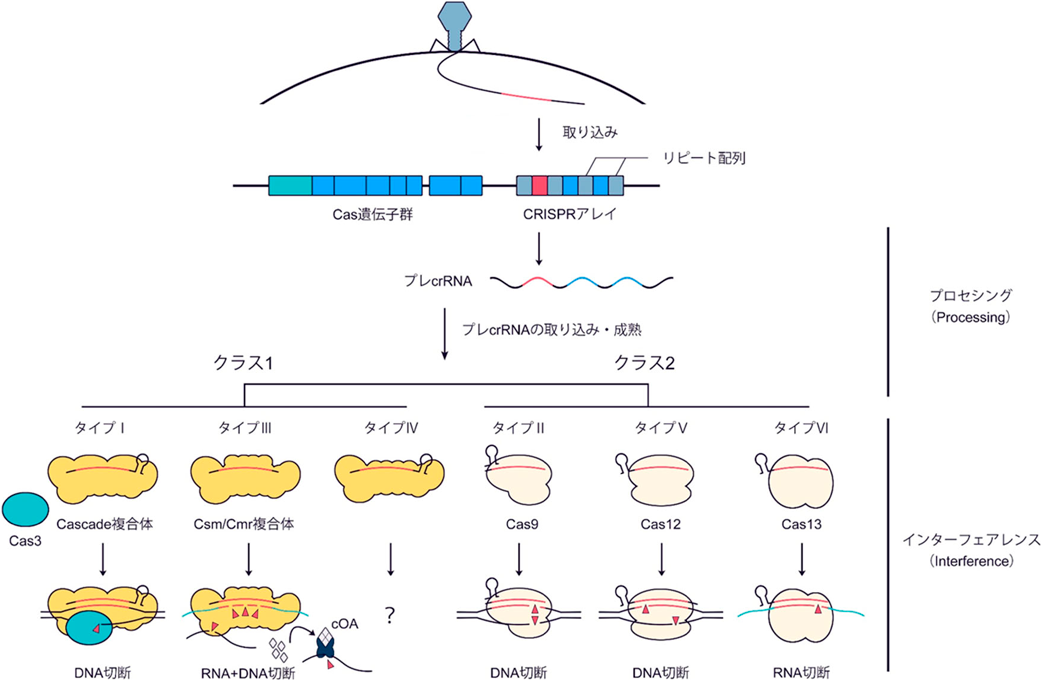
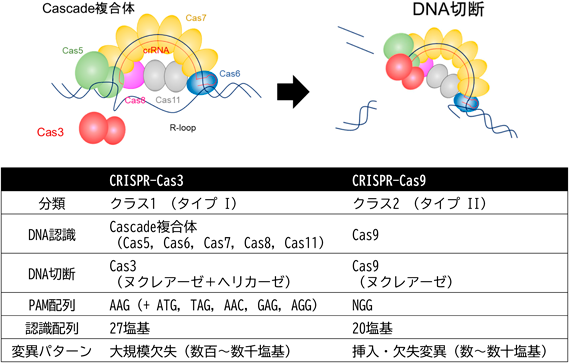
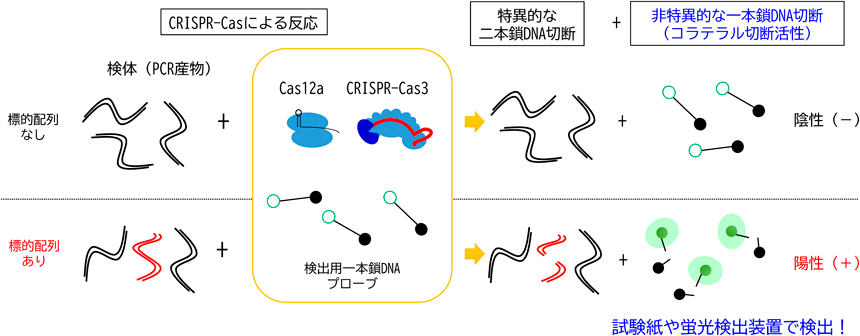
タイプI CRISPRを用いたゲノム編集技術A novel genome editing technology with a type I CRISPR system
東京大学医科学研究所実験動物研究施設先進動物ゲノム研究分野Division of Animal Genetics, Institute of Medical Science, The University of Tokyo ◇ 〒108–8639 港区白金台4–6–1 ◇ 4–6–1 Shirokanedai, Minato-ku, Tokyo 108–8639, Japan