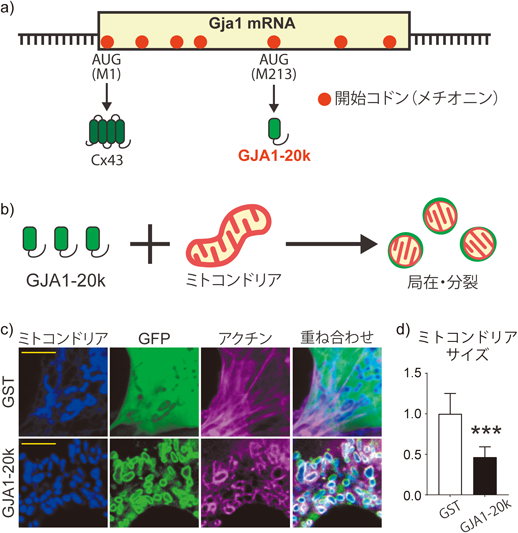
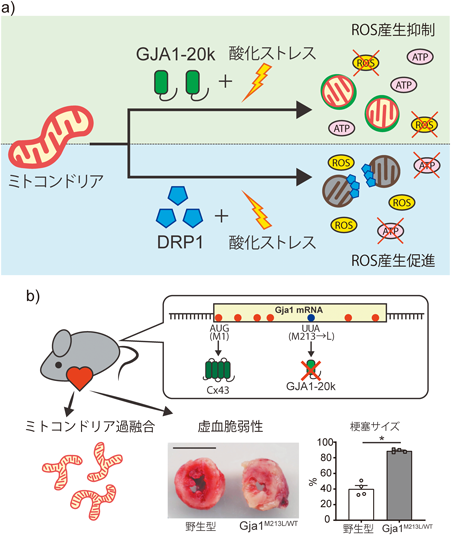
ミトコンドリアの保護的分裂を導く新たな制御因子GJA1-20kThe novel inducer GJA1-20k for playing a role in mediating the protective fission of mitochondria
1 The University of Utah School of Medicine, Department of Surgery and Nora Eccles Harrison Cardiovascular Research and Training Institute (CVRTI)The University of Utah School of Medicine, Department of Surgery and Nora Eccles Harrison Cardiovascular Research and Training Institute (CVRTI) ◇ 95 S 2000 E, Salt Lake City, Utah, 84112 U.S.A. ◇ 95 S 2000 E, Salt Lake City, Utah, 84112 U.S.A.
2 東京医科歯科大学大学院医歯学総合研究科歯周病学分野Tokyo Medical and Dental University, Graduate School of Medical and Dental Sciences, Department of Periodontology ◇ 〒113–8510 東京都文京区湯島1–5–45 10号館7階 ◇ 1–5–45, Bldg 10 Floor 7, Yushima, Bunkyo-ku, Tokyo 113–8510, Japan