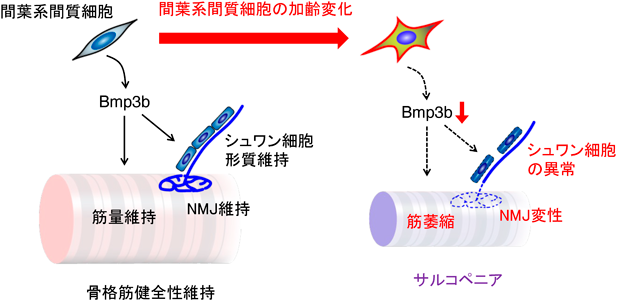
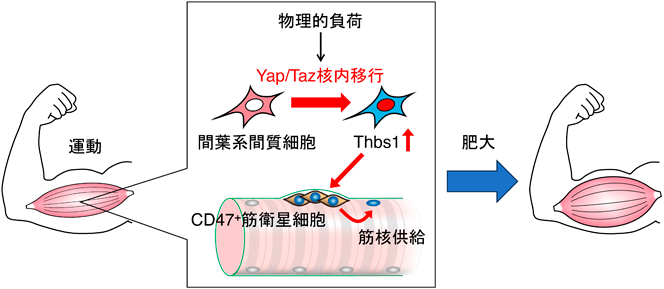
間葉系間質細胞による骨格筋組織の健全性維持機構Mechanisms of skeletal muscle health maintenance by mesenchymal stromal cells
九州大学生体防御医学研究所細胞不均一性学分野Division of Cell Heterogeneity, Medical Institute of Bioregulation, Kyushu University ◇ 〒812–8582 福岡市東区馬出3–1–1 ◇ 3–1–1 Maidashi, Higashi, Fukuoka 812–8582, Japan