昨今,さまざまながん腫で効果が証明されている抗PD-1/PD-L1抗体や抗CTLA-4抗体などの免疫チェックポイント阻害薬(immune checkpoint inhibitor:ICI)や,白血病やリンパ腫,多発性骨髄腫などに対してのキメラ抗原受容体T細胞(chimeric antigen receptor-T cell:CAR-T細胞)療法などが出現したことから,がん治療において「がん免疫療法」の重要性が注目されている.
一方で,実臨床において年単位で再発なく完治したかのように著効する症例もあれば,完全に無効,もしくは治療効果が得られていても免疫療法特有のさまざまな有害事象が強く出てしまい治療継続困難になってしまう症例を経験することも少なくない.このがん免疫療法の治療効果の違いの原因解明,および,効果予測バイオマーカーやさらに安全で効果を高める治療方法の開発が期待されている1).
近年提唱された「がん免疫編集」という概念は,がん免疫療法の効果を考える上で非常に重要である.すなわち,がん細胞は最初に異物として免疫系に非自己として判断されて排除される(「排除相」).しかし排除されなかったがん細胞が生き残ってしまい,完全には排除されないが免疫系によって進行が抑えられ臨床的にも見つかってこないような平衡状態に達する(「平衡相」).そして,最終的には免疫逃避機構により免疫系の攻撃から完全に逃避して,がん細胞にとって都合のよい腫瘍微小環境が形成されて進行増悪の経緯をたどり,臨床的ながんとして見つかってくる(「逃避相」).ICIのようながん免疫療法はこの腫瘍微小環境における逃避機構の一部を阻害して「逃避相」から逆戻しをしている治療といえる.したがって,ICIの作用メカニズムや,抗腫瘍免疫応答の本態を理解するためには,末梢血だけでなくがん細胞にとって都合のよい腫瘍微小環境,特に直接腫瘍と対峙している腫瘍浸潤免疫細胞を解析しその免疫制御機構を明らかにする必要があり,盛んに研究されている2).
腫瘍微小環境を構成する主な免疫細胞として,TおよびB細胞,マクロファージ,樹状細胞などがあげられる.また免疫細胞以外にも,がん関連線維芽細胞,血管およびリンパ管,細胞外マトリックスなどが互いに相互作用してがん細胞と関連し,不均一な集団を形成している3).不均一がゆえに,深い理解のためには組織をバルクで解析するだけでなく,1細胞レベルで解析することが重要である.
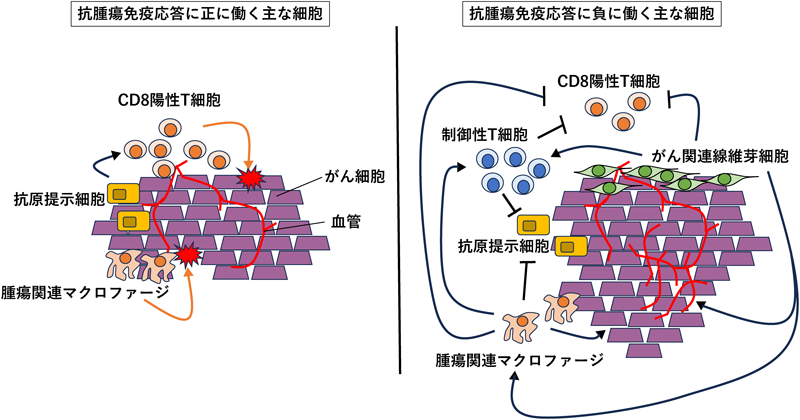
3. 腫瘍微小環境を構成する代表的な細胞の免疫制御(図1)
1)CD8陽性T細胞
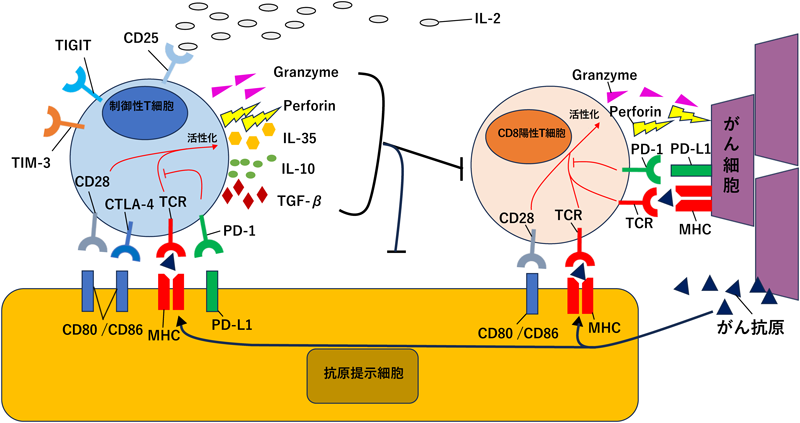
CD8陽性T細胞はがん免疫療法において非常に重要であり,がん細胞に対して直接攻撃して抗腫瘍効果をもたらすことが知られている.実際にマウスの研究でCD8陽性T細胞が除去されると腫瘍増大を来し,ICIも無効になることが知られている.CD8陽性T細胞は,がん細胞もしくは抗原提示細胞(antigen presenting cell:APC)上の主要組織適合遺伝子複合体(major histocompatibility complex:MHC)クラスIによって提示されたがん抗原をT細胞受容体(T cell receptor:TCR)で認識することによって活性化する.しかしながら,MHC/TCRシグナルだけではT細胞は活性化せず,必ずCD28などの副刺激シグナルが必要とされている.TCRシグナルとCD28などの副刺激シグナルにより活性化したCD8陽性T細胞はパーフォリン,グランザイム,Fasリガンドなどを発現しがん細胞を殺傷する.
一方で,免疫チェックポイント分子はこの過程でT細胞の活性を制御している.たとえばCTLA-4という抑制性の免疫チェックポイント分子はCD28が本来結合するべきCD80やCD86といった分子と強力に結合してしまい,CD28からのシグナルを奪ってT細胞を抑制している.また,がん細胞やAPCに発現するPD-L1は,T細胞上に発現するPD-1に結合することで主にTCRからの活性化シグナルを抑制することでT細胞を制御している.
また,慢性的な抗原刺激存在下でT細胞が機能不全状態になることを「疲弊」状態と呼ぶ.従来は慢性感染で提唱された概念であるが,腫瘍組織でも同様のことが起きるとされ,腫瘍浸潤CD8陽性T細胞は疲弊することで増殖能力が障害され,アポトーシスが進み,サイトカイン放出が減少する4).この疲弊状態にPD-1などの免疫チェックポイント分子が重要な役割を果たしている.すなわち慢性的な抗原刺激でT細胞上にPD-1などが高発現し,リガンドであるPD-L1からの抑制性の刺激が入り続けることでT細胞が機能不全に陥ってしまう.
近年の解析から腫瘍浸潤CD8陽性T細胞は,がん細胞を直接攻撃しているクローンと,攻撃していない非特異的なクローンが混在している集団であることが報告されている5).PD-1陰性のCD8陽性T細胞は間質に存在し,逆にPD-1陽性のCD8陽性T細胞はがん細胞の近くに存在しており,腫瘍浸潤PD-1陽性CD8陽性T細胞ががん細胞を直接攻撃しているT細胞であることを示唆する結果が得られている6).実際に,我々はシングルセルシークエンスにより網羅的遺伝子発現とTCR配列を同時に解析してT細胞クローンごとの詳細な表現型解析を行うことで,増殖しているT細胞クローンの中に,PD-1分子を発現している疲弊CD8陽性T細胞を同定した.このような疲弊CD8陽性T細胞クローンは実験的にも同じ患者由来のがん細胞に反応したが,一方で増殖していてもPD-1分子をあまり発現していないような非疲弊のクローンに関しては,末梢血にも大量に存在しており,がん細胞との反応性も示さなかった.したがってICIはこのがん細胞を直接攻撃しているPD-1を高発現している疲弊CD8陽性T細胞を再活性化して治療効果を発揮している治療ともいえる.
2)制御性T細胞(図2)
抗腫瘍免疫応答を担うCD8陽性T細胞とは逆に,Foxp3陽性で特徴づけられるCD4陽性T細胞である制御性T細胞(regulatory T cell:Treg細胞)は抗腫瘍免疫応答を抑制する.そのためにその浸潤が予後不良であることはさまざまながん種で報告されている.
Treg細胞はさまざまな免疫抑制機構を有している.その一つとして,Treg細胞によるIL-2の消費と考えられている.Foxp3がIL-2遺伝子の転写を抑制していることが知られており,Treg細胞自身はIL-2を産生することができない.一方でTreg細胞は豊富なIL-2受容体(CD25)を発現しており,そのためにT細胞の増殖に必要なIL-2を優先的に消費することによって結果として他のT細胞の増殖を抑制するとされている.また,Treg細胞に高発現している免疫チェックポイント分子であるCTLA-4がAPCを抑制するメカニズムも重要だと考えられている.CTLA-4はCD80やCD86と非常に強く結合するため,CD28からの副刺激シグナルを奪ってしまうだけでなく,さらにトロゴサイトーシスという作用によってAPC表面からCD80やCD86を取り込んでしまうことで,CD28からの副刺激シグナルが入れなくなってしまい,最終的に免疫抑制効果が得られると考えられている.さらにTreg細胞はIL-10, IL-35, TGF-βなどの免疫抑制系のサイトカインやグランザイム,パーフォリンの産生放出,ATPを脱リン酸化する細胞表面酵素であるCD39/37を介したアデノシン産生なども通じてT細胞抑制に関与している7).
Treg細胞が抗PD-1/PD-L1抗体治療抵抗性に関与している可能性についてはさまざまな研究が行われている.我々はフローサイトメトリーと多重免疫染色を用いて,抗PD-1抗体によりPD-1陽性Treg細胞が活性化してしまい,抗腫瘍免疫応答を抑制して,耐性もしくは逆に急激に悪化するような病態を引き起こすことを報告している8, 9).
また,抗CTLA-4抗体でも似た現象が起きる可能性を考え実験を行ったところ,CTLA-4をブロックすることで,CD80やCD86がフリーになることでCD28からのシグナルがTreg細胞にも入りやすくなり,一部のCTLA-4非依存的な抑制能が活性化してしまうことも報告している.したがって抗CTLA-4抗体はADCC(antibody dependent cellular cytotoxicity)活性によりTreg細胞を枯渇させることが抗腫瘍効果を最大限に発揮する上で重要であると考えている10).
3)その他のCD4陽性T細胞
Treg細胞以外にもCD4陽性T細胞は腫瘍微小環境には多く存在している.一般的にはヘルプの機能がCD4陽性T細胞の役割であり,たとえばPD-1陽性CXCR5陽性CD4陽性の濾胞性ヘルパーT細胞(T follicular helper cell:TFH細胞)はIL-21などを介してCD8陽性T細胞を活性化させ,抗腫瘍免疫応答に関わることが報告されている11).一方で,がん細胞の中にはMHCクラスIIを発現しているものも存在している.そのような場合にはCD4陽性T細胞が細胞傷害性CD4陽性T細胞として直接攻撃している可能性が考えられており,我々も過去にそのようなCD4陽性T細胞の存在を報告し,抑制性の免疫チェックポイント分子であるLAG-3を高発現し,抗LAG-3抗体との併用が有効であることを報告している12).実際に抗LAG-3抗体はメラノーマへの有効性が報告されており,第三の免疫チェックポイント分子として注目されている13).
4)がん関連線維芽細胞(cancer associated fibroblast:CAF)
がん細胞からのさまざまな因子によって増殖した線維芽細胞はCAFと呼ばれる.このCAFはがん細胞の浸潤増殖の促進に大きく関与している一方で,CAFは起源的にも機能的にも非常に不均一として知られている.一般的にCAFはFGF, SDF-1などの細胞成長因子を分泌することでがん細胞の増殖浸潤を促進すること,IL-6やIL-8などのサイトカインによりマクロファージの浸潤を促すこと,VEGFなどにより血管新生などを促進することなどを介して腫瘍促進につながるとされる.また,免疫抑制機構としてIL-10やTGF-βなどの多数の免疫抑制性のサイトカインを分泌すること,さらに細胞外マトリックスのリモデリングにも働くことで結果として,抗腫瘍効果に重要なCD8陽性T細胞の浸潤を減少させることも報告されている14).一方で,Meflin分子を発現する一部のCAFは抗腫瘍効果を持つ細胞として報告されている15).
5)腫瘍関連マクロファージ(tumor associated macrophage:TAM)
マクロファージは一般的に,M1(炎症促進)とM2(抗炎症)のタイプに分別されることが多いが,経験的にも単純に区別することはきわめて難しい.これまでの研究の結果からは,多くの腫瘍微小環境において,TAMは多彩なメカニズムで腫瘍を促進することが考えられている.たとえば,IL-10やTGF-βの分泌によってCD8陽性T細胞を抑制的に作用し,Treg細胞を誘導することによって免疫応答を抑制する結果につながる.また,VEGF, FGFなどといった血管新生誘導因子や細胞増殖因子を産生して,血管新生やがん細胞増殖進展を促して腫瘍促進に働く作用も知られている.血小板増殖因子であるPDGFも分泌することで,がん細胞増殖進展に働きかけることも考えられている16).