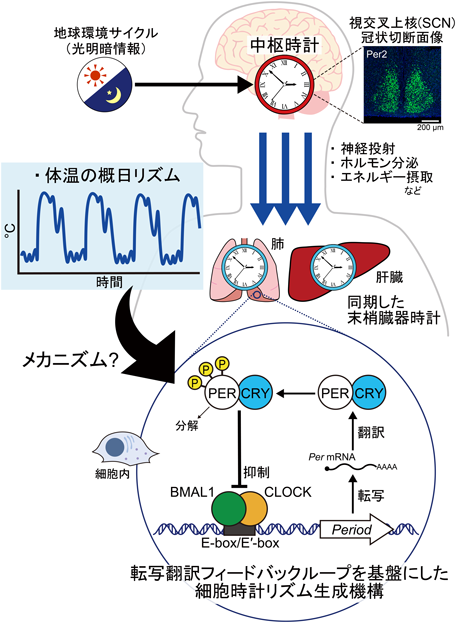
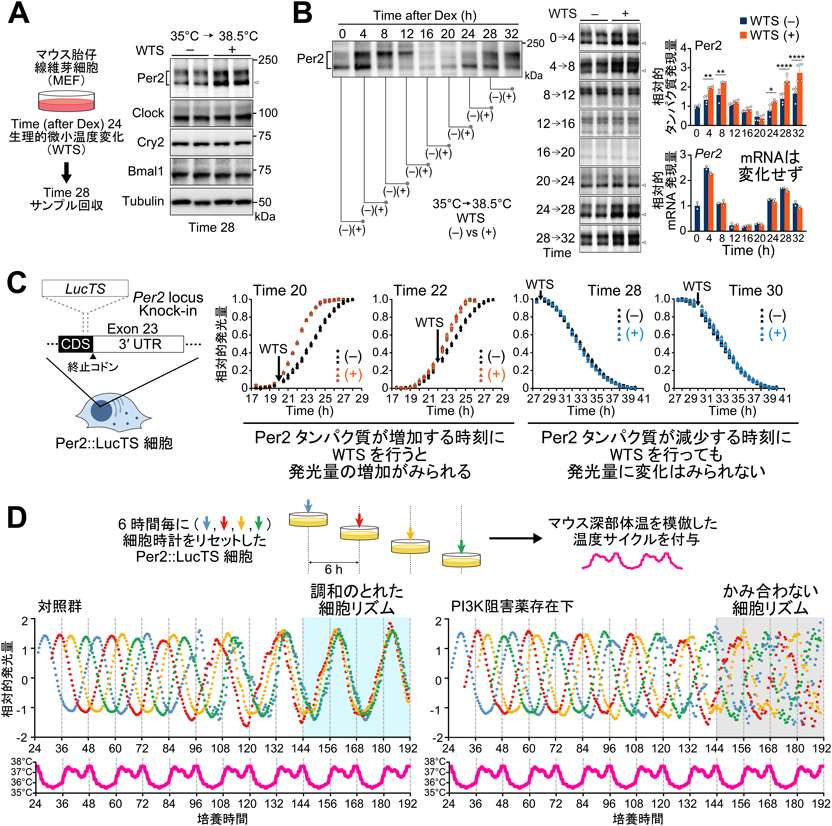
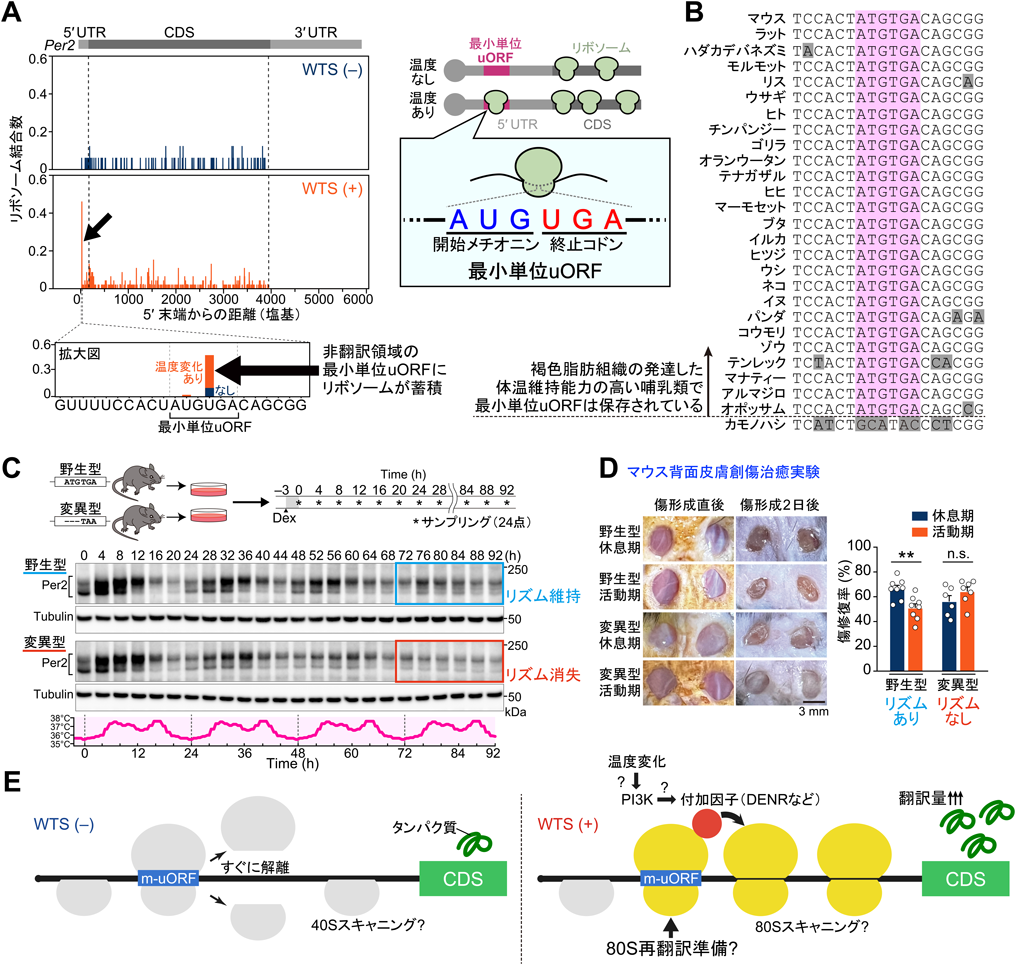
最小単位uORF翻訳を介した体内時計調律:ゆるやかな体温変動にしなやかに調和する時計の仕組みMinimal uORF-mediated mechanisms of mammalian clock adaptation to day/night physiological body temperature fluctuations
京都大学大学院薬学研究科創発医薬科学専攻システムバイオロジー分野Department of Systems Biology, Graduate School of Pharmaceutical Sciences, Kyoto University ◇ 〒606–8501 京都府京都市左京区吉田下阿達町46–29 別館4階 ◇ 46–29 Yoshidashimoadachi-cho, Sakyo-ku, Kyoto 606–8501, Japan