生化学領域において,ケトン体は,三つの代謝物質,β-ヒドロキシ酪酸,アセト酢酸,およびアセトンの総称である.古典的にケトン体は,脂肪酸のβ酸化中に形成される中間代謝物と考えられていた.しかし,ケトン体は脂肪酸とは異なる経路を通じて生成される代謝物であることが明らかとなり,その後の生理学的機能への関心を引き起こした1).特に,ケトン体は他のエネルギー供給源と比較して独特の特性を示し,絶食により血中濃度が上昇し,飢餓時の主要なエネルギー供給源となる.このエネルギー供給源としての利用は人間に限らず,他の種にも共通しており,これまでケトン体代謝はエネルギー基質としての機能解析が研究の中心であった.しかし最近になり,ケトン体そのものがシグナル伝達やエピゲノムの調節にも関与することが明らかになり,多角的な影響が強調されている2).
ケトン体の合成と分解はミトコンドリア内で行われる.したがって,ケトン体の代謝を十分に理解するためには,ケトン体の代謝とミトコンドリアの機能との関連を知ることが重要である.またケトン体は,過剰に蓄積するとケトーシスまたはケトアシドーシスを引き起こすことが知られており,糖尿病患者にとって特に懸念される合併症となる.その一方,軽度のケトン体上昇による臓器保護効果や,断食やカロリー制限によるケトーシスを健康寿命の延伸に活用しようとする臨床試験も注目されている.そこで本稿では,ケトン体代謝のミトコンドリアで起こる反応に焦点を当て,ケトン体代謝がもたらす臓器や病態への影響を概説する.
ケトン体代謝の特徴の一つが,肝臓などのケトン体産生臓器と心臓や脳などの消費臓器が明確に区別されていることである.これらの違いは,ミトコンドリア内に局在する,ケトン体産生・分解それぞれの律速段階酵素の発現によって制御される.
1)ケトン体の合成と分解経路
ケトン体の基質はアセチル-CoAである.ミトコンドリア内でまず,アセチル-CoAはアセトアセチル-CoAを形成する.その後,アセトアセチル-CoAとアセチル-CoAはヒドロキシメチルグルタリル補酵素Aシンターゼ2(hydroxymethylglutaryl-CoA synthase 2:Hmgcs2)の作用によって縮合され,hydroxymethylglutaryl-CoA(HMG-CoA)を合成する.HMG-CoAはその後,ヒドロキシメチルグルタリル補酵素Aリアーゼによってアセチル-CoAとケトン体であるアセト酢酸に変換される.アセト酢酸はさらにβ-ヒドロキシ酪酸デヒドロゲナーゼ(β-hydroxybutyrate dehydrogenase:BDH1)によって還元され,β-ヒドロキシ酪酸(β-hydroxybutyric acid:βOHB)が生成される3).ケトン体合成の中では,Hmgcs2が律速段階酵素として機能し,Hmgcs2の発現がケトン体合成を規定する因子となる.アセト酢酸とβOHBの変換は可逆的な反応であり,NADHとNAD+の酸化還元反応を伴っている.そのため,これらの平衡状態はアセト酢酸とβ-ヒドロキシ酪酸の比率およびNAD+とNADHの比率によって決定される.つまり,NADHの量が増加すると還元反応が促進され,NAD+の量が増加すると酸化反応が促進される.この平衡状態は,エネルギー供給と需要に適応し,ケトン体代謝におけるアセト酢酸とβOHBの配分を調節している.なお,アセト酢酸の一部からカルボキシ基が脱炭酸されると,アセトンが形成され,呼気中へと排出される.
アセト酢酸とβOHBの細胞間での受け渡しには,monocarboxylate transporter(MCT)などのトランスポーターが重要な働きを持つ.solute carrier family 16 member 6(SLC16A6)は,ケトン体の放出に重要な役割を果たすタイプのMCTである.ゼブラフィッシュでの機能喪失モデルの検討において,SLC16A6の欠損は肝臓でケトン体の過度な蓄積をもたらすことが示された.またヒトにおいても,重度のケトアシドーシスを繰り返す患者の遺伝子解析により,SLC16A1(またはMCT1)にフレームシフト変異が存在することが明らかになった4).
細胞に取り込まれたケトン体は再び酸化され,アセチル-CoAへと変換される.これらのケトン体の酸化に関与する酵素としてBDH1とスクシニル-CoA:3-オキソ酸CoAトランスフェラーゼ(succinyl-CoA:3-oxoacid CoA-transferase:SCOT)などがあり,BDH1は合成過程とは逆に,βOHBを酸化してアセト酢酸へと変換する.ケトン体分解固有のステップとなるのが,アセト酢酸からアセトアセチル-CoAへの変換反応で,SCOTがつかさどっている.ケトン体分解においてはSCOTを介した反応が律速段階となっており,SCOTの発現がケトン体消費の速度を規定する因子となっている.
2)ケトン体の利用とミトコンドリアの機能
ケトン体は,合成と分解の両方においてミトコンドリア内での反応を必要とする.ここでは,ケトン体の利用とミトコンドリアの機能に関して,ヒトから得られたデータに焦点を当てる.ケトン体利用率の測定法として,心臓組織内のケトン体を直接測定する方法や,同位体炭素で標識されたケトン体を分析する方法などがある.しかしながら,拍動するヒトの心臓にこれらの方法を適用することは難しい.このような制限のある中で有用な方法の一つが,心臓カテーテル検査中に得られる血液検体を利用した測定法である.心臓カテーテル検査中に,特殊な形状のカテーテルを用いることで,大動脈基部の動脈血と冠静脈洞の静脈血を採取することが可能である.冠静脈洞は,心臓内を循環した大部分の血液が灌流する静脈であるため,大動脈基部の動脈血と冠静脈洞の静脈血を比較することで,心臓内で産生・消費された物質を検討することが可能となる.ミトコンドリア機能との関連については,乳酸産生の程度を評価することで,嫌気性代謝の亢進の有無を評価することができる.我々は,ミトコンドリアの機能がケトン体の利用に与える影響を明らかにするために,虚血性心疾患の患者を対象として,カテーテル検査時にケトン体と乳酸を測定した.通常心臓内を循環する過程で,3割ほどのケトン体が消費されるが,心筋虚血が生じて乳酸産生が亢進するような状態では,ケトン体消費量が1割程度まで低下し,虚血が緩和されると利用率が迅速に回復することが観察された5).この結果は,ミトコンドリア内での好気的代謝がケトン体の利用にとって重要であることを示している.
ケトン体の利用率は,虚血性心疾患以外の病態でも変化することが知られている.ミトコンドリアの機能が低下することが知られる糖尿病では,ブドウ糖と乳酸の利用率が低下する一方,心臓でのケトン体の利用率は増加する6).さらに,網羅的手法を用いて心臓の代謝物の産生と消費を調べた研究では,心機能の低下した状態においてケトン体の利用率が増加していることが示された7).著しく嫌気代謝が亢進した状態と異なり,ミトコンドリア機能の低下した状態ではケトン体の利用率が増加する点は興味深い.エネルギー基質として,代謝産物の酸素利用とエネルギー生産効率を比較した検討では,ケトン体は単位分子あたりブドウ糖よりもATPをより多く生成する一方,脂肪酸と比較して酸素の消費が少ないことが知られ,軽度から中等度のミトコンドリア機能が障害された状況において,有用なエネルギー基質となりうる可能性が示唆されている.
3)ケトン体の合成とミトコンドリアの機能
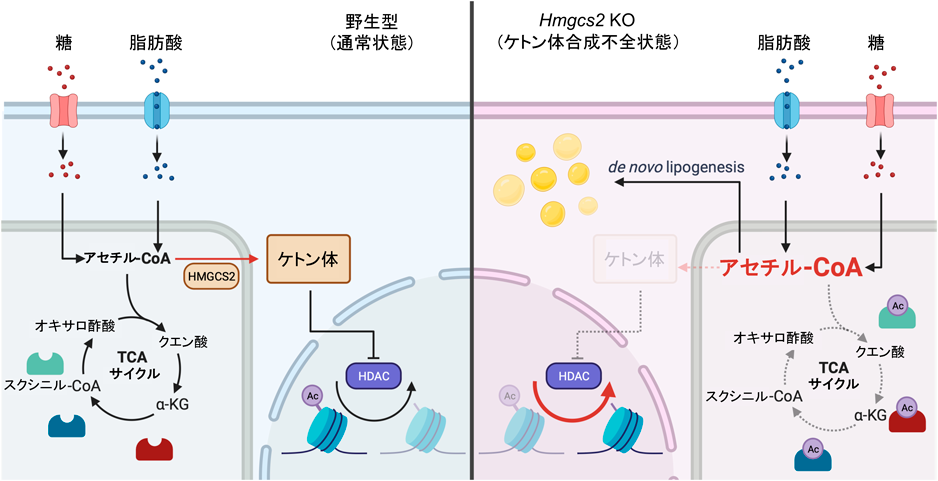
ケトン体の合成は,他の臓器にケトン体を供給する役割に加えて,多面的な役割を果たすことが明らかになっている.Hmgcs2は肝細胞だけでなく,腎臓の近位尿細管や腸の幹細胞でも発現しているが,腸では腸幹細胞で産生されるβOHBが,ヒストン修飾を介してNOTCHシグナルを制御し,幹細胞機能を維持する8).また腎臓では,ケトン体が糖尿病性腎症モデルにおいてmTORC1の過剰な活性化を抑制することにより,腎臓の保護効果を発揮する9).そうした中で我々は,ケトン体合成の生理的な意義を解明するために,ケトン体合成の制限速度酵素であるHmgcs2のノックアウトマウスモデル(Hmgcs2 KO)を作成した.興味深いことに,Hmgcs2 KOマウスはケトン体を合成することができないにもかかわらず生存可能であり,飢餓耐性を持つ.進化的にも,ゾウやイルカなどの一部の種は,進化の過程でHmgcs2を失っており,飢餓時におけるエネルギー供給源としてのケトン体は,必ずしも必須ではないかもしれない10).
一方で,Hmgcs2 KOマウスは,出生後に脂肪肝の急速な進行を示す.単離肝細胞を用いた検討では,Hmgcs2 KO由来の肝細胞では酸素消費が減少することが確認され,ケトン体の合成不全によりミトコンドリア機能が低下することが示された.メタボロミクス解析により原因を検討した結果,クエン酸サイクルの中間代謝産物が減少している一方で,基質となるアセチル-CoAの濃度はHmgcs2 KOでむしろ上昇していることが確認された.アセチル-CoAの蓄積とクエン酸サイクル代謝産物低下の関連を検討するため,介在酵素の翻訳後修飾に注目してアセチル化プロテオミクス解析を実施した結果,Hmgcs2 KOマウスではクエン酸サイクルの介在酵素を含めたミトコンドリアタンパク質に過度なアセチル化修飾が加わっていることが明らかとなった.すなわち,ケトン体合成の障害により細胞内でアセチル-CoAが蓄積すると,ミトコンドリアタンパク質の過度なアセチル化が生じ,クエン酸サイクルにおける酵素連続反応が抑制される.これらの一連の研究結果は,ケトン体合成自体が細胞内での過剰なケトン体蓄積を和らげ,ミトコンドリア機能を保護する役割を果たすことを示した(図1)11).
ケトン体合成によるミトコンドリア保護作用は,病態にも密接に関連する.非アルコール性脂肪性肝疾患(non-alcoholic fatty liver disease:NAFLD)および非アルコール性脂肪性肝炎(non-alcoholic steatohepatitis:NASH)は,ミトコンドリア機能の異常と密接に関連する12).ミトコンドリア局在遺伝子の発現パターンを比較した研究では,Hmgcs2の発現がNAFDLと比較してより重症なNASHにおいて減少していることが示された13).成熟マウスに対するHmgcs2のアンチセンスオリゴヌクレオチドを用いた研究でも,高脂肪食により誘導されるNAFLD/NASH病態がケトン生成の障害によって増悪することが示された14).また逆に,ケトン生成を強化することで,過剰なアセチル-CoAの蓄積を緩和し,ミトコンドリアタンパク質の機能を改善することが期待される.ケトン体合成の強化を活用した手法は,NAFLD/NASHの治療においても調査されている.アデノウイルスベクターを用いた強制発現実験において,肝臓でHmgcs2の発現を増強することが異所性脂肪堆積の有意な減少につながることが示された15).Hmgcs2の機能増強を目的とした創薬治療も期待されるが,間接的にケトン生成を誘導する方法として,食事療法が注目されている.食事療法には,総カロリーの制限や空腹日の設定による断食療法などがあるが,ヒトにおいても600 kcal/日の摂取日と制限のない食事日を交互に繰り返す「Alternative day fasting」を行うことで,体重減少,脂肪肝の改善,インスリン感受性の向上,肝障害マーカーの低減が示されており,今後さらなる解析が期待されている.
本稿では,ケトン体代謝の合成経路と分解経路の両方から,ケトン体代謝の多面的な効果と,ミトコンドリアに及ぼす影響について概説した.長らく絶食時のエネルギー供給源として認識されてきたケトン体であるが,エネルギー供給源としての役割を超えてさまざまな効果を有することが期待されている.一方で,ケトン体が過度に蓄積するケトアシドーシスと呼ばれる状態は,体に対して悪影響を及ぼすことが明らかであり,ケトン体代謝を利用した介入方法を考えるには,慎重なエビデンスの積み重ねが不可欠である.これは薬理学的アプローチだけでなく,ケトン体代謝を誘導する絶食やカロリー制限などの手法にも当てはまり,適切なケトン体代謝の調整方法を理解することは,健康と寿命を促進するための社会的な取り組みにおいて重要である.