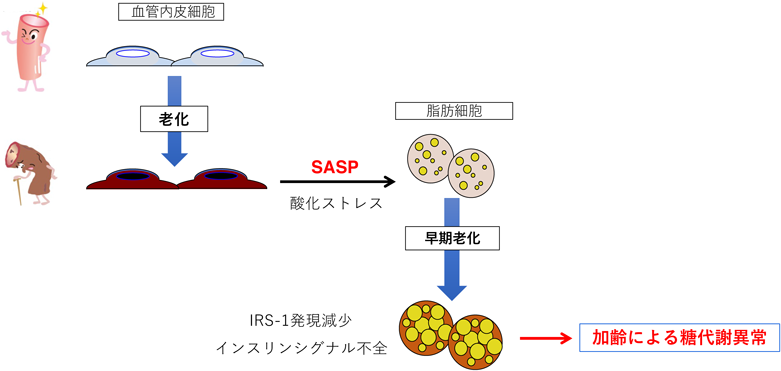
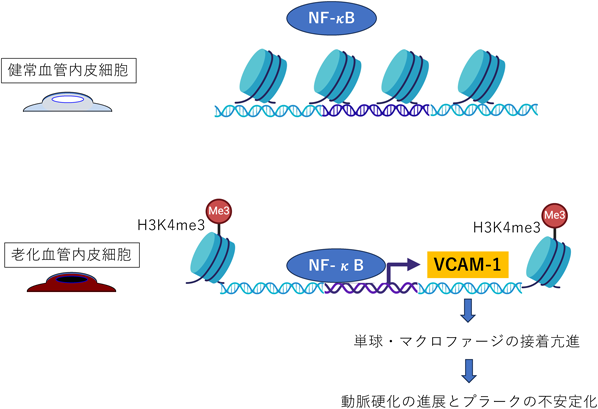
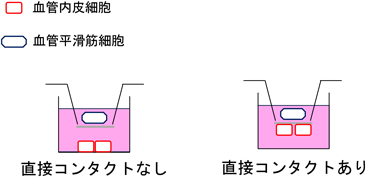
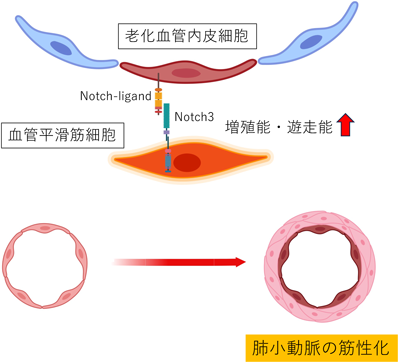
血管内皮細胞老化と老化関連疾患の関わりA role of endothelial cell senescence in aging
京都府立医科大学長寿・地域疫学講座Department of Epidemiology for Longevity and Regional Health, Kyoto Prefectural University of Medicine ◇ 〒602–8566 京都市上京区河原町通広小路上る梶井町465 ◇ 465 Kajii, Kawaramchi-Hirokoji, Kamigyo, Kyoto 602–8566, Japan