染色体工学技術は,染色体を“移す”技術,“切る”技術,“つなぐ”技術からなり,細胞や動物のゲノム情報を染色体(Mb)スケールで改変することができる.そのため,従来技術では解析が困難な長大な遺伝子(ジストロフィン遺伝子,抗体重鎖軽鎖遺伝子)や,複数の遺伝子が集約した遺伝子クラスター(薬物代謝酵素関連遺伝子クラスター),反復配列(セントロメア)の研究に用いられてきた1–3).また,原因が染色体レベルまで絞り込まれている疾患の責任領域をさらに絞り込む研究にも活用されている.
1)染色体を「移す」
a.微小核細胞融合法
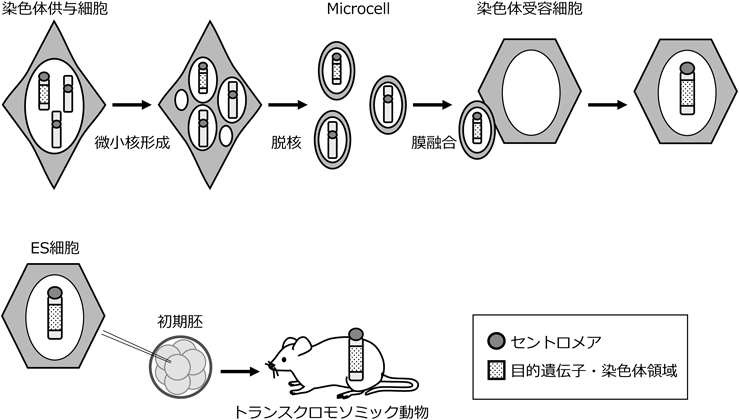
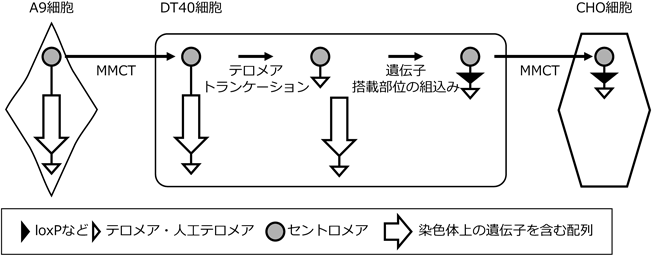
細胞どうしを人工的に融合させる全細胞融合法は,センダイウイルス,ポリエチレングリコール,電気パルスなどによって膜融合を誘発することで行われる.この人工的な細胞融合によって得られるハイブリッド細胞では,核も融合する場合がほとんどであり,2種に由来するゲノム情報を保持することになる.この全細胞融合技術は,抗体産生細胞であるB細胞と自律増殖能を持つミエローマ細胞を融合させたハイブリドーマのように,研究・医療・産業に対して多大な貢献をしてきた.一方,特定の染色体やその一部の領域に着目した研究を推進する場面においては,ゲノム情報すべてを移す全細胞融合法ではなく,任意の染色体のみを移入する手法が必要となる.そこで,特定の染色体のみを細胞から細胞へ「移す」際に有用な微小核細胞融合(microcell-mediated chromosome transfer:MMCT)が開発された.MMCTでは,全細胞融合でも利用される細胞膜どうしの融合と核の融合を利用する点は同様だが,膜融合をする前の染色体供与細胞に操作を行うことで,保持するゲノム情報が染色体1~数本となった微小核細胞にする点が特徴である.
染色体供与細胞に微小管の重合阻害剤コルセミドや脱重合阻害剤パクリタキセルを作用させると,有糸分裂期(M期)に凝集した染色体の娘細胞への分配が正常に行われなくなり,それぞれの染色体が赤道面に整列できず,散らばった状態となり,分裂期チェックポイントの条件を満たせずに細胞周期がM期で停止する.この停止は,細胞分裂が正常に行われるための監視機構であり,異常な細胞はここで排除されるが,マウスA9細胞,チャイニーズハムスターCHO細胞,ニワトリDT40細胞など一部の細胞株では,M期の離脱が起こり,強引に細胞周期が進行する.すると,細胞質中に散在する染色体の周囲に核膜がそれぞれ形成され,染色体が1~数本入った小さな核(微小核)を形成する4).このように微小核を形成させた染色体供与細胞を,アクチン重合阻害剤サイトカラシンBで処理しながら高速遠心を行うと,サイトカラシンBの脱核作用と遠心力によって微小核が細胞膜に包まれた状態で飛び出し,微小核細胞(microcell)を作製できる5).
細胞融合に先立った以上の微小核形成処理と脱核操作を染色体供与細胞に施すことで,細胞融合に必要な構成要素を持ちながらゲノム情報が染色体1~数本となる微小核細胞を取得できる.これを全細胞融合法と同様に融合させれば,特定の染色体のみを移入できる(図1,上段)6–8).
b.MMCTを用いた応用研究
MMCTが確立された1970年代には9, 10),個々の遺伝子を細胞に導入し機能を検証する形質転換手法が確立され,がん遺伝子やがん抑制遺伝子などもいくつか見つかってきた.しかし,ゲノム上に数万近くある遺伝子から,効率よく目的遺伝子を見いだすには,よりシステマティックな手法が必要とされていた.このため,まずヒト正常線維芽細胞に薬剤耐性遺伝子を導入し,染色体にランダム挿入されたプールが作製された.そして,この細胞をA9細胞と全細胞融合し,さらにA9細胞へMMCTして薬剤選択することで,薬剤耐性遺伝子が挿入されたヒト染色体を1本だけ持つモノクロモソーマルハイブリッド細胞ライブラリーが作られた11).このモノクロモソーマルハイブリッドライブラリーは,Y染色体を除いたすべてのヒト染色体が網羅されており,これを用いた染色体導入実験から,染色体単位での機能検証と,目的遺伝子の探索システムが確立された12).
c.染色体改変動物
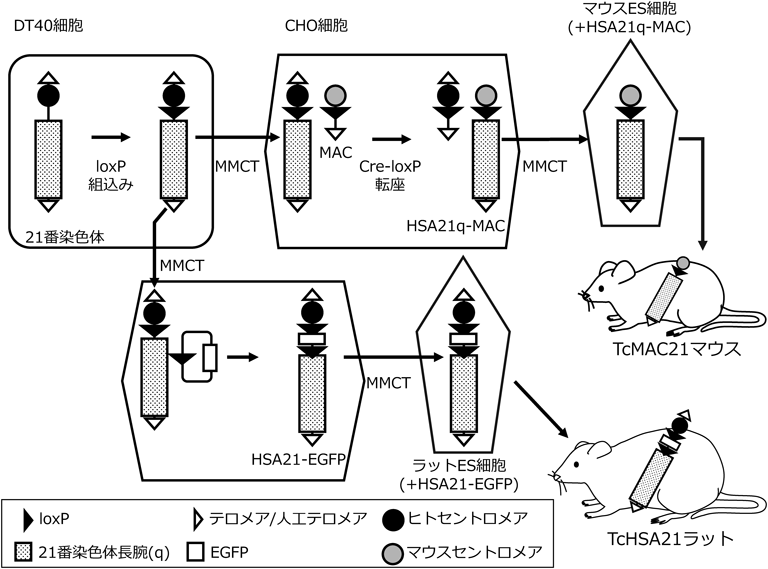
MMCTを用いて染色体をマウスなどの胚性幹(embryonic stem:ES)細胞へ導入できる13).初期胚へ移植したES細胞は胚発生の過程で分化し,初期胚の細胞とともにキメラ個体を形成する.このように外来染色体を導入することで作製される動物は,遺伝子導入(transgenic:Tg)動物と区別して染色体導入(trans-chromosomic:Tc)動物と呼ぶ.マウスやラットのようにES細胞が樹立されている種では外来染色体を導入してTc動物を作製することが可能であるが,キメラ形成能・子孫伝達能があるES細胞が樹立されていない動物種の場合,クローン技術を活用できる種であれば,外来染色体を導入したTc動物を作製することが可能である.多細胞生物の生命現象は複数の細胞どうしが協働して表現型として現れることから,培養細胞を用いた解析に加えて動物実験による解析も行うことはきわめて重要である.Tc動物は染色体スケールでゲノム情報を導入しているため,遺伝子機能だけでなく,その遺伝子がいつ・どこで・どのくらい発現するのかという遺伝子発現制御情報も再現される利点がある(図1,下段).
2)染色体を「切る・つなぐ」
a.Cre-loxP
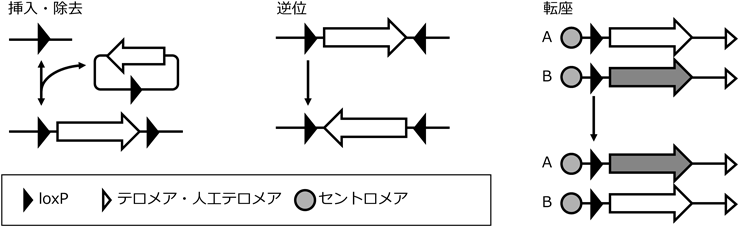
染色体の数的異常や大規模な欠失・転座のような染色体レベルの構造異常は,ダウン症候群,ターナー症候群,クラインフェルター症候群のような先天性疾患やがんの発症・悪性化に関連する.これらの疾患の原因究明やモデル作製には,染色体構造を大規模に改変する技術が要求される.Cre-loxP組換えは,loxPと呼ばれるDNA配列を認識するCre組換えタンパク質によって,二つのloxP配列が組み換わる仕組みを利用した遺伝子工学技術である.つまり,染色体上の任意の領域を除去,あるいは,逆位にしたいときは,二つのloxP配列を図2のように配す.組換えは同一染色体上に限らず,異なる染色体間でも誘導できるので,異なる染色体上にloxP配列を配することで,狙った染色体どうしを組み換える,すなわち,転座させることができる14).
b.テロメアトランケーション
テロメアは,直鎖状染色体の末端部に存在するDNAとタンパク質の複合体であり,脊椎動物ではTTAGGGという配列が直列に数kbの長さで繰り返した反復構造をとる.テロメアDNA上にシェルタリンと呼ばれるタンパク質複合体が集合し,末端部がDNA損傷部位として認識されないように保護している.一方,DNA末端部分ではラギング鎖の複製を完全に行うことが難しく,複製ごとに100~200 bpずつ末端配列が失われるとされ,テロメア配列も例外ではない.しかし,この配列に相補的に結合するテロメアRNAを鋳型として,テロメラーゼと呼ばれる逆転写酵素がリーディング鎖側のテロメア反復配列を伸長して染色体末端部のラギング鎖複製を助け,その長さが保たれる.このテロメア末端保持機能が失われると,テロメア配列が短縮し,やがてはシェルタリン複合体の結合を失い,染色体末端がDNA損傷部位と認識され細胞は増殖を停止する.興味深いことに,ヒトの多くの体細胞ではテロメラーゼの活性はほとんどなく,初代培養細胞は有限回の分裂の後増殖できなくなるが,テロメラーゼ遺伝子を強制発現させると,その上限を超えて300回以上も分裂を続けられる.このテロメア機能は,人工的に作製したテロメア配列上でも働くことが知られており,これを利用したテロメアトランケーションと呼ばれる染色体工学技術も開発されている.具体的には,染色体腕上の標的配列を含んだDNA断片とマーカー遺伝子,テロメア配列を含んだカセットを細胞に導入すると,標的配列との相同組換えにより標的部位に挿入される.セントロメア側からみてカセット挿入部位より外側の配列は,セントロメアを失い分配されなくなるため,細胞内から消失する15).このような手法を活用すれば,さまざまな腕の長さを持つ染色体シリーズを作製することが可能であり,特定の染色体を切り詰めていくことによって,染色体上の責任遺伝子を同定することにも活用され,がん抑制遺伝子や細胞老化誘導因子,テロメラーゼ抑制因子など,疾患などの表現型に関与する染色体領域の同定につながっている16–18).また,このような染色体の短縮化において,DT40細胞は,特に高い相同組換え効率を持つ.このため,目的染色体をDT40細胞に導入し,テロメアトランケーションを行い,また他の細胞に導入するといった形で,染色体編集のプラットフォーム細胞として用いられてきた.CHO細胞中でゲノム編集技術を活用することでDT40細胞を使用しない方法も開発されている15).
3)ヒト/マウス人工染色体ベクター(human/mouse artificial chromosome:HAC/MAC)
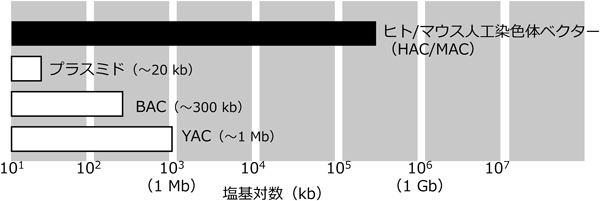
HACには,ヒトセントロメアDNAを用いて作製されるボトムアップ型と,天然染色体の遺伝子領域をすべて除去し天然セントロメアを残存させて作製されるトップダウン型がある.従来ベクターであるプラスミド,細菌人工染色体(bacterial artificial chromosome:BAC),酵母人工染色体(yeast artificial chromosome:YAC)と比較して,ボトムアップ/トップダウン型HACおよびMACは共通して以下のような特徴を持つ(図3).
- Mbスケールの長鎖DNAを安定に保持でき,エンハンサーやトポロジカルドメイン構造も含めた発現制御領域を遺伝子とともに搭載することで,強制発現では確認できない宿主の生理的発現制御を再現できる.強制発現で再現できる遺伝子機能は,転写・翻訳産物であるRNAやタンパク質の機能であるが,生理的発現で再現される遺伝子機能は,転写・翻訳産物がいつ・どこで・どのくらいの強度で機能するのかという情報も含むため,より高次な現象として解析できる.
- 内在の他の染色体とは独立して維持され,細胞分裂に伴って複製分配される.従来ベクターは哺乳類細胞内では複製分配されず,宿主ゲノムから独立した状態では細胞分裂に伴って数が半減し,均一な機能解析が行えない.この問題を回避するためには宿主ゲノムへ組み込む必要があるものの,挿入部位とその周辺のエピジェネティックな環境によって発現量が変化・サイレンシングする問題,コピー数の制御が困難な問題が残る.宿主ゲノムから独立して維持されるHAC/MAC上の遺伝子は上記問題を克服している.本項では筆者らが構築を進めてきたHAC/MACについて述べる.
a.ボトムアップ型HAC
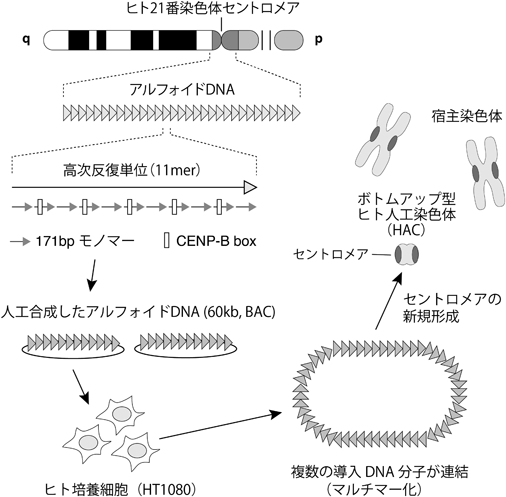
染色体の維持にその均等分配機構は非常に重要で,これが失われると生物は致死となる.セントロメアはこの分配機能を担う特殊なクロマチン構造であり,セントロメア特異的なヒストンH3バリアントであるCENP-Aタンパク質の他,多数のセントロメア特異的なタンパク質群が細胞周期を通してこの上に集合している.また分裂期には,セントロメアクロマチン上にキネトコアタンパク質複合体が集合し,微小管との相互作用を介して染色体を均等分配する.このセントロメアのDNA配列は,ヒトではアルフォイドDNAと呼ばれる高頻度反復配列であり,171 bpのアルフォイドモノマーが複数組み合わさった数kbの反復単位(high order repeat unit:HOR unit)が,0.5~数Mbの長さまで均一に繰り返す構造をとる.この長大な反復中でセントロメア特異的なタンパク質が集合している領域はおおよそ100 kb前後と考えられ,残りの領域はヘテロクロマチンで占められる.このセントロメアDNA配列をヒトHT1080細胞に導入すると,導入DNAが複数つながった数Mbスケールのマルチマーが形成される.そして,このマルチマーの一部にセントロメアクロマチンが新規形成されると,導入DNAは分配機能を獲得し,宿主染色体とは独立に安定分配される.このような,導入DNAから作られる染色体をボトムアップ型HACと呼ぶ(図4).
ボトムアップ型HACの利点は,導入DNAを自由にデザインできる点にあり,これを用いてさまざまな変異体も作製できる.これにより,新規セントロメア形成に必要な配列(セントロメアタンパク質の一つであるCENP-Bが結合する配列:CENP-B box)などが明らかにされている19).さらにloxP配列のような遺伝子導入部位を相同組換えによって組み込むことで,2節3)項記載の特徴を持つ発現ベクターとして活用できるボトムアップ型HACも作製している20).
b.トップダウン型HAC
トップダウン型HACに必要な要素は,染色体分配に必要なセントロメアと複製に必要な複製起点,末端を保護するテロメア配列であり,それ以外の領域はすべて除去可能である.このため,21番染色体のみを保持するモノクロモソーマルハイブリッドをDT40細胞へMMCTで移入し,テロメアトランケーションを施すことで,染色体腕部の大部分を除去したミニ染色体を作製できる.このように,21番染色体のセントロメアとそこに含まれる複製起点以外の領域を削除し,loxP配列を搭載したミニ21番染色体(トップダウン型HAC)を構築した(図5)21).
c.マウス人工染色体ベクター(MAC)
ヒト染色体やヒト人工染色体ベクターを用いたマウスの解析から,ヒトセントロメアを持つ染色体はマウス細胞内での分配安定性が低いことがわかってきた.これは,染色体の複製分配に重要なセントロメア配列の違いが原因と考えられる.この課題を克服し,一般的な実験動物であるマウスで人工染色体ベクターを保持させるために,マウスのセントロメアを保持する新たな哺乳類人工染色体ベクターが必要と考えた.そこでマウス10番染色体・11番染色体から作製したトップダウン哺乳類人工染色体ベクターがMACである.作製方法や特徴はトップダウン型HACと共通しており,期待どおりにマウスの細胞の中でも非常に安定なため,人工染色体を用いたTcマウス作製のスタンダードとして利用されている22, 23).
4)トップダウン型HAC/MACへの遺伝子搭載方法
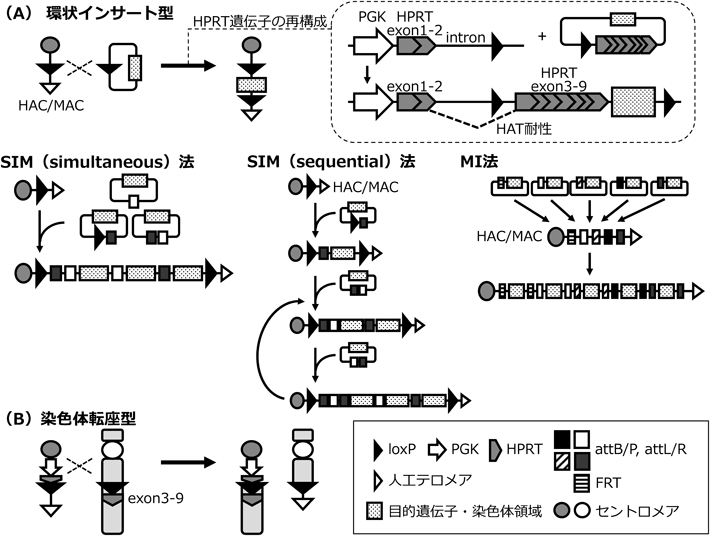
トップダウン型HAC/MACへの遺伝子(群)搭載には,遺伝子導入部位の組換え配列を活用する,環状インサート型と染色体転座型がある.
a.環状インサート型(図6A)
環状インサート型では,環状ベクターであるプラスミド,PAC, BAC, YACを活用できるという利点がある.トップダウン型HAC/MAC上には,loxP配列とともにPGKプロモーターとヒトヒポキサンチンホスホリボシルトランスフェラーゼ(hypoxanthine phosphoribosyltransferase:HPRT)遺伝子のエキソン1–2が搭載されている.環状ベクター上にloxP配列とヒトHPRT遺伝子のエキソン3–9を組み込み,組換えタンパク質Cre発現ベクターとともにトップダウン型HAC/MAC保持細胞へトランスフェクションすることで,トップダウン型HAC/MAC上のloxP配列と環状ベクター上のloxP配列が組み換わりトップダウン型HAC/MAC上に搭載される20, 21).このとき,ヒトHPRT遺伝子が再構築され,ヒポキサンチン-アミノプテリン-チミジン(hypoxanthine-aminopterin-thymidine:HAT)に対する薬剤耐性を獲得するため,正しくトップダウン型HAC/MACに環状ベクターが組み込まれた細胞を薬剤選抜することができ,目的外の部位へ環状ベクターがランダム挿入された細胞と区別して取得することができる.トップダウン型HAC/MACの遺伝子導入部位にはloxPタイプ以外にもセリン型部位特異的組換えタイプ(attBとattPの組換え,組換え後にattLとattRが生じる)もあり21, 22, 24),一度に3種類の環状ベクターを同時に搭載できるsimultaneous integration of multiple gene-loading vectors(SIM)法や複数の環状ベクターを,再構成される薬剤を順次切り替えながら一つずつ搭載していくsequential integration of multiple gene-loading vectors(SIM)法25),5種類の環状ベクターを順次搭載していくmulti-integrase(MI)法26, 27)も開発され,搭載したい環状ベクターの数や特性に応じて使い分けている.このような複数の環状ベクターを搭載する技術は,複数の遺伝子の協働によって機能が発揮される現象を再現するHAC/MACを構築する上で有用である.
b.染色体転座型(図6B)
染色体転座型では,従来の環状ベクターでは保持できないMbスケールの領域をトップダウン型HAC/MAC上へクローニングできる.クローニングしたい領域を持つ染色体をDT40細胞へ導入し,標的部位へloxP-ヒトHPRT(エキソン3–9)を相同組換えによって挿入する.改変した染色体をトップダウン型HAC/MAC保持CHO細胞へ導入し,Cre発現ベクターをトランスフェクションすることで,トップダウン型HAC/MAC上のloxP配列と目的染色体上のloxP配列が組み換わり,所望の染色体領域をトップダウン型HAC/MACに転座させることができる28, 29).
ここまで,染色体工学を取り巻くさまざまな技術を概説した.本節ではその染色体工学技術を活用することによって我々のグループが行ってきた基礎研究から応用研究までの取り組みを紹介する.
1)セントロメア活性制御と人工染色体汎用化
染色体の安定維持に必須なテロメア・セントロメアタンパク質の多くは,脊椎動物で高度に保存されている.テロメアのDNA配列TTAGGGも脊椎動物間で保存されており,ヒトテロメア配列は,他の脊椎動物でも機能する.このようなことから,脊椎動物間では異種生物の染色体を細胞内で維持することが可能になっていると考えられる.一方,セントロメアのDNA配列は種によって大きく異なり,別々の進化を遂げてきた.なぜ,異なるセントロメア配列でもその上のセントロメア機能や染色体が維持されるのか.それはセントロメアクロマチンがあるところに新しいセントロメアタンパク質を補充するという,セントロメアのエピジェネティックな維持機構に手がかりがあると考えられる.おそらく,高度に保存されたセントロメアタンパク質どうしには種間でも保存された相互作用が存在するため,前の種の細胞で獲得したセントロメアタンパク質の集合を元に,新しい種の細胞のセントロメアタンパク質が集合し補充されることで,少しずつ新しい種のセントロメアとして構成タンパク質が入れ換わりながら機能していると考えられる.このような入れ換わり機構の動作原理を理解すれば,それを利用して導入した染色体の安定性を高め,MMCTで染色体導入できる種の範囲を広げることもできると考えられる.この一つの要素として,セントロメアクロマチン上のヒストン修飾がその活性に与える影響と,その制御法を紹介する.
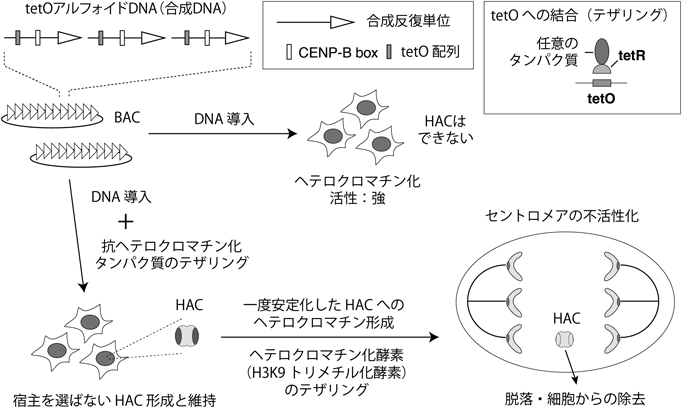
ボトムアップ型HACには天然のセントロメアにはない配列も人工的に付与できる.たとえば,テトラサイクリンリプレッサータンパク質(tetracycline repressor:tetR)は,テトラサイクリンオペレーター(tetracycline operator:tetO)配列に結合することが知られているが,このtetOをアルフォイドDNAの反復単位に埋め込むことで,tetRを介して任意のタンパク質をこの上に結合させることができる.セントロメアクロマチン上におけるセントロメアタンパク質群の集合は,通常の遺伝子発現制御と同様に,周囲のクロマチン構造によっても制御を受けている.たとえば,通常,アルフォイドDNA上のヘテロクロマチン化(H3K9トリメチル化修飾)活性の強い細胞では,セントロメアクロマチンやHACを新規形成させることはできないが,ヘテロクロマチン化を弱めるアセチル化酵素を,tetRを介してアルフォイドDNA上に結合させる(テザリングする)と,セントロメア形成が起こるようになる.このようにセントロメアクロマチン形成の起こりやすさを人為的に操作することで,宿主細胞の持つクロマチン修飾活性にかかわらずHACを形成させることが可能になった(図7)30).また逆に,アセチル化酵素のテザリングにより形成されたHAC上のセントロメアクロマチンは,テザリングを止めてもエピジェネティックな機構により自律的に維持されることがわかっているが,逆の働きを持つH3K9トリメチル化酵素と融合したtetRをテザリングすることで,この維持機構を停止させることもできる.維持機構を停止したセントロメアは,セントロメア・キネトコアタンパク質の集合が減少してゆき,不活性化する.セントロメアを不活性化されたHACは,染色体分配機構から脱落し,最終的に細胞内から除去されるため,一度導入したボトムアップ型人工染色体を人為的に細胞から取り除く手段としても応用できる(図7)31).今後,このような手法をより最適化することで,脊椎動物と非脊椎動物間や,動物と植物間などの種間の壁を越えることができる,より万能な人工染色体ベクターの開発が期待される.
2)間葉系幹細胞を用いた筋萎縮性側索硬化症治療
筋萎縮性側索硬化症(amyotrophic lateral sclerosis:ALS)は,日本では10万人あたり2人が発症する指定難病で,手足の筋肉や呼吸に必要な筋肉が次第に動かせなくなる疾患である.筋ジストロフィーのような筋肉に原因のある疾患とは異なり,筋肉を制御する神経に原因を持つ神経変性疾患で,脊髄/大脳皮質運動ニューロンの細胞死によって発症する.進行を遅延する対症療法以外の治療法がないため根治療法が望まれている.これまでに,ALSの新規治療法として疾患部位への幹細胞移植や神経栄養因子の投与の効果が検証され,幹細胞移植は動物実験において神経細胞の補充や細胞死抑制効果が示されている.神経栄養因子の投与は,グリア細胞由来神経栄養因子(glial cell line-derived neurotrophic factor:GDNF)やインスリン様成長因子1(insulin-like growth factor-1:IGF-1)の投与が有効であることが動物実験で示され,肝細胞増殖因子(hepatocyte growth factor:HGF)の投与も臨床研究が開始されている.一方で,神経栄養因子の投与は持続性が低く,1か月に数回の髄腔内注入を必要とするため,患者への負担が大きいだけでなく,タンパク質製剤である神経栄養因子の生産コストの高さの問題も残されている.我々は,移植する幹細胞が神経栄養因子GDNF, IGF-1, HGFを安定かつ持続的に産生するよう改変することで,1回の幹細胞移植で長期間の治療効果を得る方法の開発を試みた.
まず,神経栄養因子HGF, GDNF, IGF-1とレポーター(Emerald luciferase:E-Luc)からなる遺伝子カセットをCre-loxPシステムによってトップダウン型HAC上に搭載し,このトップダウン型HACを不死化ヒト間葉系幹細胞(human immortalized mesenchymal stem cell:hiMSC)に導入したHAC-MSCを樹立した.次に,HAC-MSCの治療効果を検証するために,ALSモデルマウスの第四脳室に移植し,治療効果を解析した.その結果,通常のMSCの移植と比較して,HAC-MSCを移植したALSモデルマウスは発症までの期間と生存期間を延長した.一方で,HAC-MSCの移植ではHAC-MSCが生着せず,治療効果が限定的であることも明らかとなった32).そこで,HAC-MSCをシート状に培養し,シート化HAC-MSCを移植することでHAC-MSCが生着し,治療効果を増強できることを明らかにした33).トップダウン型HACに搭載された遺伝子は,ゲノム中に挿入された遺伝子とは異なりサイレンシングや発現量の不安定化が生じず,ヒト細胞の中で安定に維持され娘細胞にも分配されるというトップダウン型HACの特徴を活用した応用例といえる.
3)筋ジストロフィー治療法の開発(図8)
デュシェンヌ型筋ジストロフィー(Duchenne muscular dystrophy:DMD)は,X染色体上のジストロフィン(dystrophin:DYS)遺伝子の変異により筋繊維膜直下のDYSタンパク質が欠損することで生じる難病である.不可逆的な筋力の低下を主訴とし,損傷した筋肉の再生が行われないことに起因する.現在,特定のエキソンを欠損した患者に限って使用できるビルトラルセンが開発されているものの,根治を可能とするものではなく繰り返し投与が必要であることが大きな課題である.骨格筋および平滑筋へ分化可能な体性幹細胞である中胚葉系血管芽細胞(mesoangioblast:MAB)は,動脈内投与によって血管壁を通過し炎症部位に集積することが知られ34),DMDでは損傷した筋組織で炎症が起きているため,DMDモデル動物にMABを投与することでその有効性が示されている.ヒトではHLA一致ドナー由来MABを用いた臨床試験が進行しているが35),多様性に富むHLAの型が一致するドナーと患者の奇跡的なマッチングを期待する必要がある.また,正常な遺伝子を補充することや修復することによる治療法も検討されているものの,巨大遺伝子として知られるDYS遺伝子(全長約2.4 Mb, 79のエキソン)への変異は患者によってさまざまで,すべての患者を網羅する治療戦略はなかった.そこで,長大な遺伝子も扱うことができる染色体工学技術を用いて,患者由来幹細胞へ正常DYS遺伝子を補充し患者に戻すex vivo治療による根治療法を模索した.
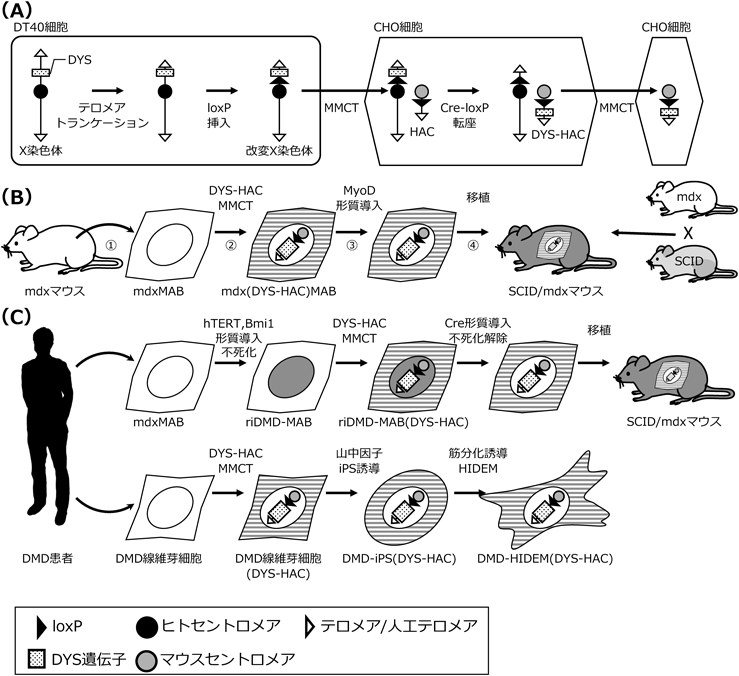
まずDT40細胞内でX染色体上のDYS遺伝子のセントロメア側にloxP配列を,テロメア側に人工テロメア配列を相同組換えで挿入し,HAC保持CHO細胞へ導入した.次にHAC上のloxP配列とX染色体上のloxP配列で転座を誘導し,正常DYS遺伝子全長を保持するDYS-HACを構築した(図8A)1).
次に患者由来MABを用いたex vivo治療のモデル実験を行った.DMDモデルマウス(mdxマウス)由来MABを樹立し(図8B-①),DYS-HACを導入することでmdx(DYS-HAC)MABを作製した(図8B-②).さらに筋分化制御因子MyoDを形質導入(図8B-③)した細胞を,重度複合免疫不全(severe combined Immunodeficiency:SCID)マウスとmdxマウスを交配したSCID/mdxマウスの大腿動脈へ移植した(図8B-④).SCID/mdxマウスの筋組織では,ヒトDYSタンパク質を発現する筋組織や骨格筋の組織幹細胞である筋サテライト細胞を確認できた.また,mdx(DYS-HAC)MAB非移植SCID/mdxマウス群に比べて運動機能が向上,SCIDマウス群と同程度まで回復し,その効果は8か月以上持続した36).
DYS-HACを導入する治療コンセプトをマウスで示すことができたが,MABが体細胞であることから移植するための細胞を大量に調製することが難しいという課題が残っている.そこで,可逆的に体細胞に無限増殖能を付与する不死化遺伝子カセットの開発を行った.Cre-loxPシステムによって除去可能な不死化遺伝子カセットloxP-hTERT[ヒトテロメラーゼサブユニット逆転写酵素遺伝子(human telomerase reverse transcriptase)],loxP-Bmi1(Bmi1 polycomb ring finger oncogene)をDMD患者由来のMAB(DMD-MAB)へ形質導入し,可逆的不死化(reversible immortalized)DMD-MAB(riDMD-MAB)を作製した.次に,riDMD-MABにDYS-HACを導入したriDMD-MAB(DYS-HAC)を作製し,大量培養ののちCreの一過性発現によって不死化遺伝子カセットを除去した上で,SCID/mdxマウスへ移植した.riDMD-MAB(DYS-HAC)は筋組織へ生着し,ヒトDYSタンパク質の発現を確認した(図8C上段)37).
さらに,無限増殖能を持ち容易に大量の細胞を用意できる利点があるiPS細胞を活用することでも上記課題の克服ができないか検討を進めた.まず,DYS遺伝子のエキソン4–43を欠損するヒトDMD患者由来の繊維芽細胞にDYS-HACを導入し,山中因子を用いてDMD-iPS(DYS-HAC)を作製した.DMD-iPS(DYS-HAC)は非薬剤選抜条件下で50回継代しても90%以上の細胞でDYS-HACが維持され,薬剤選抜ができない生体への移植後も機能的であることが示唆された38).さらに,ヒトiPS細胞由来MAB(human iPS cell-derived mesoangioblasts:HIDEM)分化法により,DMD-iPS(DYS-HAC)からDMD-HIDEM(DYS-HAC)を作製し,筋分化誘導によって正常なヒトDYSタンパク質を発現する筋繊維へと分化することを確認した(図8C下段)39).以上の実験から,DYS-HACを利用して患者由来のMABやiPS細胞を用いたDMD根治療法となるex vivo治療への可能性が示された.
4)セーフガードシステム
本節2)項や3)項で紹介したような細胞由来の細胞医薬品や再生医療の開発は近年特に注目されている.このような細胞製剤は,患者自身由来の細胞から作製した自家細胞を用いたものと,患者以外の人の細胞から作製した他家細胞を用いたものがある.自家細胞は,移植時に拒絶反応を伴わない安全面の優位性がある一方で,細胞の用意[①患者からの細胞の取得,②iPS細胞の樹立,③治療に必要な細胞の改変(遺伝子導入・分化誘導),④大量培養]が必要である.これには多大な時間・経費コストを要し,すべての患者で自家細胞移植治療を施すことは難しい.他家細胞は,あらかじめ③治療に必要な細胞の改変,④大量培養ができるため,コスト面の改善を見込めるものである一方で,移植時の拒絶反応という課題が残っている.拒絶反応の原因にはHLAハプロタイプの不一致,移植片対宿主病がある.京都大学iPS研究所の進めるHLAホモドナー由来iPS細胞プロジェクトによって,他家由来細胞であってもHLAが一致する細胞を選んで利用することができる.また,HLA不一致による拒絶反応への寄与が大きいHLA遺伝子をすべて破壊し,ハプロタイプのレパートリーが少ないHLA-Cのみを残存させ,HLAホモドナー由来iPS細胞ライブラリーの充足率を格段に改善する方法も開発されている40).このように,拒絶反応に対する課題は徐々に克服されつつある.また,自家細胞や他家細胞を用いて作製された治療用細胞は,その過程で生じる遺伝子変異や核型異常がないか,分化が不十分な未分化細胞が残存していないか,などの品質チェックが行われる.遺伝子変異や核型異常,未分化細胞の混入は,移植した細胞のがん化を引き起こすため,細胞製剤の安全性を脅かす要素である.遺伝子変異や核型異常は全ゲノムシークエンスや核型解析によって検出できるが,その後の大量培養過程での異常は見過ごすことになる.未分化細胞を選択的に除去する方法に未分化細胞の表面抗原を利用した細胞分種技術や,代謝の違いを利用した技術が開発されている.ただし,この未分化細胞除去技術もさらなる改良が求められている.自殺遺伝子ヘルペスウイルスチミジンキナーゼ(herpes simplex virus-thymidine kinase:HSV-Tk)やiCaspase9は,移植片対宿主病の発生や腫瘍化に備えたセーフガードシステムとして注目され,細胞医薬品への応用が進められている41, 42).しかし,それらのシステムは移植細胞をすべて死滅させ治療の中断を余儀なくするもので,患者へ投与する自殺誘導薬剤自体の副作用についても課題を残している.以上の問題を解決するために,未分化細胞や腫瘍化細胞を選択的に死滅させるセーフガードシステムの開発を行った.
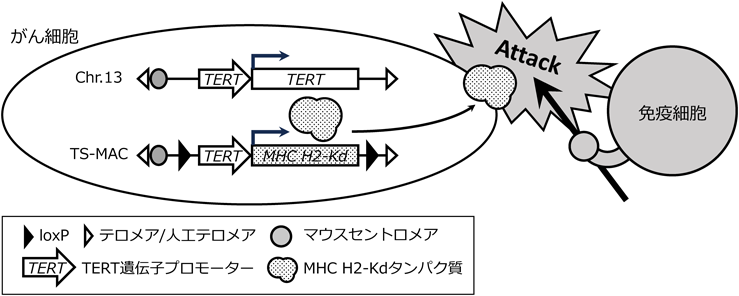
未分化細胞および腫瘍化細胞で特異的に活性化されるhTERTの発現制御領域と,高抗原性タンパク質(MHC H2-Kd)を結合した遺伝子カセットを作製した.この遺伝子カセットをMAC上に搭載し(TS-MAC),がん細胞であるC57BL6/L由来メラノーマ細胞に導入した.続いて,コントロールあるいはTS-MAC保持メラノーマ細胞を,それぞれ同系統C57BL6/Jマウスに移植したところ,コントロールメラノーマ細胞の生着率83%に比べてTS-MAC保持メラノーマ細胞の生着率は17%であり,有意に生着能力を喪失した.これは,メラノーマ細胞のTERT活性によってMAC上のMHC H2-Kdが発現し,宿主免疫によって排除されたことを示している(図9)43).このような腫瘍化リスクを抱える細胞を細胞製剤中から特異的に除去可能なセーフガードカセットをHACに搭載することで,安全性の高い細胞医薬品の開発が可能になる.
5)ダウン症モデル動物
ダウン症は,ヒト21番染色体全長または一部が3本になることで,発達遅滞,特徴的顔貌,心奇形,消化器系疾患,甲状腺機能低下症,眼疾患,難聴などを併発する先天性疾患である.発生率が1/600~1/800と先天性染色体異常症としては高頻度であるものの,21番染色体上のどの遺伝子がどの症状に関連しているのかは明らかになっていないために根治療法がなく,患者ごとの症状に合わせた対症療法が行われてきた.この治療法や治療薬の開発が遅れていた背景には治療薬開発・評価の要となるモデル動物作製の困難性があった.単一遺伝子や少数の遺伝子を原因とする疾患では,Tg動物を作製することができる.一方,21番染色体が過剰になるダウン症では,そのすべての遺伝子を導入したTg動物を作製できない.モデル動物として頻繁に用いられるマウスやラットでは,ヒト21番染色体に相当する染色体領域が複数の染色体に分布するため,ダウン症を自然発症せず,染色体領域の部分重複などによってヒト21番染色体トリソミーに相当するモデル動物を作製することは容易ではない.我々は染色体工学技術を活用することで,ヒト21番染色体をマウス・ラットに導入し,疾患原因の探索,治療薬の評価が可能なダウン症モデルマウス・ラットの作製に取り組んだ.
a.ダウン症モデルマウス
ヒト染色体は一般的にマウス細胞では不安定なため,ヒト21番染色体を全身組織に高頻度で保持したTcマウスの作製は難しい.そこで,マウス細胞で安定なMACにヒト21番染色体を搭載することでこの問題を克服した.ヒト21番染色体は長腕(HSA21q)のみをMACへ搭載することで,ヒト21番染色体上のほとんどの遺伝子を搭載することができる.まず,A9モノクロモソーマルハイブリッドのヒト21番染色体をDT40細胞へ導入し,長腕の最もセントロメアに近い領域を標的としてloxP配列を組み込んだ.これをMAC保持CHO細胞へ導入し,Creを発現させることでMAC上に搭載した.このHSA21q-MACをマウスES細胞に導入し,ダウン症モデルマウス(TcMAC21マウス)を作製した(図10)28).
TcMAC21マウスでは,ヒト21番染色体上の遺伝子が組織特異的に発現し,ダウン症特有の表現型が確認された.また,21番染色体上の213遺伝子のうち199遺伝子(93.4%)のトリソミー化に成功しており,従来のダウン症モデルマウス(Tc1)の158遺伝子(74.2%)を大幅に上回った.さらに,TcMAC21は全身の臓器で安定に維持されており,Tc1の抱えていたマウス内でのヒト染色体の不安定性によるモザイク性の課題も克服できた28).このようにTcMAC21マウスは,従来のモデルマウスに比べてダウン症モデルマウスとして適していると考えられ,諸症状に対応する原因遺伝子の解明や症状改善のための治療法,治療薬開発において有用な研究資材となると期待される.
b.ダウン症モデルラット
これまでに作製されたダウン症モデル動物はマウスのみであったが,ダウン症モデルマウスで再現された表現型は部分的だった.マウスに比べて複雑な神経回路を構築するラットは,記憶学習などの解析にも頻用され,神経変性疾患であるパーキンソン病モデルやハンチントン病モデルでは,マウスモデルに比べてラットモデルの方がより正確にヒト病態を再現する側面もある44, 45).これは,ラットの脳発生がマウスよりもヒトに近いためと考えられており,ダウン症のモデルにおいてもラットを用いることで,マウスモデルよりもダウン症の表現型を再現できると考えた.ヒト染色体はラット細胞内で安定であるため,ヒト21番染色体全長(HSA21)を保持するTcラットの作出が可能である.つまり,TcMAC21マウスが保持しない短腕上の遺伝子も導入することになり,よりヒトのダウン症表現型を反映したモデルとなりうる.はじめに,DT40細胞内のヒト21番染色体にloxP配列を組み込み,CHO細胞へ導入した.このloxPサイトに,EGFPを組み込みHSA21-EGFPを作製した.これをラットES細胞にMMCTで導入し,ダウン症モデルラット(TcHSA21ラット)を作製した46).
TcHSA21ラットはTcMAC21マウス同様に心室中隔欠損症などの先天性心奇形,小脳の萎縮などの脳の形態学的異常,頭部顔面骨格異常,血液学的異常,記憶学習能力の低下が確認された.さらに,小脳の萎縮に加えて小葉の分岐形成が低下していたこと,記憶学習能力の低下の他に不安様行動と過活動を同時に示したことは,これまでのダウン症モデルマウスでは報告がなく,TcHSA21ラットがマウスよりもヒトダウン症の表現型をよく反映したモデルといえる証左である46).このように,ダウン症モデル動物として最適と考えられるTcHSA21ラットを用いることで,さまざまな症状に対する原因遺伝子の解明や種々の症状改善のための治療法,治療薬開発に貢献するとともに,より複雑で高度な神経回路を形成可能なラットの特性を活かし,ダウン症候群の脳病態のメカニズム解明にも活用されることが期待できる.
6)完全ヒト抗体産生マウス
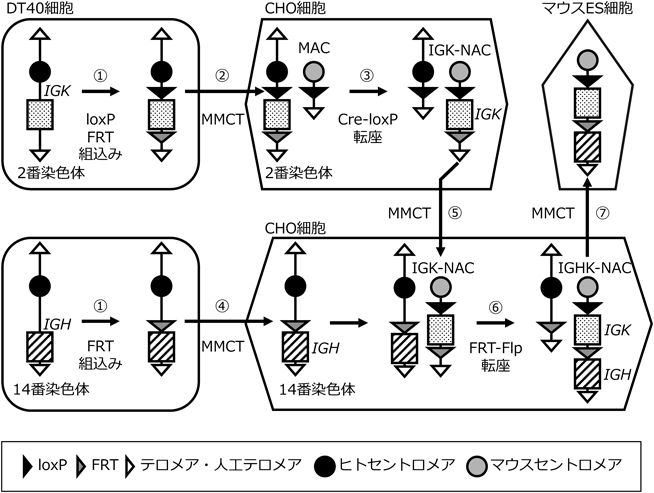
モノクローナル抗体による抗体医薬品は,この20年で医療への貢献度が急速に高まったタンパク質製剤で,がんや神経変性疾患など多様な疾患に対して開発が進められている.抗体医薬品の開発では,抗原に特異的に結合して治療効果を発揮する機能性と,ヒトへ投与した際の安全性が重要である.抗体医薬品シーズの探索は,マウスに抗原を免疫して得られる抗原特異的抗体を産生するB細胞を,自律増殖能を持つミエローマ細胞と融合したハイブリドーマ作製によって行われる.この他にヒト抗体遺伝子由来の配列を起点としたヒトドナーライブラリーを用いるファージディスプレイ法による抗体取得方法も開発されている.繰り返し抗原を免疫したマウス由来のB細胞を活用できるハイブリドーマ法は,マウス生体機能によるよりよい抗体の選抜が行われることからも,古典的な方法でありながら今でも最もよく用いられるモノクローナル抗体取得手法である.ただし,ハイブリドーマ法で取得されるマウス抗体は,そのままヒトに投与すると外来抗原として認識され副作用の原因となる.この安全性の問題を克服するために,マウス抗体遺伝子の大部分をヒト抗体遺伝子に置き換えるヒト化技術が開発されている.抗体の抗原認識に特に重要なcomplementarity determining region 3(CDR3)を残し,他のアミノ酸配列をヒト配列に置換して作製されるヒト化抗体は,日米欧で上市されている116品目の抗体医薬品の53品目を占めており(2022年3月19日時点),最もポピュラーとなっている47).一方で,このヒト化抗体の作製過程では,マウス抗体の時点では結合力や機能などの薬効が認められた抗体でも,ヒト化によって結合力や機能性が損なわれる場合がある.さらに,わずかに残るCDR3がマウス由来であるために,副作用が生じる可能性も残る.これらの課題は,すべてのアミノ酸配列がヒトであるヒト抗体をハイブリドーマ法から直接取得できれば解決できる.抗体遺伝子はその莫大な多様性を生み出すためにきわめて長大で,ヒトの抗体遺伝子も免疫グロブリン重鎖(immunoglobulin heavy chain:IGH)1.5 Mb,免疫グロブリンκ鎖(immunoglobulin kappa chain:IGK)2 Mbとなっている.この大きさの遺伝子は従来のTg動物作製において長大な領域の導入に用いられてきたBAC(<300 kb)でも扱えない.そこで,Mbスケールの染色体断片をMACへ搭載する技術を活用し,ヒトIGHとIGK(3.5 Mb)を保持するマウスを作製した.
IGHを持つヒト14番染色体とIGKを持つヒト2番染色体をそれぞれ保持するDT40細胞を用い,IGHの上流とIGKの下流にFRT配列を,IGKの上流にloxP配列を組み込んだ(図11-①).まず2番染色体をMAC保持CHO細胞へ導入し(図11-②),2番染色体短腕のIGKからテロメア側をMACに転座搭載した(IGK-NAC)(図11-③).続いて,14番染色体をDT40細胞からCHO細胞へ移入し(図11-④),そこへIGK-NACを導入した(図11-⑤).ここで14番染色体とIGK-NACのFRT配列どうしで相互転座することでIGHK-NACを作製できる(図11-⑥).その後IGHK-NACをマウスES細胞へ導入し(図11-⑦),作製されたマウスがIGHK-NACマウスである.このIGHK-NACマウスをマウス抗体遺伝子IghとIgkをノックアウトしたHKLDマウスと交配することで,マウス抗体の代わりにヒトの抗体を産生する完全ヒト抗体産生マウス(Tc-mAbマウス)の作製に成功した29).Tc-mAbマウスを免疫すると,マウス抗体の代わりにヒト抗体が産生されるため,従来どおりTc-mAbマウス由来のハイブリドーマをスクリーニングすることで機能性と安全性が高い抗原特異的ヒトモノクローナル抗体を取得できる29, 48).