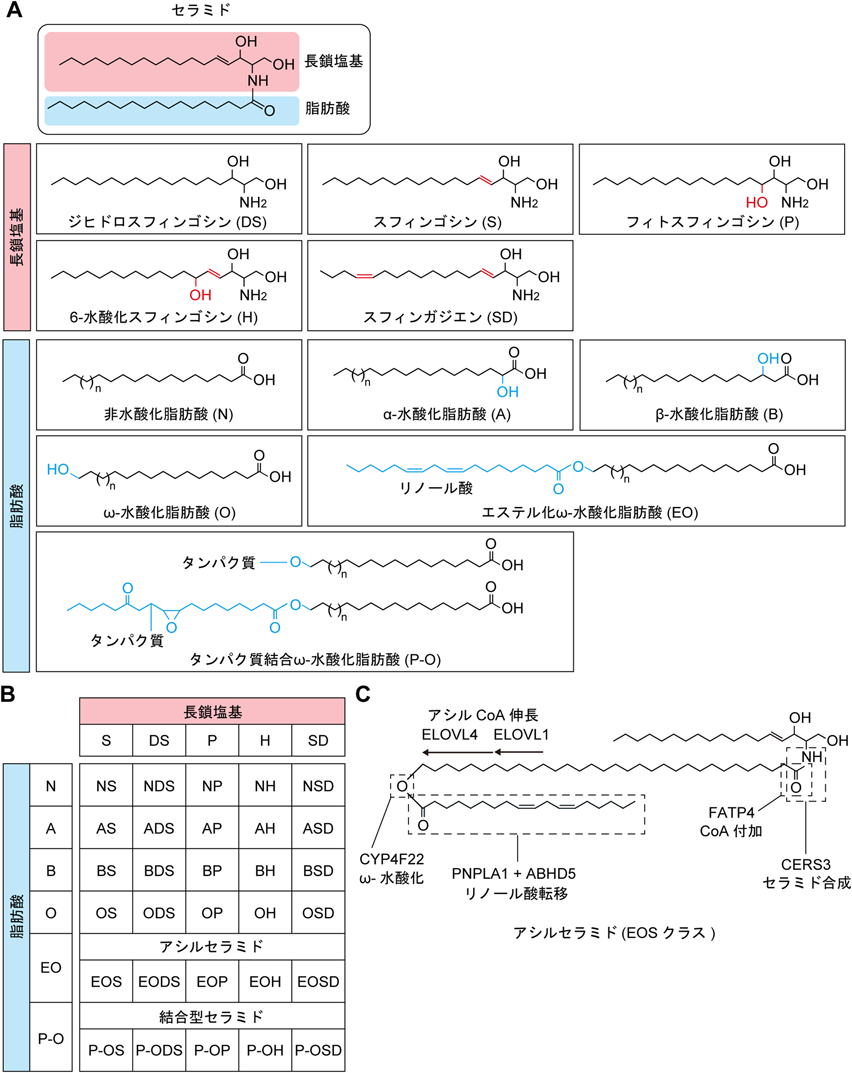
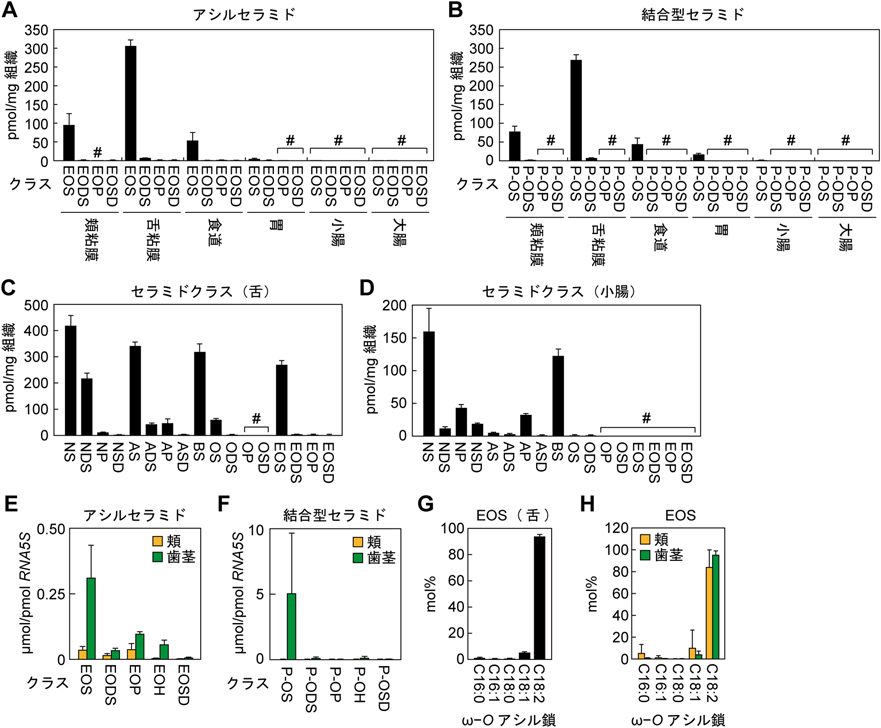
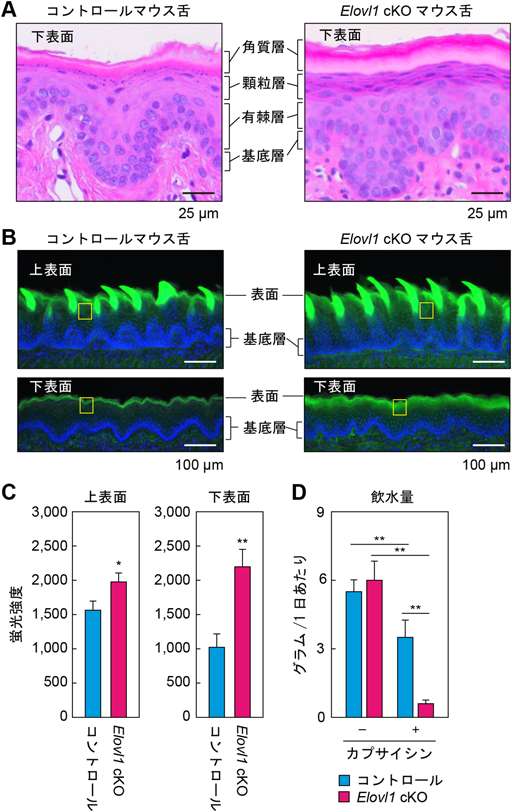
口腔バリア機能における長い炭素鎖を有するセラミド分子種の重要性Importance of ceramides containing very-long-chain fatty acids in oral barrier function
北海道大学大学院薬学研究院Laboratory of Biochemistry, Faculty of Pharmaceutical Sciences, Hokkaido University ◇ 〒060–0812 北海道札幌市北区北12条西6丁目 ◇ Kita 12-jo, Nishi 6-chome, Kita-ku, Sapporo, Hokkaido 060–0812, Japan