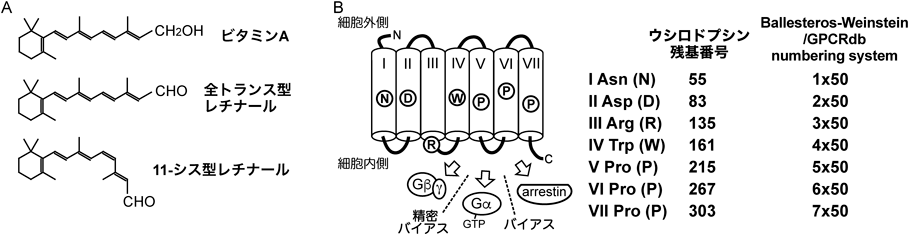
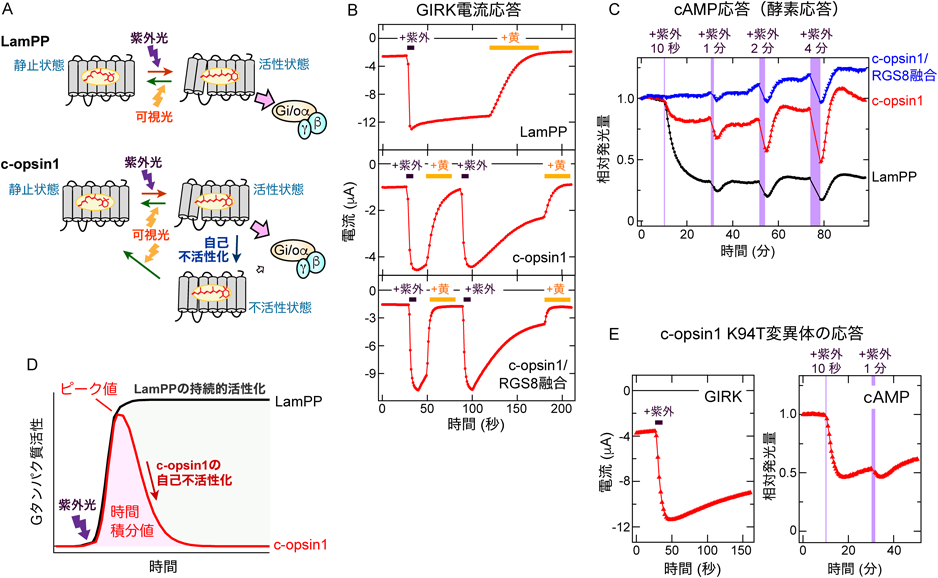
自己不活性化する光感受性GPCRを利用した「精密バイアス光操作ツール」の開発Development of a “finely-biased” optical control tool using a self-inactivating photosensitive GPCR
1 神戸大学大学院理学研究科生物学専攻Department of Biology, Kobe University ◇ 〒657–8501 兵庫県神戸市灘区六甲台町1–1 ◇ 1–1 Rokkodai-cho, Nada-ku, Kobe, Hyogo 657–8501, Japan
2 神戸大学次世代光散乱イメージング科学研究センターCenter of Optical Scattering Image Science, Kobe University ◇ 〒657–8501 兵庫県神戸市灘区六甲台町1–1 ◇ 1–1 Rokkodai-cho, Nada-ku, Kobe, Hyogo 657–8501, Japan