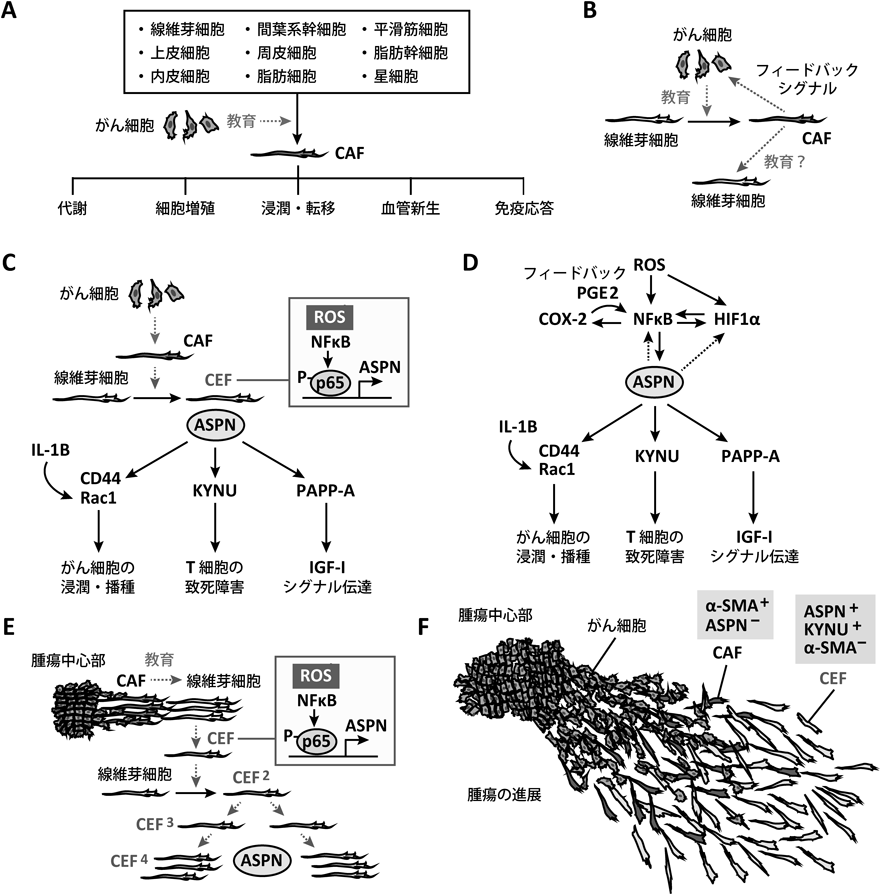
がん細胞の周囲に存在する細胞は,がんを増進させる異質な細胞へと分化する.たとえば,がん細胞近辺の線維芽細胞はがん関連線維芽細胞(cancer associated fibroblast:CAF)へと分化し,組織深部へのがん浸潤に働くことが知られている1).
がん細胞から分泌されるサイトカイン・ケモカインや細胞外小胞は,間質細胞のリプログラミング効果を持つ.リプログラム後の間質細胞は細胞外マトリックスのリモデリング,血管新生,免疫抑制などのがん微小環境の形成に積極的に働くため,その周囲でのがん細胞の運動性や増殖が亢進され,転移・播種を増大させる2).がん間質に含まれる線維芽細胞,マクロファージ,好中球などは注目される研究対象であり,がん細胞とこれら間質細胞群で展開される相互作用シグナルが急速に解明される状況にある3).将来的に,がん細胞–間質細胞群の応答やがん進展に有利ながん微小環境の形成シグナルを遮断することで,がん増悪を減衰させることが期待されている.
がん細胞は線維芽細胞をCAFへと分化させる一方で,CAFはがん細胞の遊走や増殖などを促進するフィードバック効果を示す.著者らは,CAFのフィードバック効果が実は正常な線維芽細胞へも影響するという可能性に気づいた.CAFにより刺激された線維芽細胞をCEF(CAF educated fibroblast)と名づけて,新規のがん進展メカニズムを検証した4).
1889年,Paget博士により「seed-and-soil」仮説としてがん発生における周囲環境の重要性が提唱されて以来,がんの発生と進行の理解にがん微小環境の役割が注目されてきた.がん微小環境には,がん細胞により教育されリプログラムされた線維芽細胞や免疫細胞などの多くの種類の細胞が含まれている.それら細胞が分泌するサイトカイン・ケモカインや成長因子,細胞外小胞によって細胞外マトリックス(extracellular matrix:ECM)のリモデリングや血管新生,免疫抑制の増進を引き起こしてしまうため,がん細胞の挙動が多様となると考えられている.CAFは最も豊富ながん間質の主要成分であり,非常に不均一な細胞グループである.近年,空間トランスクリプトーム解析によりCAFサブタイプの特異性が注目され,その細胞起源,バイオマーカーおよび機能に多面性を持つ細胞であることがみえてきた5–7).
CAFは,ECMのリモデリング,サイトカインや細胞外小胞の分泌,代謝リプログラミングなどの多様な方法でがん細胞と相互作用し,腫瘍の発生,浸潤,転移,薬剤耐性などのさまざまな生物学的挙動に積極的に関与する.CAFがこれほど複雑な機能を持つ理由は,CAFが高度に不均一な細胞群であるためであり,これは主にその起源の多様性によるものである(図1A).CAFは腫瘍周囲の正常線維芽細胞,骨髄由来の間葉幹細胞,星細胞,上皮細胞,内皮細胞など,さまざまな細胞に由来することがわかってきた.また,CAFの他の前駆体として,血管内皮細胞,周皮細胞,脂肪細胞,脂肪幹細胞などが発生源と考えられている.CAFの供給源となる細胞は,がん細胞による教育を通じてCAFへ分化している.がん細胞が放出するトランスフォーミング増殖因子β(transforming growth factor β:TGF-β)や線維芽細胞増殖因子(fibroblast growth factor:FGF)などのサイトカインおよび,細胞外小胞内に含まれる因子は,線維芽細胞を活性化する.骨髄由来の間葉系幹細胞(mesenchymal stem cells:MCS)では,腫瘍から分泌されたCXCL-16がMCS膜上のケモカイン受容体CXCR6へ結合することや8),がん細胞由来のオステオポンチン刺激によるMCSのTGF-β発現誘導がCAF分化メカニズムとして報告されている9).
CAFの細胞源が異なることに起因して固有のバイオマーカーを発現する可能性があり,バイオマーカーはCAFの異なる特性を反映する可能性が考えられている.筋線維芽細胞型myCAF(myoblastic CAF, α-SMA陽性),炎症型iCAF(inflammatory CAF, IL-6 / LIF陽性),抗原提示型apCAF(antigen-presenting CAF, CD74陽性)は初期に見つけられた代表的なCAFサブタイプであるが,細胞源の違いに関連して機能的に多様なサブタイプが次々と特定されてきている(膵臓がんでは20種ほどのCAFサブタイプが報告されている).近年,複数のCAFサブタイプは,がんの促進だけではなく抑制にも働くという双方向性機能など,腫瘍発生過程において異なる役割を果たしていることが空間トランスクリプトームによる臨床観察により示されている.
一部のCAFはTGF-βおよびその他のサイトカインも分泌し,これらが複合することによってがん細胞へのフィードバック効果が複雑となる.がん細胞におけるTGF-β経路に限っても複雑であり,TGF-β受容体はSmad経路を介した転写シグナルを伝達する一方,non-Smad経路ではPI3K/Akt, MEK/Erk, Rac/cdc42経路などの多数の経路を制御することで,EMT(上皮間葉転換),浸潤,増殖,炎症,血管新生などのがん細胞の多数の特性に関与している8).
多数のCAFサブタイプが存在し,それらは特有の刺激効果をもってがん微小環境の形成やがん細胞の活性化に関与するため,がん間質ではかなり複雑ながん悪性化シグナルが伝搬していることが考えられる.がん予後の改善にとって,がん環境が複雑となる前の早期発見は重要であり,発がん初期でのCAFサブタイプのバイオマーカーの検知が重大な課題と考えている.
1)CAFは線維芽細胞を分化させる
がん細胞は線維芽細胞をCAFへと分化させ,CAFは細胞外因子を介してがん細胞の遊走や増殖を促進するフィードバック効果を示す.著者らは,CAFからのフィードバック効果が腫瘍組織に存在する通常の線維芽細胞にも伝搬されると思いついた(図1B).この可能性を探るため,CAF培養上清で線維芽細胞を刺激して,刺激後の線維芽細胞サブタイプをCEF(CAF educated fibroblast)と名づけて,その遺伝子発現を解析した4).
ヒトスキルス胃がん組織由来のCAFとその組織周辺のNF(normal fibroblast,通常の線維芽細胞)を用いた胃がんモデルにより検証を進めた.CAF培養上清で24時間NFを刺激して産出したCEFをマイクロアレイと定量的PCRを用いて解析した結果,NFと比較してCEFにおける497遺伝子の発現増加を明らかとした.著者らはCEFで特異的に高発現するキヌレニナーゼ(kynureninase),PAPP-A(pregnancy associated plasma protein A),アスポリン(Asporin),IL-1βに注目した.
まず生体内において,がん細胞を排除した条件でのCAFによるNFのCEF化を検討した.ビオチン標識したNFと非標識のCAFを混合してヌードマウスへ皮下移植し,in vivoでのNFのCEF化を検証した.摘出した移植部の免疫組織化学染色の結果,マウス組織内でのビオチン-NFでアスポリンとIL-1βの共発現が観察された.また,組織内のビオチン-NFをavidin-FITC結合とFACSの併用で分画し,このNFでのアスポリン,キヌレニナーゼ,PAPP-A発現がイムノブロットにより確認された.これらはがん細胞とは独立した状況における生体内でのCAFのNF教育効果を示している.
2)CEFによる免疫抑制とがん活性化
CEFで特異的に発現するキヌレニナーゼとPAPP-Aに注目し,その作用と発現メカニズムを検討した.キヌレニナーゼはトリプトファンを代謝するキヌレニン経路で働く酵素であり,その代謝産物3-ヒドロキシアントラニル酸(3-HAA)はCD8+ T細胞の致死障害に関わる一面が報告されている10).CEF培養上清はCD8+ T細胞に致死障害を与えたため,CEFでの3-HAA産生量の増大がCD8+ T細胞へ影響すると考えられた.
細胞膜上のPAPP-AはIGF(insulin-like growth factor)結合タンパク質4(IGFBP-4)を特異的に切断し,IGFBP-4/IGF-I複合体からのIGF-I放出に働く11).この複合体をCEFに作用させた場合,IGF-Iの放出によるOCUM-12胃がん細胞のIGF受容体のリン酸化が確認できた.CEFはIGF-I活性化を通じてがん細胞増殖に関与する可能性がある.さらに,本研究によりアスポリン(低分子プロテオグリカン)はキヌレニナーゼ,PAPP-A発現を誘導する上流因子とわかった.アスポリン組換えタンパク質で刺激した線維芽細胞ではキヌレニナーゼ,PAPP-A発現が誘導された(図1C).
CEFでは活性酸素種(reactive oxygen species:ROS)産生の増加により転写因子NFκBの活性が向上していた.このNFκB活性化はCEFにおけるアスポリンなどの発現とともにCOX-2(cyclooxygenase-2)発現の増加にも関与していた.COX-2により産生されるプロスタグランジンE2はNFκB活性を増進させるフィードバック効果が知られている(図1D).CEFのCOX-2阻害剤処理はCEF特有の遺伝子発現を減少させた.
3)CEFはがん組織で広域に分布する
著者らは,CEF由来の液性因子でも線維芽細胞のリプログラムを発生させる可能性に気づいた.そこでCEF培養上清によって刺激した線維芽細胞の発現分子を調べた結果,CEFと類似したアスポリン,キヌレニナーゼなどの産生パターンを持つ細胞(CEF2と呼ぶ)であることがわかった.このCEF2もまた線維芽細胞を連続的にリプログラムすることで,新たなCEFを産生することが判明した(図1E).このCEFの自立的な複製は,がん組織におけるCEF領域の展開につながり,がん浸潤や転移を有利とさせる広範囲ながん微小環境の形成が予測された.そのため,ヒト胃がん組織切片をCEFマーカー分子として特定したキヌレニナーゼやアスポリンで染色し,CEFの分布を調べた.がん原発の近辺にはCAF(α-SMA陽性/アスポリン陰性)が集合し,CAF近辺から組織深部の遠方に至ってまでCEF(α-SMA陰性/キヌレニナーゼ陽性/アスポリン陽性)が分散していた(図1F).
4)線維芽細胞の多様性はがん浸潤を促進する
CEFの培養上清に応答したOCUM-12胃がん細胞では遊走が高まった.CEFから分泌されたアスポリンがOCUM-12での活性型Rac1を増加させると考えられた(図1C).活性型Rac1の増加はアクチン細胞骨格のリモデリングにつながるため,がん組織でのCEF周囲ではがん細胞の遊走が促進される可能性を考えた.
前述のように,通常の線維芽細胞とCAFを混合してヌードマウス皮下へ移植した場合,生体内でもCAFは線維芽細胞をリプログラムしてCEFを産生していた.そこで,がん病態により近い条件でのマウス腫瘍においてCEFとがん進展の関連を検証した.NF, CAF, OCUM-12を混合して,ヌードマウスの胃壁へと同所性移植を行った.また,CAF単独とOCUM-12の組み合わせでも同様な移植を進めた.興味深いことに,CEFを含んだ腫瘍においてより大規模ながん浸潤が観察された.CEFとCAFの共存は,がん細胞の増殖や運動性の促進とともに,ECMのリモデリングなどのがん微小環境の増進へシナジカルに働くことで,がん浸潤を加速させるかもしれない.
CEFを含むマウス腫瘍でのがん浸潤の抑制を試みた.上記のNF, CAF, OCUM-12で形成されるマウス腫瘍領域へCOX-2阻害剤NS-39812)を投与した場合,がん浸潤を抑制することに成功した.CEFでみられるCOX-2の高発現はアスポリン発現の増進および分泌につながるため,NS-398はCEFを通じたがん浸潤の抑制にとって有用な可能性がある.
近年,がん細胞に反応した線維芽細胞はリプログラムによってmyCAF, iCAFなどの複数のCAFサブタイプへと分化し,各々のサブタイプが持つ固有の特性が組み合わさることでがん進展にシナジー効果をもたらすことが考えられている.
著者らが見つけた新たな線維芽細胞サブタイプであるCEFはCAFサブタイプとは異なり,がん細胞からの刺激とは独立して産生されることが特徴である.CEFはがん原発よりも遠位の領域で自立的に複製されるため,がん細胞の移動にとって最適かつ広域ながん微小環境領域を準備することが想定された.将来的に,がん組織におけるCEFの存在とがん予後との相関を詳細にすることで,CEFマーカー(アスポリン,キヌレニナーゼ,PAPP-A)によるがん間質の悪性度の評価が期待される.たとえば,CAFによるCEF産生ががん細胞の存在しない部位でも潜在的に進行している可能性があるため,体液サンプル中のCEF由来の細胞外アスポリンやキヌレニナーゼを検出することでがん進行の予測に活用できる可能性がある.また,CAFやCEF産生の遮断はがん浸潤や播種を標的とした戦略的に有望な治療法といえる.
最後に,線維芽細胞における自立的ながん微小環境の創出は,おそらくマクロファージや好中球などの他の細胞間でも起こる汎用な機構であるため,がん研究の新たな視点と捉えている.