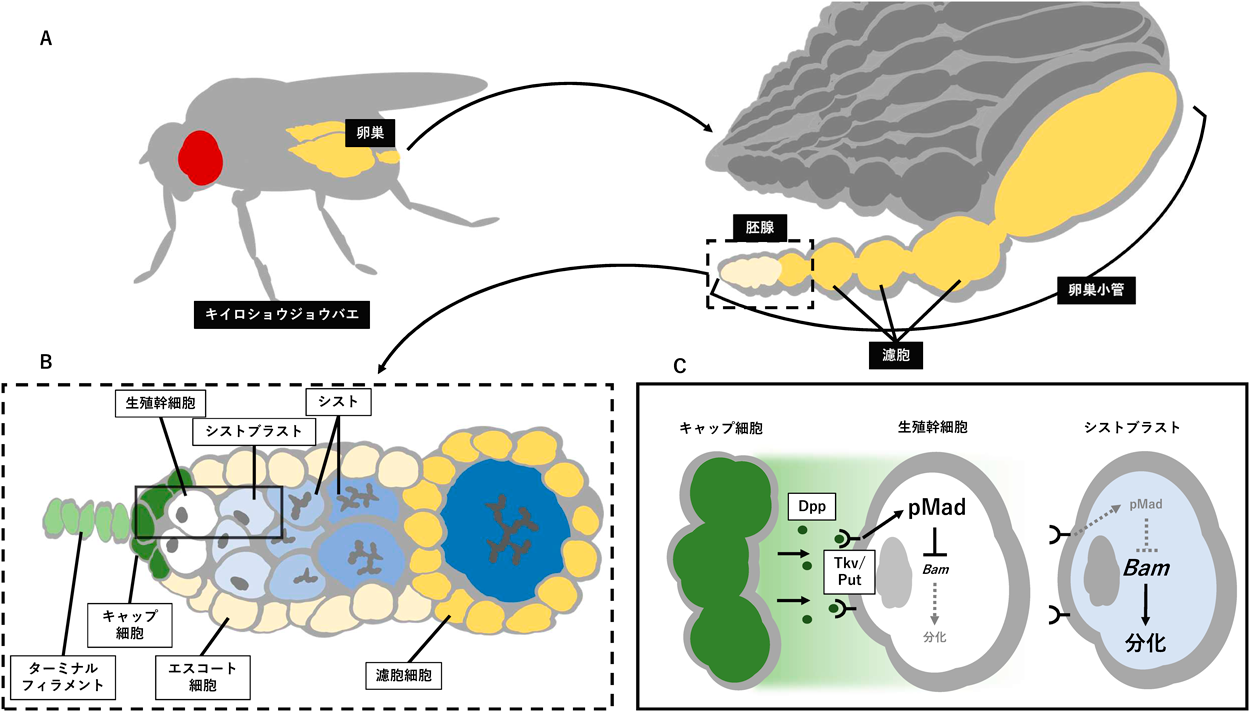
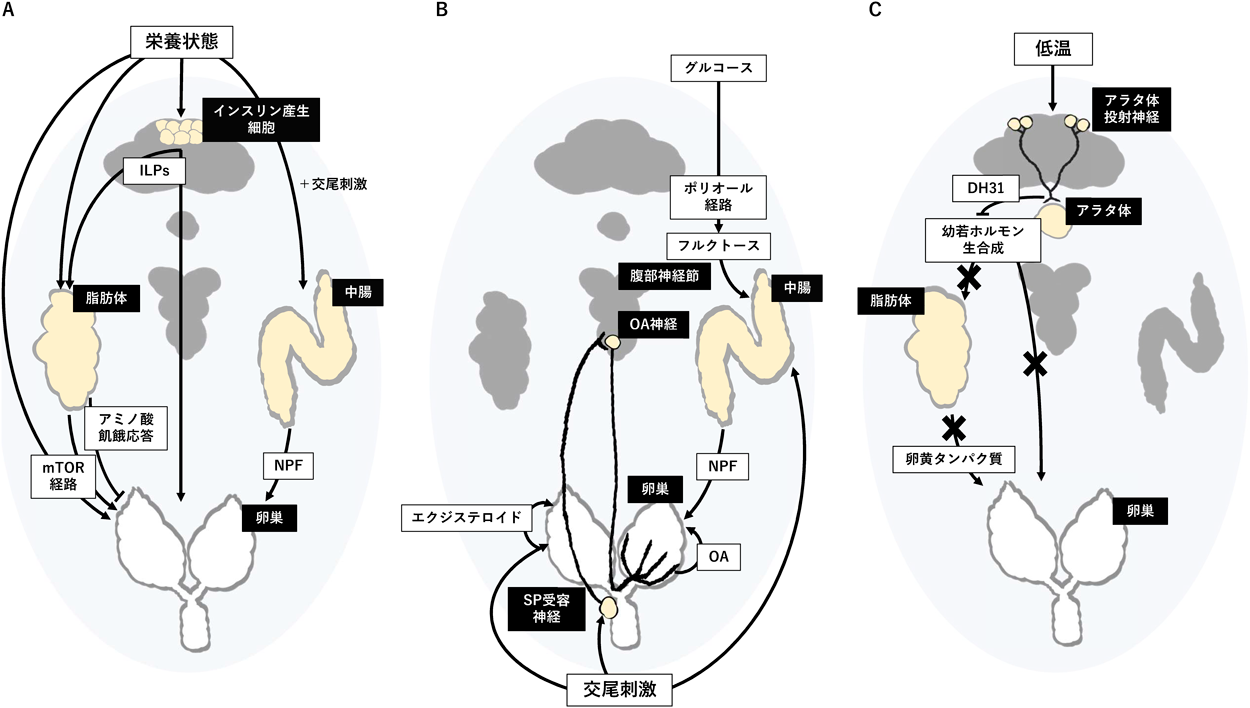
環境に応じた卵形成を支える臓器連関メカニズム:ショウジョウバエの生殖幹細胞研究を中心にInterorgan communication regulating oogenesis in response to environmental conditions: Focusing on studies in Drosophila germline stem cells
1 筑波大学生命環境学群生物学類College of Biological Sciences, School of Life and Environmental Sciences, University of Tsukuba ◇ 〒305–8577 茨城県つくば市天王台1–1–1 ◇ Tennodai 1–1–1, Tsukuba, Ibaraki 305–8577, Japan
2 筑波大学生存ダイナミクス研究センターLife Science Center for Survival Dynamics, Tsukuba Advanced Research Alliance (TARA), University of Tsukuba ◇ 〒305–8577 茨城県つくば市天王台1–1–1 TARAセンターB棟 ◇ TARA Center Bldg. B., Tennodai 1–1–1, Tsukuba, Ibaraki 305–8577, Japan