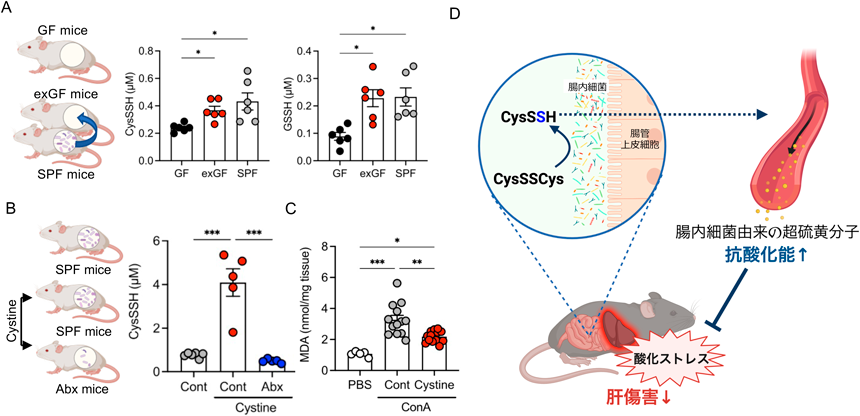
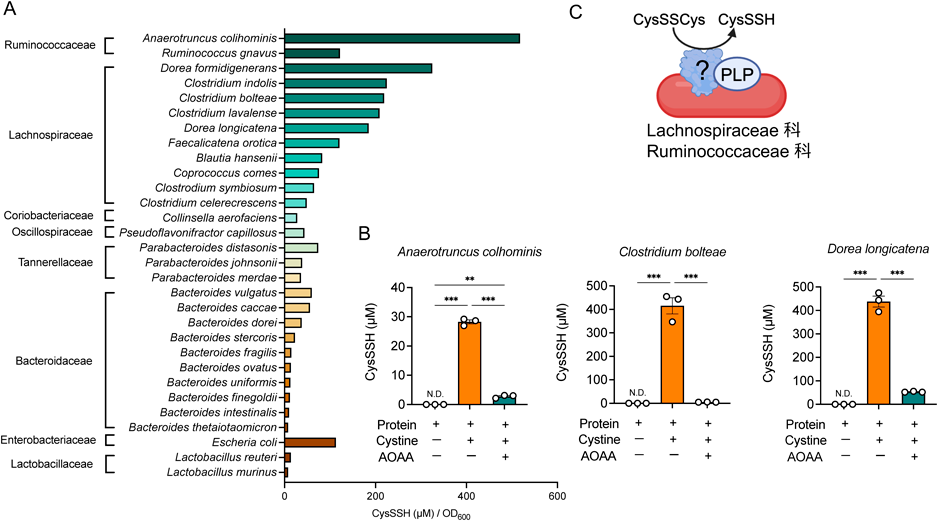
超硫黄分子の新たな供給源としての腸内細菌叢とその役割Gut microbiota as a new source of supersulfides and its role
慶応義塾大学薬学部創薬研究センターResearch Center for Drug Discovery, Faculty of Pharmacy and Graduate School of Pharmaceutical Sciences, Keio University ◇ 〒105–8512 東京都港区芝公園1–5–30 ◇ 1–5–30 Shibakoen, Minato-ku, Tokyo 105–8512, Japan