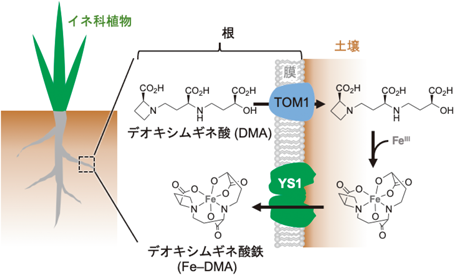
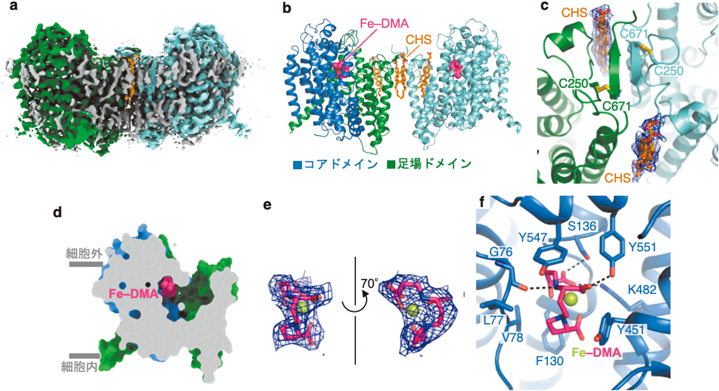
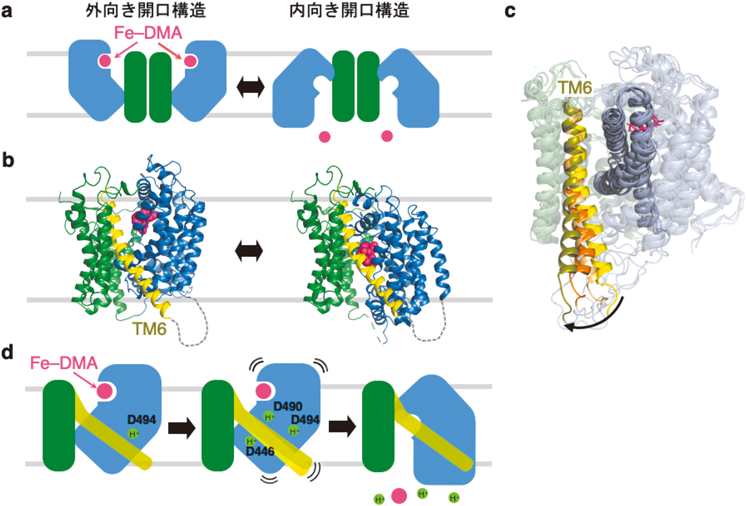
オオムギYellow stripe 1(YS1)トランスポーターによる鉄錯体の認識と輸送の構造基盤Structural basis of iron-phytosiderophore recognition and transport by barley Yellow Stripe 1 transporter
理化学研究所・生命機能科学研究センターRIKEN Center for Biosystems Dynamics Research ◇ 〒230–0045 神奈川県横浜市鶴見区末広町1–7–22 ◇ 1–7–22 Suehiro-cho, Tsurumi-ku, Yokohama, Kanagawa 230–0045, Japan