1)海馬とペリニューロナルネット
海馬は扁桃体や帯状回などとともに大脳辺縁系を構成しており,学習や記憶,情動などの高次脳機能を担っている.大脳皮質で処理されたさまざまなモダリティの情報は,嗅内野で中継された後,貫通線維を通り,海馬歯状回に入力する.海馬に伝えられた情報は,最初に歯状回,次にアンモン角のCA3領域,最後にアンモン角のCA1領域でシナプス結合を形成した後,海馬台に出力され,嗅内野に戻される.「三シナプス回路」と呼ばれているこの古典的な神経回路は,現代の海馬の入出力の知見からは時代遅れと言わざるをえないものの,依然として高次脳機能の発現基盤の一つであると考えられている.また,アンモン角のCA2領域やCA3領域は,乳頭体や嗅内野,中隔核などからの直接入力を受けており,それぞれ異なる脳機能の制御に関わることが示されている1).
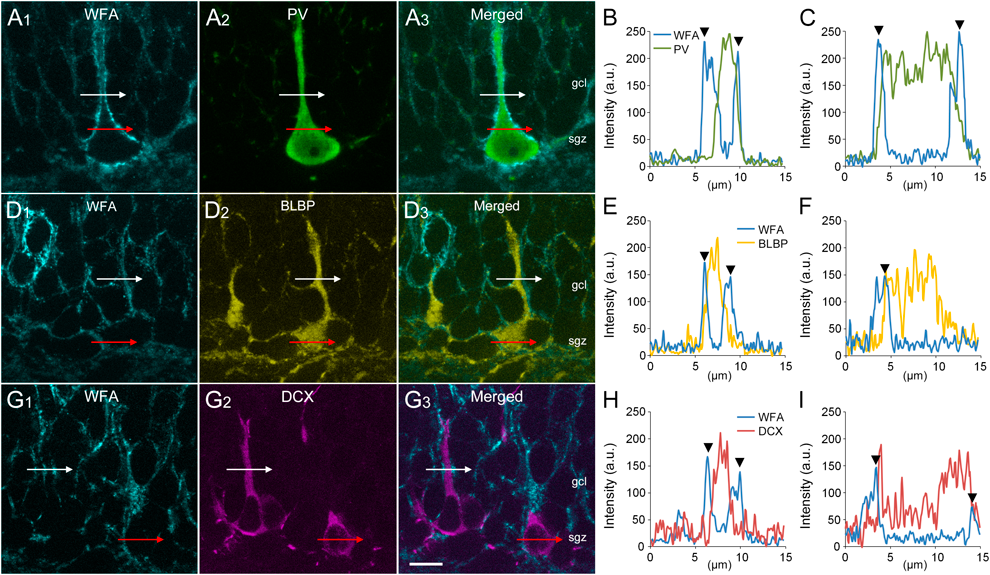
ペリニューロナルネットは,コンドロイチン硫酸の側枝がアグリカン(aggrecan)やホスファカン(phosphacan)などのコアタンパク質に共有結合したプロテオグリカンを含む細胞外マトリックスの特殊な構造であり,ニューロンの細胞体と近位樹状突起を網状に包んでいる2).ペリニューロナルネットの同定には,Wisteria floribunda agglutinin(WFA)やVicia villosa agglutinin(VVA)などのレクチン(糖鎖結合タンパク質)3)に加えて,CS56や3B3などの抗コンドロイチン硫酸抗体,アグリカンやホスファカンなどに対する抗コアタンパク質抗体4)などが用いられることが多い.
大脳皮質や海馬においては,抑制性のGABAニューロンであるパルブアルブミン(parvalbumin:PV)ニューロンの細胞体の周囲に形成されていることが知られている5).その一方で,扁桃体や脊髄においては,興奮性のグルタミン酸作動性ニューロンと抑制性のGABAニューロンのいずれにもペリニューロナルネットが形成されていることが示されている6).このように,ペリニューロナルネットとニューロンの関係は,中枢神経系の部位によって異なる.
ペリニューロナルネットについては,その特徴的な形態に注目が集まり7),多くの解剖学的研究がなされてきた.我々も,マウス海馬の構造的分化とペリニューロナルネットの分布様式の相関や8),加齢に伴うペリニューロナルネットの分布様式の変化と抗認知症薬の作用9),ペリニューロナルネットの形成とPVの発現レベルの相関など10),独自の解剖学的研究に取り組んできた.また,ペリニューロナルネットの機能に関する研究も近年急速に進展しており,発達期の視覚野における神経可塑性の制限における役割や,加齢に伴う認知機能障害や精神神経疾患の病態形成への関与など,新たな知見が蓄積されている11).
2)GABAニューロンのサブクラスとペリニューロナルネット
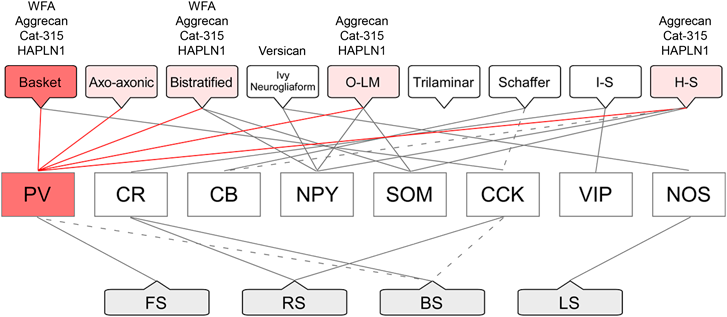
海馬のGABAニューロンは,軸索と樹状突起の形態学的特徴や,細胞体の位置,分子マーカーの発現様式,電気生理学的性質などに基づき,複数のサブクラスに分類されている(図1).形態学的特徴に基づくGABAニューロンのサブクラスとしては,basket細胞(軸索終末が錐体細胞の細胞体の周囲に籠状に分布している),axo-axonic細胞(軸索終末が錐体細胞の軸索起始部に分布している),bistratified細胞[軸索が放線層(stratum radiatum)と上昇層(stratum oriens)の2層に分布している],O-LM細胞[樹状突起がstratum oriensに広がっている一方で,軸索終末が網状分子層(stratum lacunosum-moleculare)に分布している],H-S細胞[軸索が海馬(hippocampus)から内側中隔核(medial septal nucleus)に投射している]などがある12).また,GABAニューロンの分子マーカーとしては,PVに加えて,カルレチニン(calretinin:CR)やカルビンディン(calbindin D28K:CB)などのカルシウム結合タンパク質,ニューロペプチドY(neuropeptide Y:NPY)やソマトスタチン(somatostatin:SOM),血管作動性腸管ペプチド(vasoactive intestinal peptide:VIP),コレシストキニン(cholecystokinin:CCK)などの神経ペプチドに加えて,一酸化窒素合成酵素(nitric oxide synthase:NOS)が用いられている.電気生理学的性質に基づくGABAニューロンのサブクラスとしては,fast spiking(FS)細胞(高頻度の発火を伴う),regular spiking(RS)細胞(規則的な発火を伴う),burst spiking(BS)細胞(バースト発火を伴う),late spiking(LS)細胞(比較的長い発火潜時を伴う)などがある.
海馬のGABAニューロンが複数のサブクラスに分類されることが報告された当初,形態学的サブクラスと分子マーカーに基づくサブクラス,電気生理学的サブクラスの間には,単純な対応関係が存在すると考えられていた.しかし近年,その対応はかなり複雑であることが明らかになっている.ニューロンは,神経回路網を構成する機能デバイスであり,形態学的特徴(入出力構造)と電気生理学的性質に基づく分類は,その機能に関する基礎的な知見を与える.しかしながら,形態学的分類や電気生理学的分類には,単一細胞レベルで活動性の記録と標識を行う必要があり,分布様式についての情報を得ることが難しい.その一方で,分子マーカーによる分類は,形態学的分類と電気生理学的分類をつなぐハブとしての役割が期待されており,分布様式を定量的に評価することが可能である.このため我々は,正確なサンプリングを可能にするオプティカルダイセクター法13)を用いる画像解析システムを独自に開発し,分子マーカーに基づくマウス海馬GABAニューロンのさまざまなサブクラスについて,分布様式の定量解析に取り組んできた14, 15).
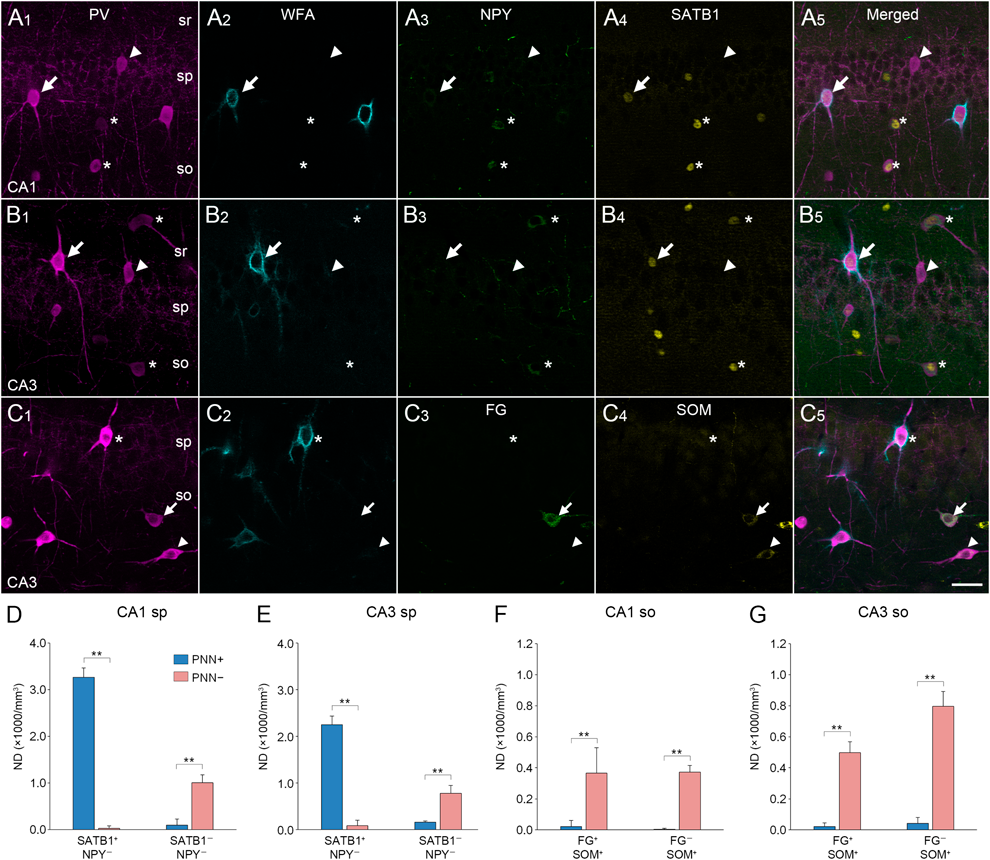
近年,海馬アンモン角のPVニューロンは,少なくとも五つのサブクラスから構成されることが明らかになっている16).小坂らによる先駆的な解剖学的研究が報告されて以来7),ペリニューロナルネットはすべてのPVニューロンに形成されているように誤解されていることが多いが,それは事実ではない.我々は,マウス海馬のペリニューロナルネットを構成している各種の糖鎖と,PVニューロンのサブクラスとの関係を検討してきた(図1).WFAレクチンを用いた研究では17),ペリニューロナルネットはPV陽性のbasket細胞とbistratified細胞に高率に形成されている一方,PV陽性のaxo-axonic細胞やO-LM細胞,H-S細胞では,ペリニューロナルネットの形成率がきわめて低いことを報告している(図2).また,抗アグリカン抗体を用いた研究では18),ペリニューロナルネットはPV陽性のbasket細胞とbistratified細胞に加えて,O-LM細胞やH-S細胞にも高率で形成されていることを示した.さらに,Cat-315糖鎖,ヒアルロン酸プロテオグリカンリンクタンパク質(hyaluronan and proteoglycan link protein 1:HAPLN1),バーシカン(versican)などについても,形態学的サブクラスとの対応が存在する可能性がある.GABAニューロンのサブクラスは,高次脳機能の発現基盤としての海馬の神経回路網の理解に必須のものであり16),異なる糖鎖構造を有するペリニューロナルネットがGABAニューロンのサブクラス選択的に形成されていることは,今後の海馬研究に重要な示唆を与えるものである.
1)ペリニューロナルネットと神経可塑性
2002年に発表されたPizzorussoらによる独創的な研究によって,発達期の視覚野に形成されるペリニューロナルネットは,臨界期における神経可塑性を制限することが初めて明らかにされた19).その後,コンドロイチナーゼABC(コンドロイチン硫酸分解酵素)を用いてペリニューロナルネットを形成している糖鎖を薬理学的に分解すると,成体ラットの視覚皮質の可塑性が回復すること19),軟骨リンクタンパク質(cartilage link protein:CRTL1)を遺伝的に欠損させたマウスでは,ペリニューロナルネットの形成が抑制され,視覚皮質の眼優位性カラムの可塑性が発達後も維持されること,などが報告されている20).ペリニューロナルネットの形成によって神経可塑性が制限される仕組みについてはまだわかっていないことが多いが,ホメオタンパク質(ホメオドメインと相同性の高いアミノ酸配列を有するタンパク質の総称で,遺伝子調節機能を持つ)であるorthodenticle homolog 2(OTX2)が網膜から視覚皮質に輸送されることでPVニューロンが成熟し,ペリニューロナルネットの形成と視覚の臨界期が開始されることが近年明らかになった21).さらに,Otx2遺伝子に変異を導入すると,聴覚野や内側前頭皮質における臨界期の開始も遅れることや22),PVニューロンによるOTX2ホメオタンパク質の取り込みは,コンドロイチン硫酸プロテオグリカンによって促進されること23),コンドロイチン硫酸プロテオグリカンは,OTX2ホメオタンパク質とペリニューロナルネットの相互作用を制御していること24),などがわかってきた.
多くの研究によって,ペリニューロナルネットを薬理学的に分解すると,長期増強や(long-term potentiation:LTP),長期抑圧(long-term depression;LTD),ペアパルス比(paired pulse ratio:PPR)など,記憶や可塑性のモデルとされる現象の障害が起こることが示されてきた25).また,ペリニューロナルネットのアグリカンを欠損させたマウスでは恐怖記憶の想起が低下することも報告されている26).そのメカニズムには不明な点も多いが,ペリニューロナルネットはPVニューロンの活動性を制御することで神経可塑性に関わっている可能性がある27).
2)ペリニューロナルネットと認知機能
2014年にノーベル生理学・医学賞を受賞したMoser夫妻とO’Keefeによって発見された海馬の場所細胞と28),嗅内野のグリッド細胞は29)は,空間認知システムにおいて中心的な役割を担っている.興味深いことに,空間情報の処理に糖鎖が関わっていることが近年明らかになりつつある.たとえば,海馬のペリニューロナルネットはNPY受容体による制御を受けており,空間学習に関わっていること30),嗅内野のペリニューロナルネットはグリッド細胞によるネットワークの安定化に必要であること31),などが報告されている.また,内側前頭皮質のペリニューロナルネットはコカイン関連場所記憶を制御していることなども明らかにされている32).糖鎖による空間認知の制御メカニズムについては,今後のさらなる解明が待たれる.
社会性記憶における海馬のペリニューロナルネットの役割についても,近年研究が進んでいる.げっ歯類を用いる実験では,社会性記憶とは見知った相手とそうでない相手を見分ける記憶として定義される.当初,海馬アンモン角のCA2領域が社会性記憶に中心的な役割を果たしていることが注目されたが33),その後の研究によって,ペリニューロナルネットが社会性記憶にも関わっていることが明らかになった34).
認知機能障害とペリニューロナルネットについても報告が増えている.これまでに,Creutzfeldt-Jakob病患者の脳ではペリニューロナルネットの脱落が認められること35),Alzheimer病患者の脳ではペリニューロナルネットが脱落していること36),などが報告されている.最新のLC-MS/MS解析では,Alzheimer病の病態はペリニューロナルネットに含まれるコンドロイチン硫酸プロテオグリカンの硫酸化パターンと関連があることも示されている37)(三上,北川の稿も参照).
3)ペリニューロナルネットと精神神経疾患
ペリニューロナルネットと精神神経疾患の関連については,統合失調症患者の死後脳に関する知見が蓄積されている38).これまでに,統合失調症患者の背外側前頭前野や39),扁桃体では5),ペリニューロナルネットが減少していることが明らかになっている.また,動物モデルを用いた実験も進展がみられ,胎仔期の酸化的ストレスへの曝露に基づく統合失調症モデルラットでは,視床網様核におけるペリニューロナルネットの形成が低下していることなどが報告されている40).我々は,マウス海馬のPVニューロンのサブクラスとペリニューロナルネットの構成異常が統合失調症の病態形成に関わっていることを報告している41).また,近年のゲノムワイド関連解析(genome wide association study:GWAS)によって,複数の糖鎖関連遺伝子(Fut9, Man2a1, Tmtc1, Galnt10, B3gat1など)が統合失調症のリスク因子であることが明らかになった42).これらの遺伝子によってコードされる分子は,グルタミン酸受容体やドパミン受容体の糖鎖修飾に関わっており,その異常によって受容体の側方拡散や内在化が障害されることで,統合失調症の発症リスクが高まると考えられている.
ポリシアル酸(polysialic acid:PSA)はシアル酸の直鎖状ポリマーの総称であり,神経接着因子(neural cell adhesion molecule:NCAM)と結合している(PSA-NCAM).酸性多糖であるPSAは,さまざまな生理活性分子と特異的に結合し,そのシグナルを調整することで神経機能を制御している43).また,PSAの異常が統合失調症や双極性障害などの病態に関わっていることも明らかになりつつある44).我々は,マウス海馬のCCK陽性GABAニューロンの周囲には,PSA-NCAMによるペリニューロナルネットに類似した細胞外マトリックスの特殊な構造が形成されており,選択的セロトニン再取り込み阻害薬(抗うつ薬)の作用機転である可能性を報告している45).
1)神経発生と細胞外マトリックス
細胞外マトリックスの糖鎖によって神経発生が制御されるメカニズムについては多くの研究がある46).これまでに,コンドロイチン硫酸プロテオグリカンやヘパラン硫酸プロテオグリカンなどによって,神経幹細胞の分裂や分化,新生ニューロンの成熟などが制御されていることが明らかになっている47).
発達期のマウスの大脳皮質でコンドロイチン硫酸プロテオグリカンを薬理学的に分解すると,神経幹細胞の分裂が抑制され,新生ニューロンが減少する48).その一方で,アストロサイトの増殖が増加することから,ニューロンとグリアの分化のスイッチとしてコンドロイチン硫酸プロテオグリカンが作用していると考えられる.ニューロスフェア(浮遊培養によって単一の神経幹細胞から球状の細胞凝集塊を形成させたもの)では,コンドロイチン硫酸プロテオグリカンの投与によってニューロンの増殖が促進されることが示されている49).発達期の脳では,コンドロイチン硫酸プロテオグリカンの受容体が発現していることが報告されている50).その一つは,受容体型チロシンホスファターゼシグマ(receptor-type tyrosine-protein phosphatase sigma:RPTPσ),もう一つはNogo受容体(Nogo receptor:NgR)である.NgRのリガンドを投与すると,野生型マウスから作製されたニューロスフェアではニューロンの分裂が促進されるが,NgRノックアウトマウスのニューロスフェアでは,ニューロンの分裂促進は起こらない51).その一方で,RPTPσと成体海馬神経新生との関連については現在までほとんどわかっていない.
ヘパラン硫酸プロテオグリカンについても神経幹細胞の分裂やシナプス形成との関連が指摘されている.パールカン(perlecan)はヘパラン硫酸プロテオグリカンの一種であり,神経上皮の基底膜に発現している.これまでの研究によってパールカンが神経幹細胞の増殖を維持すること,実験的に中和抗体によってパールカンの作用を阻害すると,神経上皮の形成が障害され,間脳の形成に異常が生じることなどが示されている52).また,パールカンを遺伝的に欠損したマウスでは,神経新生が抑制され,大脳新皮質の形成不全が起こることも報告されている53).一方で,シンデカン-4(syndecan-4)もヘパラン硫酸プロテオグリカンの一種であるが,パールカンとは異なり,その遺伝的な欠損はニューロンの分裂を促進することが報告されている54).また,グリピカン-1(glypican-1)は神経上皮に発現しており,遺伝的にグリピカン-1を欠損したマウスでは,線維芽細胞成長因子(fibroblast growth factor:FGF)シグナリングが阻害され,脳のサイズが縮小することが報告されている55).
リーリン(reelin)は,3461アミノ酸残基からなる巨大細胞外マトリックス分子であり,神経発生において重要な役割を果たしている56).辺縁帯のカハールレチウス(Cajal Retzius)細胞から分泌されるリーリンは,細胞接着因子であるインテグリン(integrin)と細胞外マトリックスとの接着を亢進することで神経細胞の配置と層構造の形成を制御している57).リーリンの機能不全は,その受容体であるアポリポプロテインE受容体(apolipoprotein E receptor 2:ApoER2)を介する細胞内シグナル伝達経路の異常を招き,神経細胞移動異常を伴う滑脳症の原因となる58).
2)成体海馬神経新生と高次脳機能
ヒトを含む哺乳類の脳では,海馬歯状回や側脳室下帯など,いくつかの領域で発達後も神経幹細胞が存在し,新たなニューロンの産生が続く.海馬におけるこの現象は,成体海馬神経新生と呼ばれており,Altmanらによる先駆的な研究によって1960年代に発見されたにもかかわらず59),成体の脳では新たなニューロンの産生は起こらないと信じられていたため,なかなか研究が進まなかった.しかしながら20世紀末から,成体海馬神経新生が高次脳機能の発現基盤の一つである可能性に注目が集まり,研究が急速に進展している.ラットやマウスなどのげっ歯類の海馬歯状回の顆粒細胞層下帯では,神経幹細胞が分裂し,1日あたり約9000個のニューロンが産生されている60).新生ニューロンの多くはアポトーシスなどで失われるが,一部の新生ニューロンは,軸索や樹状突起の進展,シナプスの形成などを経て成熟する61).最新の多光子顕微鏡を使ったライブイメージング研究では,新生ニューロンは4~6週間かけて成熟し,神経回路網に組み込まれることが示されている62).また,新生ニューロンは入力抵抗が大きく,GABAニューロンによる抑制が少ない.このため,新生ニューロンは成熟ニューロンよりも興奮しやすく63),可塑性が高い64).
近年の研究によって,記憶や学習に海馬歯状回の新生ニューロンが関わっているメカニズムが明らかになりつつある.最初期遺伝子(細胞への刺激に応答して迅速かつ一過性に活性化される遺伝子)を用いた実験では,空間学習や恐怖条件づけによって,産生されてから2~4週後の新生ニューロンが活性化しやすいことが報告されている65, 66).これらの新生ニューロンは,臨界期と呼ばれる興奮性が高い状態にあると考えられている.成熟に伴い臨界期を過ぎたニューロンの興奮性は低下するため,新たな情報はそのタイミングで臨界期に入った異なる新生ニューロンによってエンコード(情報を記憶に取り込むこと:符号化)されることになる.また,ある情報を臨界期にエンコードした新生ニューロンは,後日同じ環境に曝露すると再度活性化することで,記憶が想起されると考えられている67).
円形の水槽と水面下に隠されたプラットフォームから構成されるモリス水迷路試験は,げっ歯類の空間学習と海馬機能の評価に広く用いられている68).空間学習のフェーズで神経新生を抑制すると,モリス水迷路試験における成績が低下することが示されている69).また,げっ歯類の認知的柔軟性はモリス水迷路試験の反転学習プロトコールで評価されているが,新生ニューロンの産生を抑制することで,新たなプラットフォームの位置を学習することが難しくなり,以前にプラットフォームがあった位置で探索を続けるようになる70).興味深いことに,神経新生を促進すると,反転学習における新たなプラットフォームの位置の学習成績が向上し,認知的柔軟性が高まることも示唆されている71).
新奇物体認知試験は,「見たことのない物を好む」というげっ歯類の特性を利用した認知機能と空間学習の試験である72).成体海馬神経新生を抑制すると,新奇物体認知試験の成績が低下することが知られている73).産生されてから4~6週後のニューロンが物体の新奇性の認識に関わっていることも報告されている74).
3)成体海馬神経新生と細胞外マトリックス
神経発生と細胞外マトリックスについての研究に比較すると,細胞外マトリックスによる成体海馬神経新生の制御機序の研究は少ない.このため我々は,成体マウスの海馬歯状回のコンドロイチン硫酸鎖による神経新生のニッチの研究を進めている(図3).薬理学的に海馬歯状回のコンドロイチン硫酸プロテオグリカンを分解すると,新生ニューロンの産生が減少し,樹状突起の成熟が抑制され,認知機能が障害されること,“豊かな環境”による神経新生の促進には,コンドロイチン硫酸プロテオグリカンの合成増加が必須であることなどを報告している75).コンドロイチン硫酸プロテオグリカンはFGFや脳由来神経栄養因子(brain-derived neurotrophic factor:BDNF)などの神経栄養因子と結合してニッチを構成し,それらの作用を増強すると考えられている76).
成体海馬神経新生におけるヒアルロン酸の役割に関する研究はこれまで少ないが,海馬歯状回の顆粒細胞層にヒアルロン酸の局在が認められることが報告されている77).薬理学的に海馬のヒアルロン酸を分解すると,海馬依存性の文脈恐怖条件づけが障害されることも明らかにされている78).また,神経幹細胞はヒアルロン酸の受容体であるcluster of differentiation 44(CD44)を発現しており,ヒアルロン酸は神経幹細胞の分裂を抑制する作用があることが示されている79).また,CD44を遺伝的に欠損させたマウスでは,モリス水迷路試験における空間記憶の保持が障害されることも示されている80).しかしながら,成体海馬神経新生のニッチとしてのヒアルロン酸の役割については現在も不明な点が多い.
先に述べたリーリンは,成体海馬の新生ニューロンの移動と分化においても重要な役割を果たしている.海馬歯状回のリーリンは,新生ニューロンを分子層に移動させる誘引因子として作用する81).また,リーリンを過剰発現させると,新生ニューロンのシナプスの成熟が促進される82).一方で,リーリンはN-methyl-D-aspartate(NMDA)受容体の分子組成を変化させ,α-amino-3-hydroxy-5-methyl-4-isoxazole propionic acid(AMPA)受容体の樹状突起のスパインへの集積を促し,新生ニューロンの成熟にも関わっている83).これらの結果は,成体海馬神経新生のニッチとしてのリーリンの重要性を示唆している.