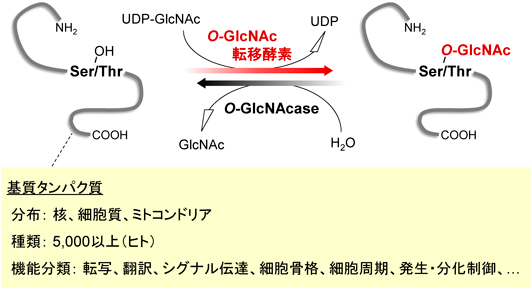
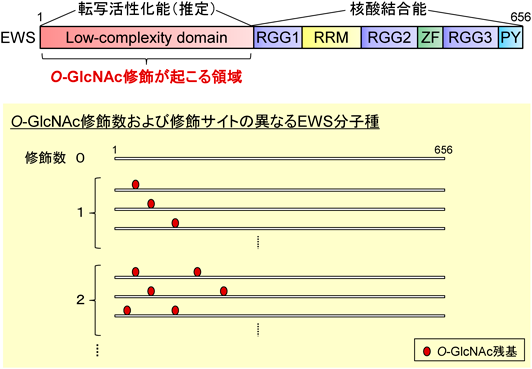
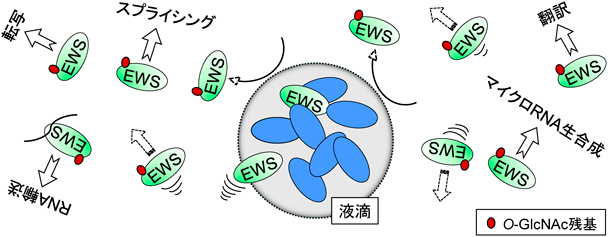
O-GlcNAc修飾されたタンパク質の特性:難病に関わるタンパク質を中心にProperties of O-GlcNAc-modified proteins: Focus on proteins involved in intractable diseases
長浜バイオ大学大学院バイオサイエンス研究科Graduate School of Bioscience, Nagahama Institute of Bio-Science & Technology ◇ 〒526–0829 滋賀県長浜市田村町1266 ◇ 1266 Tamura, Nagahama, Shiga 526–0829, Japan