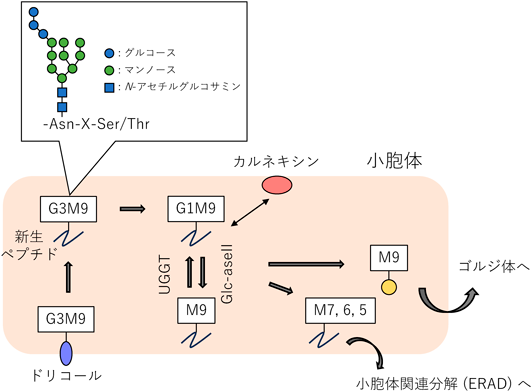
タンパク質に施される糖鎖修飾には,タンパク質のアスパラギン(Asn)残基に糖鎖が共有結合するN結合型とセリン(Ser)またはトレオニン(Thr)残基に糖鎖が共有結合するO結合型の2種類がある.小胞体では,新生ペプチドの大部分に対してN結合型糖鎖修飾が行われ,これが糖タンパク質の正しいフォールディングを監視する役目も担っている5)(図1).N結合型糖鎖修飾は小胞体内腔で新生ペプチドのAsn-X-Ser/ThrモチーフのAsn残基のアミノ基に,G3M9型糖鎖[3個のグルコース(Glc)と9個のマンノース(Man),2個のN-アセチルグルコサミン(GlcNAc)からなる]が付加されるところから始まる(原田の稿も参照).次にグルコシダーゼI, IIによって2個のGlcが除去され,G1M9型糖鎖になると,カルネキシンやカルレティキュリンのような糖タンパク質専用の小胞体シャペロンによって認識されるようになり,フォールディングが行われる.最後にグルコシダーゼIIによって残り1個のGlcが除去され,M9型糖鎖になる.ここで糖タンパク質が正しくフォールディングされている場合は,ゴルジ体へと送られ,さらに糖鎖修飾を受ける.正しくフォールディングされなかった場合,グルコース転移酵素UGGT1およびUGGT2により糖タンパク質のM9型糖鎖に1個のGlcが付加され,再びG1M9型糖鎖になり,小胞体シャペロンによるフォールディングを受ける(カルネキシンサイクル).それでも正しくフォールディングされない異常タンパク質はM9型糖鎖からManが段階的に除去されて,最終的に小胞体関連分解(ER-associated degradation:ERAD)経路で分解される6).
ゴルジ体では小胞体から輸送されてきたタンパク質のN結合型糖鎖のさらなるプロセシングと,プロテオグリカンやムチンのO結合型糖鎖修飾が行われる.N結合型糖鎖はハイマンノース型,複合型,ハイブリッド型に分類され,ハイマンノース型は小胞体から送られてきたM9型糖鎖タンパク質がゴルジ体でそれ以上修飾を受けないことを意味する.複合型やハイブリッド型は,ゴルジ体内に送られてきたM9型糖鎖タンパク質のManが部分的に除去されたり,GlcNAcやガラクトース(Gal),シアル酸などが付加されたりして形成される.
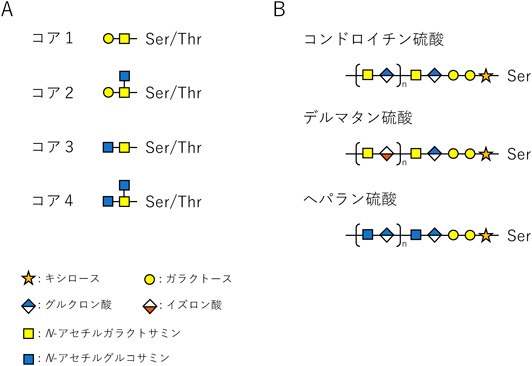
コアタンパク質のSerまたはThrの水酸基にN-アセチルガラクトサミン(GalNAc)が結合することで生合成が開始するムチン型糖鎖はO結合型糖鎖修飾の大部分を占める(図2A).他にもさまざまなタイプが存在し,コアタンパク質のSerの水酸基にキシロース(Xyl)が結合するとプロテオグリカンにみられるグリコサミノグリカンが生合成される(図2B)(三上,北川の稿も参照).また,新しいタイプのO結合型糖鎖として,コアタンパク質のSerまたはThrの水酸基にManやフコース(Fuc),Glcが結合する非典型的なタイプなども知られている.ムチン型糖鎖はGalNAcに続いて,GalやGlcNAc, Fuc,シアル酸などが結合したヘテロ多糖で,ムチンのコアタンパク質にはムチン型糖鎖が多数共有結合している7).ヒトでは,約20種類のムチンが同定されており,その大部分が消化管で発現し,粘液の主成分として消化管上皮の保護作用を担う.代表的なムチン型糖鎖のコア構造1~4を図2Aに示す.プロテオグリカンはコアタンパク質のSer残基にグリコサミノグリカンと呼ばれる,アミノ糖を含む二糖が数十回繰り返した直鎖状の糖鎖が共有結合した糖タンパク質の総称である(三上,北川の稿も参照).グリコサミノグリカンには,GalNAcとグルクロン酸(GlcA)の二糖繰り返し構造を持つコンドロイチン硫酸,GalNAcとGlcAまたはイズロン酸(IdoA)の二糖繰り返し構造を持つデルマタン硫酸,GlcNAcとGlcAまたはIdoAの二糖繰り返し構造を持つヘパラン硫酸などがある8)(図2B).コンドロイチン硫酸を含むプロテオグリカンは軟骨の主成分として有名であり,水分子を多量に保持することでクッション材としての機能を示すことが知られているが,プロテオグリカン自体はユビキタスに発現しており,細胞表面や細胞外マトリクスに局在して細胞接着や増殖,分化などの細胞活動を制御するためのシグナル伝達因子として機能している9, 10).重要な機能をもつ糖鎖の生合成不全は細胞の恒常性を破綻させ,発生異常や病気といった,個体の生存維持を困難にさせる状況を招く.これを防ぐため,ゴルジ体には糖鎖修飾能を増強するゴルジ体ストレス応答の仕組みが備わっている.
単純な糖鎖からN結合型糖鎖の複合型やハイブリッド型,O結合型糖鎖のムチン型,グリコサミノグリカンなどのかなり複雑な糖鎖まで,さまざまなパターンの糖鎖形成を担う,糖転移酵素やグリコシダーゼが小胞体およびゴルジ体に集結している.これらの酵素群は,正確かつ効率的に糖鎖修飾ができるように,小胞体やゴルジ体の各槽(シスゴルジネットワーク,シス槽,メディアル槽,トランス槽,トランスゴルジネットワーク)に適切に配置されている.たとえばN結合型糖鎖の生合成を担う酵素群のうち,α-マンノシダーゼI, IIやGlcNAc転移酵素I, IIなどはシス槽に,GlcNAc転移酵素III, IVやβ1,4 Gal転移酵素などはメディアル槽に,糖鎖の末端付近に作用するα2,3シアル酸転移酵素やα2,6シアル酸転移酵素などはトランス槽に局在している11).また,ショウジョウバエでは各槽が積み重なったゴルジ層板を有するミニゴルジ体が細胞内で分散して存在しているが,UDP-糖輸送体やヘパラン硫酸の硫酸化酵素,プロテアーゼなどさまざまな翻訳後修飾に関わるタンパク質がそれぞれ異なるミニゴルジ体に局在することが示された12).これはゴルジ体で行われる多種多様な翻訳後修飾が各槽の中の異なるゾーンで制御されていることを示している.ゴルジ体ストレス応答による機能増強もゴルジ体全体で均質的に行われるのではなく,増強すべき機能の種類によって局所的に(各ゴルジ体機能ゾーンごとに)制御される可能性がある13, 14).今後,哺乳細胞の小胞体やゴルジ体において,機能的に異なるゾーンの発見が待たれる.
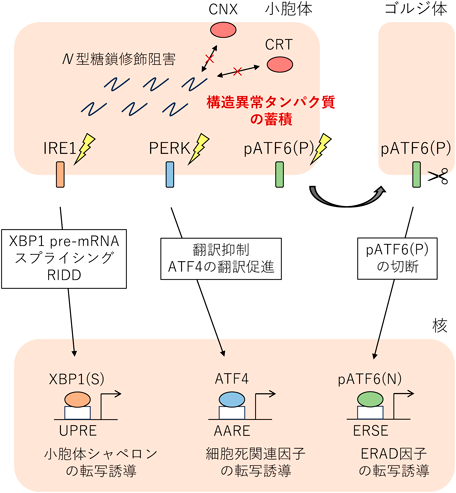
小胞体ストレス応答の詳細な分子機構は京都大学の森和俊博士らによって解明されてきた17–19).以下に哺乳細胞における小胞体ストレス応答の分子機構について説明する.小胞体の機能不足により,小胞体内に折りたたまれていない未成熟のタンパク質が蓄積すると,小胞体ストレス応答のATF6(activating transcription factor 6)経路,IRE1(inositol requiring enzyme 1)経路,PERK(double stranded RNA dependent protein kinase-like ER kinase)経路が活性化される(図3).ATF6やIRE1, PERKは小胞体ストレスを感知するセンサーで小胞体膜貫通タンパク質である20–27).ATF6経路では,pATF6(P)が小胞体内腔ドメインでストレスを感知すると,COPII小胞によりゴルジ体へと輸送され,ゴルジ体でS1PおよびS2Pプロテアーゼによる切断を受ける28).切り離された細胞質ドメインpATF6(N)が核に移行し,転写因子として転写制御配列であるERSE(ER stress response element)に結合し20),小胞体シャペロンの転写を誘導する29).IRE1経路では,IRE1αが小胞体ストレスを感知すると,細胞質ドメインのRNase活性により,細胞質でXBP1(x-box binding protein 1)mRNA前駆体のスプライシングを行う30–32).スプライシング後のXBP1成熟mRNAは転写因子XBP1(S)をコードしており,翻訳されたXBP1(S)が核移行して転写制御配列UPRE(unfolded protein response element)に結合し,蓄積した構造異常タンパク質の分解を行うERAD因子の転写を誘導する.IRE1αの発現がユビキタスであるのに対し,IRE1βは消化管組織特異的に発現しており,分泌タンパク質や膜タンパク質をコードするmRNAを特異的に分解するRIDD(regulated IRE1-dependent degradation)という仕組みを持つ33).PERK経路では,小胞体ストレスにより活性化されたPERKが,細胞質側のキナーゼドメインにより翻訳開始因子eIF2α(α subunit of the eukaryotic initiation factor 2)をリン酸化し,翻訳阻害を引き起こすことで,小胞体内に構造異常タンパク質のさらなる蓄積が起こらないようにする27).この翻訳阻害は転写因子ATF4の翻訳を促進する34).ATF4はCHOP(C/EBP homologous protein)などのアポトーシス因子の転写を誘導し,小胞体ストレスによってダメージを受けた細胞の排除を行う.
N結合型糖鎖修飾の異常は小胞体ストレス応答を容易に活性化させる(図3).N結合型糖鎖修飾の糖鎖供与体であるドリコール結合型糖鎖の生合成は,ドリコールと呼ばれる小胞体膜上の脂質にピロリン酸を介してGlcNAcをジエステル結合させるところから始まる(原田の稿を参照).ツニカマイシンは,UDP-GlcNAcの類似体であるためドリコールとGlcNAcの結合を競合阻害し,小胞体ストレス応答を活性化する35).また,生体内のあらゆる糖の主原料であるグルコースを枯渇させると,タンパク質のフォールディングを行うカルネキシンサイクルが機能せず,小胞体内に構造異常タンパク質が蓄積するため,小胞体ストレス応答が活性化される.がん細胞はグルコース枯渇を含む低栄養状態にさらされており,これに適応するために,小胞体ストレス応答IRE1経路やPERK経路を活性化させ,増殖や転移を亢進することが報告されている36).
1)ゴルジ体ストレス応答の概要
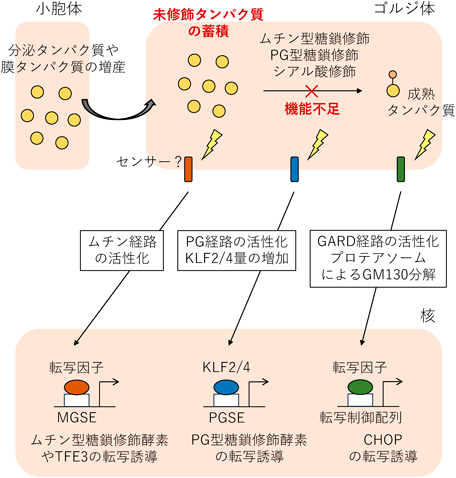
ゴルジ体ストレス応答とは,細胞の需要に応じてゴルジ体の機能を増強する,細胞に必要な適応機構である.分泌タンパク質や膜タンパク質が増産される場合,小胞体からゴルジ体へと送り込まれるタンパク質量が増えるため,既存のゴルジ体の量では糖鎖修飾などの翻訳後修飾が追いつかず,ゴルジ体内に未修飾タンパク質が蓄積すると考えられる.この機能不足状態,つまりゴルジ体ストレス状態を解消するためにゴルジ体で働くタンパク質の転写が誘導される(図4).哺乳細胞におけるゴルジ体ストレス応答の転写制御は,2011年に筆者らの研究室によって初めて報告された37).プロトンのイオノフォアであるモネンシンやニゲリシンを用いて,酸性の細胞小器官であるゴルジ体を中性化してその機能を失わせると,GCP60やGM130, giantinなどのゴルジ体構成因子,シアル酸転移酵素4Aやフコース転移酵素1などの糖鎖修飾酵素,syntaxin 3Aなどの小胞輸送因子の遺伝子発現が上昇すること,これら標的遺伝子群の転写誘導は転写制御配列GASE(Golgi apparatus stress response element)(ACGTGGC)によってコントロールされることが示された.その後,同研究室において,GASEに結合するbHLH(basic helix-loop-helix)型転写因子TFE3(transcription factor E3)が同定された38).TFE3は通常,細胞質に局在しているが,ゴルジ体ストレスが発生すると,108番目のSer(ヒトTFE3の場合)が脱リン酸化され,核移行してGASEに結合し,標的遺伝子の転写を誘導する.GASEおよびTFE3が制御するゴルジ体ストレス応答の経路はTFE3経路と命名された.現在までに筆者らの研究室を含めた複数の研究グループにより,ゴルジ体ストレス応答を制御する経路としてTFE3経路37, 38),HSP47(heat shock protein 47)経路39),CREB3(cyclic AMP-responsive element-binding protein 3)-ARF4(ADP-ribosylation factor 4)経路40),プロテオグリカン経路41),ムチン経路42),GARD(Golgi apparatus-related degradation)経路43),PI4P(phosphatidylinositol 4-phosphate)経路44)が報告されている.ここではCREB3-ARF4経路とPI4P経路について紹介し,ゴルジ体の糖鎖修飾機能が関係するHSP47経路やプロテオグリカン経路,ムチン経路,GARD経路については後で詳細に説明する.
CREB3-ARF4経路はゴルジ体ストレスによる細胞死を促進する経路であり,2013年,Reilingらによって報告された39).CREB3は小胞体ストレス応答のセンサーであるATF6ととてもよく似た構造を持つ,小胞体膜貫通タンパク質である45–47).小胞体-ゴルジ体間の小胞輸送を制御する低分子量Gタンパク質ARFファミリーの阻害剤ブレフェルジンA処理により48)ゴルジ体ストレスが発生すると,CREB3の細胞質ドメインが切り離されて核移行し,bZip(basic leucine zipper)型転写因子として機能する.ARFファミリーに属するARF4はゴルジ体膜に局在し,COPI小胞によるゴルジ体から小胞体への逆行輸送を制御することが知られているが49),CREB3がゴルジ体ストレス依存的にARF4の転写を誘導することにより,最終的に細胞死が引き起こされる.
PI4P経路は小胞体–ゴルジ体間の脂質交換輸送を増強する経路である.小胞体膜とゴルジ体膜とが接触する部位では,小胞体からゴルジ体へとコレステロールが輸送され,ゴルジ体から小胞体へとリン脂質PI4Pが輸送される.この二つの輸送は共役しており,OSBP(oxysterol-binding protein)によって制御されている.筆者らは最近,siRNAによるOSBPの発現抑制またはOSBPの阻害剤(OSW-1;強力な抗がん活性を持つ天然化合物)50–52)処理により,機能増強のためにOSBP2をはじめとした脂質輸送因子の転写が誘導されることを明らかにした44).さまざまな細胞小器官の間でコレステロール/PI4Pの交換輸送を担うORP(OSBP-related proteins)ファミリーに属するOSBPとOSBP2は非常によく似た構造を持ち53),ともにOSW-1の阻害標的である52).さらに筆者らは,OSBP2などの脂質輸送因子の転写誘導やOSW-1による細胞死がゴルジ体のPI4Pによって制御されることを明らかにし,この制御機構をPI4P経路と命名した44).
2)プロテオグリカンの糖鎖修飾阻害に対するゴルジ体ストレス応答
4NP-キシロシド(4-nitrophenyl-β-D-xyloside)はプロテオグリカンのコアタンパク質へのグリコサミノグリカン付加を阻害する54).グリコサミノグリカン鎖は個々の糖が段階的にコアタンパク質に転移されることによって形成されていくが,コアタンパク質のSer残基が持つ水酸基へのXyl結合がその起点となる(図2B).4NP-キシロシドはXylの類似体でXylの1位の水酸基が4-ニトロフェニル化されているため,コアタンパク質とO-グリコシド結合を形成することができず,Xylとコアタンパク質との結合を競合的に阻害することができる.4MU-キシロシド(4-methylumbelliferyl-β-D-xyloside)はXylの1位の水酸基が4-メチルウンベリフェリル化されており,4NP-キシロシドと同様の効果を示す55).プロテオグリカンの糖鎖修飾機能の不足状態を補うために活性化されるのがゴルジ体ストレス応答プロテオグリカン経路である(図4).4NP-キシロシドや4MU-キシロシド処理により発生したゴルジ体ストレスをゴルジ体に存在するセンサーが感知すると,その情報は核へと伝達されると考えられる.核内では,標的遺伝子であるコンドロイチン硫酸やヘパラン硫酸の生合成に関わる酵素遺伝子群(B3GAT3, CSGALNACT2, EXT2, CHST7, HS3ST1, HS6ST1, NDST2, GLCE)の発現が誘導される41).B3GAT3はコンドロイチン硫酸やヘパラン硫酸などが共通してもつ,Xyl-Gal-Gal-GlcAの順でコアタンパク質に共有結合している四糖構造のうち,GalにGlcAを付加するGlcA転移酵素である(図2B).CSGALNACT2はコンドロイチン硫酸のGlcAとGalNAcの二糖繰り返し構造のうち,GalNAcの付加を行う酵素である.EXT2はEXT1とヘテロ複合体を形成して機能する,ヘパラン硫酸のGlcAとGlcNAcの二糖繰り返し構造の合成に関わるヘパラン硫酸ポリメラーゼである.さらに,コンドロイチン硫酸の硫酸化修飾を担うCHST7やヘパラン硫酸の硫酸化修飾酵素であるHS3ST1, HS6ST1, NDST2,ヘパラン硫酸のGlcAをIdoAに異性化する酵素GLCEについて,ゴルジ体ストレス依存的に遺伝子発現の上昇がみられる.これら遺伝子群の転写誘導は小胞体ストレス応答やゴルジ体ストレス応答TFE3経路による制御を受けない.各標的遺伝子についてプロモーターの解析が行われた結果,PGSE(proteoglycan-type Golgi stress element)-A(CCGGGGCGGGGCG)およびPGSE-B(TTTTACAATTGGTC)がプロテオグリカン経路の転写制御配列として同定された.最近,C2H2型zinc-finger転写因子KLF(Krüppel-like factor)ファミリーに属するKLF2とKLF4が転写制御配列のうちPGSE-Aに結合し,標的遺伝子群の転写を正に制御する可能性が見いだされた44).KLF2とKLF4は両キシロシド存在下でmRNAレベル,タンパク質レベルでの発現量が上昇する.興味深いことに,KLF2とKLF4それぞれのプロモーター内にもPGSE様の配列が複数存在しており,KLF2/4自身がそれらに結合し,発現量を増幅するという正のフィードバック制御が行われているようである.転写因子KLF2およびKLF4の活性化メカニズムはまだ明らかでなく,ストレスセンサーも未同定であるが,ストレスはゴルジ体内に蓄積した未修飾のプロテオグリカンである可能性が高い.実際に4NP-キシロシド処理を行うと,グリコサミノグリカン鎖が十分に結合していないプロテオグリカンがゴルジ体内に蓄積し,ゴルジ体の小胞化が引き起こされること56),プロテオグリカンのコアタンパク質の生合成が促進されること54)が報告されている.また,プロテオグリカンのコアタンパク質であるSDC2(syndecan-2)をHeLa細胞に過剰発現させると,4NP-キシロシドや4MU-キシロシド処理時と同様に,ゴルジ体の断片化が起こり,標的遺伝子の転写が誘導される41).
3)ムチン型糖鎖修飾阻害に対するゴルジ体ストレス応答
BG(BenzylGalNAc)はムチン型糖鎖修飾の阻害剤として知られる.ムチン型糖鎖ではコアタンパク質に最初に結合する糖がGalNAcであるため,GalNAcの類似体で1位の水酸基がベンジル化されているBGは競合的にその結合を阻害する57).ヒト結腸腺がん由来HT29細胞では,BG処理によりゴルジ体内にムチンのコアタンパク質が蓄積されること58),ゴルジ体が断片化されることが報告されている42).このようなムチン型糖鎖修飾の機能不足状態(ムチン型ゴルジ体ストレス状態)を補うために,ゴルジ体ストレス応答ムチン経路が活性化され,ムチン型糖鎖修飾酵素(GALNT5, GALNT8, GALNT18)の遺伝子発現が誘導される42)(図4).GALNT5, GALNT8, GALNT18が属するGALNTファミリーはムチンのコアタンパク質にGalNAcを付加する酵素として知られる59).驚くべきことに,BG処理によってゴルジ体ストレス応答TFE3経路を制御する転写因子TFE3が活性化されること,TFE3の転写が誘導されることが見いだされた42).これはムチン経路が自身の活性化に加えて,ゴルジ体の全般的な機能を増強するTFE3経路も駆動させることによって,ムチン型ゴルジ体ストレス状態から回復しようとしていると予想される.ムチン型ゴルジ体ストレス依存的にTFE3の転写を誘導する転写制御配列MGSE(mucin-type Golgi stress element)(ACTTCC(N9)TCCCCA)も同定された.ムチン経路において,ストレスセンサーやシグナル伝達因子,転写因子は同定されていないが,ストレス源はプロテオグリカン経路と同様にゴルジ体内に蓄積した未修飾タンパク質であると考えられる.ムチンのコアタンパク質MUC1やMUC20を過剰発現させると,BG処理時と同様にゴルジ体の断片化が起こり,MGSEの転写活性が上昇する42).また,TFE3の転写が誘導されるだけでなく,TFE3の核移行も促進される.
BGはコラーゲン専用の小胞体局在シャペロンであるHSP47の遺伝子発現を誘導し,ゴルジ体ストレスによる細胞死を抑制するHSP47経路も活性化させる.HSP47経路は2013年に宮田らによって報告され,マウス線維芽NIH3T3細胞では,BG処理によりHSP47の遺伝子発現が上昇すること,siRNAによってHSP47の発現抑制を行うと,BGによるゴルジ体ストレス依存的な細胞死が促進されることが示された39).したがって,HSP47経路はO結合型糖鎖修飾阻害によるゴルジ体ストレスに対して,HSP47の発現を増やすことにより細胞死を防いでいると考えられる.なお,HSP47経路のストレスセンサーや転写因子は未同定であり,HSP47経路の詳細は明らかになっていない.BG処理によるHSP47の転写誘導はNIH3T3細胞に加えて,HT29細胞やHeLa細胞でも観察されるため42),ムチン経路が消化管系組織由来の細胞で特異的に活性化されるのに対し,HSP47経路は普遍的に活性化されると考えられる.
4)シアル酸修飾阻害に対するゴルジ体ストレス応答
GARD経路はシアル酸修飾阻害によるゴルジ体ストレス依存的に,26SプロテアソームによるGARDを促進し,ゴルジ体の断片化および細胞死を誘導する経路であり,2020年にMerblらによって報告された43)(図4).シアル酸修飾はCMP-シアル酸の輸送体SLC35A1やCMP-シアル酸の合成酵素CMAS(CMP-Neu5Ac synthetase)の発現抑制,シアル酸修飾の阻害剤CMP-3F-NeuAc60)やLCG(lithocholyglycine)61–64)の使用により阻害することができる.シアル酸やFuc付加など糖鎖末端の修飾が阻害されると,ゴルジ体内に糖鎖修飾の途中段階のタンパク質が蓄積し,ゴルジ体の形態変化が引き起こされる65).この阻害条件下では,ゴルジ体膜の細胞質側に結合した26Sプロテアソームおよびタンパク質のアンフォールディングを行うp97/VCP依存的に,K48特異的にポリユビキチン化されたGM130が分解される.GM130はC末端領域でGRASP65と,N末端領域でp115と結合し,ゴルジ体の隣り合う槽どうしを固定する,ゴルジ体の構造維持に必要なタンパク質であるため66, 67),GM130の分解によりゴルジ体が断片化され,アポトーシス促進因子CHOPの発現が誘導されることにより最終的に細胞死が引き起こされる.GARD経路と同様に,CREB3-ARF4経路も細胞死を促進する経路であるが40),ゴルジ体ストレスが発生する場所やストレス応答が制御される場所がこの二つの経路では異なると考えられる.CREB3-ARF4経路はブレフェルジンAで活性化されるが,これは小胞体からゴルジ体への順行輸送を阻害することからゴルジ体ストレスだけでなく小胞体ストレスも引き起こす.また,CREB3-ARF4経路で活性化される転写因子CREB3は小胞体膜に局在している.一方,シアル酸修飾は主にトランス槽などで起こることから,CREB3-ARF4経路は主にシス側領域で,GARD経路は主にトランス側領域で制御されていると考えられる.実際に,ブレフェルジンA処理によるゴルジ体の分散はプロテアソーム活性による制御を受けないことも報告されている43).CREB3-ARF4経路とGARD経路の活性化領域の違いは,ゴルジ体ストレス応答がゴルジ体全体で一様に制御されるのではなく,異なる機能ゾーンごとに制御されることを示す一つの例であると考えられる.
糖タンパク質や糖脂質の機能を制御する糖鎖部分を正確に合成するには,小胞体やゴルジ体の恒常性維持が不可欠である.細胞小器官のストレス応答の中で,小胞体ストレス応答は最も詳しく分子機構が解明されている.酵母ではIre1,哺乳類ではATF6, IRE1, PERKというストレスセンサーが発見され,小胞体の機能増強や異常タンパク質の排除の仕組みが明らかにされてきた.また,小胞体ストレス応答を制御する主要な因子群の同定はがんや神経変性疾患,糖尿病などの疾患の発症メカニズムの解明につながった68).一方ゴルジ体ストレス応答では,ゴルジ体の全般的な機能増強を行うTFE3経路をはじめとして,ゴルジ体の異なる機能をそれぞれ増強する複数の経路の存在が示された.しかし,それらの経路において標的遺伝子や転写制御配列,転写因子はいくつか同定されたが,ゴルジ体に局在するストレスセンサーはまだ発見されておらず,分子機構の全容は明らかでない.細胞の環境によって変化する糖鎖構造はさまざまな疾患とも関係しており,たとえばがん細胞では正常細胞とは異なる糖鎖パターンを示すことが報告されている69).糖鎖の複雑性は主にゴルジ体で作り出されることから,細胞環境に応じてゴルジ体の機能を調節するゴルジ体ストレス応答の分子機構が明らかにされれば,糖鎖合成の新たな制御メカニズムの解明やがんなどの疾患の治療方法開発に大きく貢献できると期待している.