糖鎖の機能を調べる研究では,単一の糖鎖や糖タンパク質試薬を必要とする場合がある.これらを細胞発現による生合成によって得るためには,複数の糖転移酵素による連続的な付与が必要となり,複雑な発現プロセスや活性制御が求められる.また,生合成できたとしても,プロダクトの糖鎖構造が不均一となることが多い.そのため,均一な糖鎖を得るためには,今のところ化学合成が最良の選択肢であるのは間違いないであろう.しかし,糖鎖の化学合成技術は専門的かつ高度な知識と技術が必要であり,実現可能な研究室は限られている.一方,糖鎖認識分子であるレクチンに対する結合剤や阻害剤が単に得られればよい場合は,必ずしも元の抗原糖鎖と同一の構造を用意する必要はなく,ペプチドなどの別の分子であったとしても,元の糖鎖リガンドと比較して同等かそれ以上の親和性があれば可能な場合がある.これまで,さまざまなレクチンや抗糖鎖抗体に対して,ランダムペプチドライブラリーを用いてスクリーニングを行うことによって,リガンド糖鎖の構造と機能を模倣させたペプチド(糖鎖模倣ペプチド)の探索が行われており,一部はレクチンに対する阻害効果を示すことが明らかにされている1).ペプチドは化学合成や生合成が比較的容易であり,糖鎖認識分子との結合や阻害効果を示す場合,研究試薬として利用可能なだけでなく,疾患治療薬としての応用も期待できる.
著者が過去に所属していたMichiko N. Fukuda研究室では,当初,がん細胞の転移メカニズムを研究するために,セレクチンの阻害剤を探索した.その過程で,ファージディスプレイ法を用いてルイスA(LeA)糖鎖模倣ペプチドを取得した.これら模倣ペプチドは,確かにセレクチン阻害効果を有するものであった.しかし,がん細胞のin vivoにおける転移実験において,転移がセレクチンとは別の生体内レクチンを介して起こることを見いだした.この発見を機に,研究は当初の予想を超える方向に進展することとなった.本稿では,これら糖鎖模倣ペプチドの発見から始まり,現在の悪性腫瘍の治療を目的とした研究へと発展した経緯について説明するとともに,関連する最近の知見を紹介したい.
2. ファージディスプレイ法を用いた糖鎖模倣ペプチドの獲得戦略
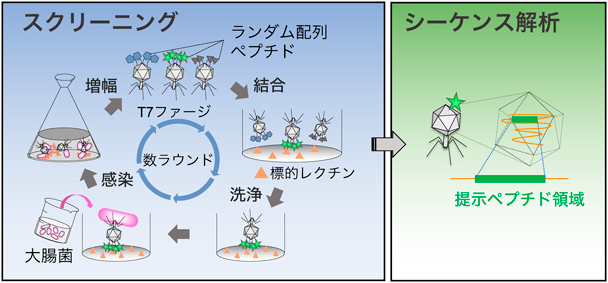
ファージディスプレイ法は,バクテリオファージのキャプシドタンパク質等をコードするDNAの直下に,発現させたいペプチドのDNAを融合させることで,自由に設計したペプチド配列をファージ表面に発現・提示させる技術である.挿入DNAをランダム配列にすることで,構築したファージ集団をランダムペプチドライブラリーとして利用できる.標的分子に結合するファージを取得し,そのDNAを解析することで提示配列が特定できる(図1).現在,ファージディスプレイ法は,ランダムペプチドのみならず,タンパク質(cDNA)や抗体のスクリーニングに広く応用されている.これまで,標的分子をレクチンや抗糖鎖抗体としてスクリーニングすることで,元の糖鎖抗原に類似したペプチドを取得できることが示されてきた1, 2).その代表例として,コンカナバリンA(ConA)に結合するペプチドの研究がある3–5).ConAを標的としたランダムペプチドによるスクリーニングにて,特異的な共通配列としてYPY(Tyr-Pro-Tyr)が見いだされている.このYPY配列の2回リピート配列を含むペプチド(DVFYPYPYASGS)は,KD=46 µMの親和性でConAと結合することや,実際にConAとデキストラン(B-1355S)の結合を阻害することが明らかにされている4).さらに,ペプチドの糖鎖への類似性について,ポリクローナル抗体を用いた交差反応によって詳細に調べられている.すなわち,α-マンノピラノシド(αMan)に対するポリクローナル抗体はDVFYPYPYASGSペプチドに結合すること,その反対の交差性として,抗DVFYPYPYASGSペプチド抗体はmethylαManに結合することが示された5).以上の知見は,ConAに結合するものとして得られてきたペプチドが,対応するリガンド糖鎖の構造を模倣することを示すものである.また,一部のレクチンはリガンド糖鎖と多価の結合を形成することによって親和性を増強しており(クラスター効果),その場合レクチン-単糖間の結合は非常に弱いことが多い.上記のConAの糖鎖模倣ペプチドの実験から,レクチン単体との親和性がKD値としてµMオーダーのペプチドが取得できれば阻害効果が十分発揮できる可能性が示唆された.
セレクチンは細胞接着に関与するレクチンの一種で,シアリルルイスX(sLeX)やシアリルルイスA(sLeA)に結合する.セレクチンファミリーにはE-,L-,P-セレクチンの3種があり,E-セレクチンは培養細胞を用いた系で,がん細胞の接着に関与することが明らかにされている6, 7).Fukuda研究室では,セレクチンに結合し,セレクチンとリガンド糖鎖の結合を阻害可能なペプチドの取得を目指し,ファージディスプレイ法によるスクリーニングを行った.しかし,当初は親和性が弱かったためかファージの濃縮を認めることはできなかった.次に方針を変更し,抗ルイスA(LeA)抗体(clone 7LE)を標的としてスクリーニングを行ったところ,複数のLeA糖鎖模倣ペプチド配列を取得することができた.これらのペプチドのうち,IELLQAR(I-ペプチド)およびその相同配列を有するペプチドは,sLeXやsLeAのE-セレクチンへの結合を実際に阻害するとともに,これら糖鎖を発現させたB16メラノーマ細胞株のE-セレクチンへの接着を阻害した8).この結果は,I-ペプチドin vivoにおいてセレクチンを介したがん細胞の転移を抑制できることを期待させるものであった.しかし,このB16細胞株を用いたin vivoでの実験的肺転移実験では,E-/P-セレクチンダブルノックアウトマウスにおいても細胞の肺への転移が認められた上に,このマウスでもI-ペプチドによって転移が阻害された.この実験結果は従来の仮説に反するものであり,in vivoにおいて転移に関与するE-/P-セレクチン以外の未知の分子の存在を示唆するものとして,大きな驚きをもたらした9).以上の結果を受けて,Fukuda研究室では,血管内皮上の新規受容体分子を同定すべく,I-ペプチドのアフィニティーカラムを用いて,肺がん組織のライセートから受容体を単離した.質量分析の結果,転移に関わる主要な受容体は,Ser/Arg-rich alternative mRNA splicing factors(Sfrs)であることが明らかにされた10).実際に,抗Sfrs抗体をあらかじめ尾静脈投与する実験を行うと,sLeX発現B16細胞株のがん転移がほとんど消失した.また,glycan arrayの結果,Sfrsは糖鎖に対する親和性を有し,タイプ1H,タイプ2H, LeX,dimeric LeX,LeY,LeB糖鎖に結合することが明らかにされた.
以上の結果は,肺組織へのsLeX,sLeA発現B16細胞株の転移においては,従来考えられてきたセレクチン以外の経路の存在を示すものであった.通常,E-セレクチンは正常の血管内皮細胞上には発現しておらず,IL-1βやTNF-αなどの炎症性サイトカインによって刺激されて初めて一過性に発現することが知られており11),E-セレクチンが肺転移の初期の介在因子でない,というFukuda研究室の実験結果と矛盾がない.実際,他グループの報告からも,大腸がん12)およびメラノーマ細胞13)の移植実験モデルでは,E-セレクチンは肺転移や原発腫瘍の形成には必須ではないことが示されている.さらに,実際の患者において,セレクチンを介さない糖鎖依存的ながん細胞転移を示唆する報告14, 15)もあり,今後,Sfrsを介したがん細胞の転移のメカニズムについて詳細な研究が行われることが期待される.
4. IF7ペプチドを用いた悪性腫瘍へのドラッグデリバリーシステム
Fukuda研究室では,上述のSfrs分子に加えて,I-ペプチドに結合するもう一つの分子として,Annexin A1(Anxa1)を同定していた10).Anxa1はほぼすべての細胞内に恒常的に発現しており,通常は細胞表面に露出しないことが知られている.興味深いことに,過去にSchnitzerらの研究室において,Anxa1は悪性腫瘍の新生血管の血流側表面に特異的に発現することが報告されていた16).一方,これまで新生血管マーカーと考えられてきたVEGFR(vascular endothelial growth factor receptor)などの分子は,正常血管表面にも存在していた.この知見は,Anxa1に結合する分子が獲得できれば,それらを用いることで血流を介して悪性腫瘍の新生血管を特異的に標的できることを示唆しており,研究を進める上で非常に重要なヒントとなった.この着想を元に,Fukuda研究室では,I-ペプチドとその相同ペプチドを担がんモデルマウスの尾静脈内に投与する実験を行った.その結果,一部のペプチドは悪性腫瘍に選択的に集積し,その中でも腫瘍に集積する特異性が最も高いペプチドがIFLLWQR配列(IF7ペプチドと命名)であることが明らかとなった17).担がんモデルマウスにあらかじめ抗Anxa1抗体を投与すると,IF7ペプチドの腫瘍への標的能が消失した.このことから,IF7ペプチドによる悪性腫瘍血管標的能は,確かにAnxa1を介して発揮されることが明らかとなった.
ベバシズマブなどの既存の血管新生阻害剤は,新生血管に直接作用することで,結果的にがん細胞へ栄養や酸素を行きわたらせなくする.そのため,低酸素および低栄養状態においても生存可能な耐性細胞がしばしば出現し,腫瘍が再発,悪性化する可能性がある.一方,IF7ペプチドなどのAnxa1結合分子は,悪性腫瘍の新生血管表面に特異的に標的するだけではなく,Anxa1と出会うとトランスサイトーシス機構で血流側から間質側へ輸送され,放出される16–18).したがって,既存の新生血管阻害剤とは異なり,Anxa1結合分子は腫瘍細胞に抗がん剤を直接送達することが期待できるため,きわめて好都合である.Fukuda研究室では,IF7が抗がん剤の運び手となる可能性を考え,塩酸イリノテカンCPT-11の活性体であるSN38をIF7ペプチドとコンジュゲートした薬剤(IF7-SN38)を作製した.ヒト大腸がん細胞株HCT116をヌードマウスの皮下に移植した担がんモデルマウスを作製し,IF7-SN38を尾静脈投与したところ,CPT-11単体の7.4分の1の低投与量(モル換算)で腫瘍の退縮が認められた17).この効果はペプチド配列依存的であり,IF7の逆配列ペプチド(RQWLLFI)では抗腫瘍効果は認められなかった.また,別の実験として,メラノーマ細胞株B16F1,肺がん細胞株LLC,前立腺がん細胞株PC3,乳がん細胞株MDA-MB231の種々の皮下移植モデルマウスを作出した.IF7ペプチドにGeldanamycinの類縁体である17-AAGをコンジュゲートした薬剤を投与したところ,すべての腫瘍の退縮が認められた17).以上の結果から,IF7-SN38はAnxa1を介して悪性腫瘍に集積し,かつ血管内皮細胞を通り越して,抗がん剤をがん細胞へと効率よく送達することができる,新しい悪性腫瘍治療薬となりうることが示された.
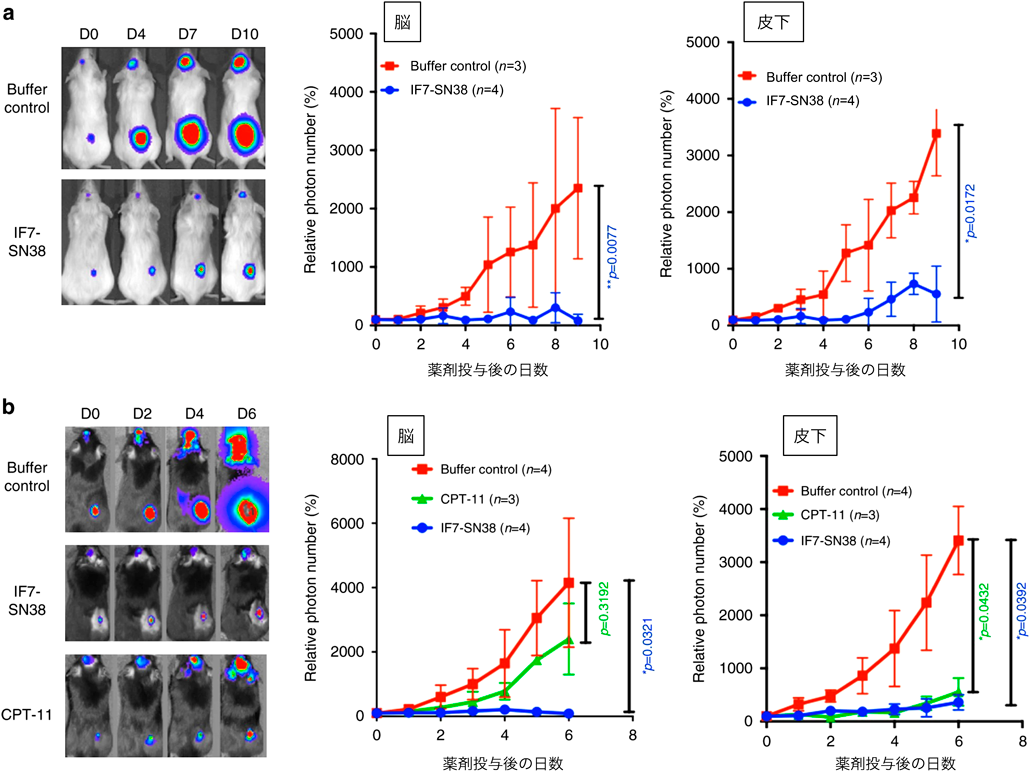
悪性腫瘍の存在する新生血管において,Anxa1が細胞表面に露出するという知見から,著者らは悪性脳腫瘍の新生血管におけるAnxa1の発現パターンに興味を持った.一般的に,脳組織では血液–脳関門が存在し,脳組織への薬剤の送達はきわめて難しいとされる.脳腫瘍内の新生血管においては血液–脳腫瘍関門が存在し,血液–脳関門よりも“leaky”であるものの,薬剤の浸透性は依然として抑制されていることが知られている19, 20).一方,Anxa1がトランスサイトーシスの機能を脳腫瘍においても発揮することができれば,IF7は脳腫瘍細胞に直接抗がん剤を送達可能な新規治療戦略となりうる.著者らは,ラットグリオーマC6細胞をNOD-SCIDマウスの脳に移植し,脳腫瘍マウスを作出した.この脳腫瘍モデルマウスにビオチン化試薬を静脈投与し,血管表面に存在する全タンパク質を標識する実験を行った.脳腫瘍組織を回収し,ライセートを調製した後に,抗Anxa1抗体で共沈してきた画分に存在するビオチン化タンパク質を解析した.質量分析の結果,Anxa1が高い割合で検出されたことから,脳腫瘍における血流側表面においてもAnxa1が発現していることが明らかとなった.次に著者らは,IF7の脳腫瘍部位への標的能を調べた.蛍光標識したIF7を,脳腫瘍モデルマウスに尾静脈投与した後に,腫瘍を含む脳組織の凍結切片を観察したところ,脳腫瘍部位に特異的に蛍光シグナルが検出された.そこで今度は,IF7-SN38が脳腫瘍の増殖に与える治療効果を調べる実験を行った.モデルマウスにおける腫瘍増殖は個体差が大きく,とりわけ皮下腫瘍と脳腫瘍の増殖の度合いを別個体間で比較するのは難しい.そこで,同一マウスに皮下腫瘍と脳腫瘍の両方を移植するdual tumorモデルを構築し,評価することとした21)(図2).もしも,IF7-SN38が血液–脳腫瘍関門を通過することができなければ,皮下腫瘍の増殖は抑制されるが,同一マウスの脳腫瘍は増殖する.一方,血液–脳腫瘍関門を通過することができれば,皮下腫瘍と脳腫瘍の両方の腫瘍増殖が抑制されるはずである.実験はC6細胞をNOD-SCIDマウスの脳に移植する系とB16細胞をC57BL/6マウスの脳に移植する系の二つで確かめた.その結果,CPT-11単体では高投与量の条件下で皮下腫瘍のみ退縮が認められた一方で,IF7-SN38では約7分の1の投与量で脳腫瘍,皮下腫瘍の両方の退縮が観察された.また,上記の二つの系の比較では,C57BL/6マウスにB16細胞を移植した方が予後が良好であった.この結果は,細胞株の違いによる抗がん剤の感受性の問題もあるものの,C57BL/6マウスでは免疫系が正常に近いことによるものであると考えられる.すなわち,抗がん剤でがん細胞が傷害を受けると,最終的には宿主の免疫機構による相乗的な抗腫瘍効果が働くことが示唆された.そこで,B16細胞の担脳腫瘍マウスのうち生き残ったマウスの皮下に,B16細胞を再移植する実験を行った.その結果,再移植されたB16細胞はほとんど大きくならない上に,腫瘍領域へのCD8+ T細胞の集積が認められた.すなわち,生き残った担脳腫瘍マウスにおいては,B16細胞に対する免疫が成立していることが明らかとなった.以上の結果は,IF7-SN38が血液–脳腫瘍関門を通過し,マウスにおける脳腫瘍を治療可能であることを示すものであった.
IF7は悪性腫瘍の新生血管を標的とするという特別な機能を有することから,化学療法の他にも放射線療法分野への応用が考えられている.ホウ素中性子捕捉療法(boron neutron capture therapy:BNCT)は,ホウ素の非放射性同位体である10Bと低エネルギー熱中性子を使用して,きわめて局所的(半径10 µm以内)に核反応を起こすことで,がん細胞のみにダメージを与える治療法である.BNCTが奏効するためには,10Bが特異的に細胞内に存在することが条件とされている.これまでに,二つの主要な10B運搬剤として10BSH(mercapto-undecahydrododecaborate)と10BPA(p-boronophenylalanine)が臨床試験で使用されている.10BSHは分子内に12個のホウ素原子を含むためホウ素の運搬効果は高いが,がん細胞への選択性は低いことが知られている22).また,アミノ酸誘導体である10BPAは,トランスポーターであるLAT1(L-type amino acid transporter 1)を介してがん細胞に取り込まれるが,一部正常細胞にも蓄積し23),非常に高い容量(500 mg/kg)で投与する必要がある.したがって,現在,ホウ素を腫瘍部位へ選択的に送達する手法の開発が期待されている.弘前大学の大山らのグループは,腫瘍への集積度を高めるために,IF7ペプチドに10BPAおよび10BSHをコンジュゲートした薬剤を用いた検討を行った24).膀胱がん細胞を移植した担がんマウスに,きわめて低用量(10~20 mg/kg)で,IF7C(10BPA)RRまたはIF7K(10BSH)RRを投与したところ,腫瘍組織に迅速に10Bが蓄積した.その結果,BNCTの効果が増強され,腫瘍の増殖が顕著に抑制された.以上の結果は,IF7が腫瘍選択的に集積する機能を持つことを再現するとともに,腫瘍部位へ効率的にホウ素を送達可能な,新しいBNCT療法の開発へとつながる可能性を示すものである.
さらに,IF7を用いたイメージング技術への応用も検討されている.IF7を18Fで標識したペプチド(18F-AIF-NOTA-IF7,あるいは18F-AI-NODA-Bn-p-SCN-GGGRDN-IF7)をA431表皮がん細胞移植マウスに静脈注射し,PET(positron emission tomography)イメージングを行ったところ,30分以内でマウス皮下腫瘍に集積した25, 26).また,IF7ナノ粒子を近赤外蛍光試薬DiR標識し,MCF-7/ADR担がんマウスに静脈注射した研究では,in vivoイメージングにて,薬剤投与1時間後には,顕著に腫瘍組織内に蓄積する様子が観察された27).以上の報告から,18F標識IF7やDiR標識IF7ナノ粒子は,腫瘍イメージングのためのトレーサーとして利用できる可能性が示され,今後のIF7を用いたさらなる応用研究の発展が期待される.
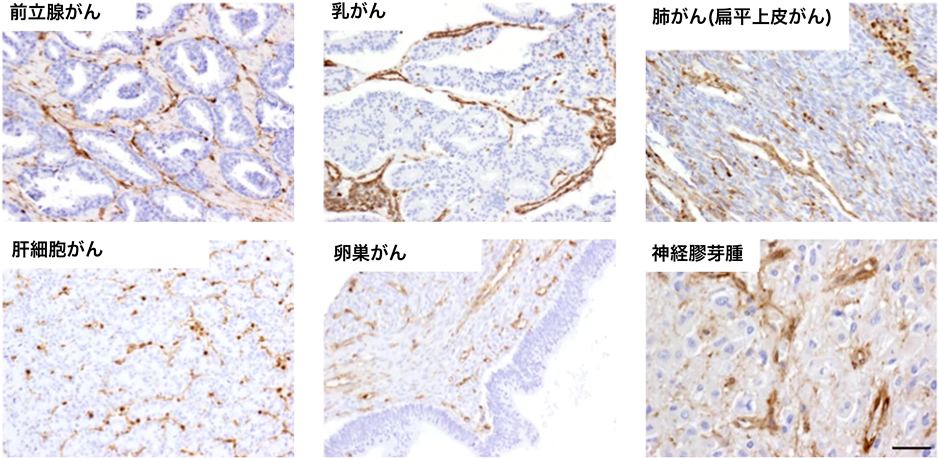
IF7はAnxa1のN末端ドメインに結合すると考えられている.その根拠として,IF7ペプチドの悪性腫瘍への標的能が,Anxa1のN末端に対するポリクローナル抗体で阻害されたことがあげられる17).興味深いことに,Anxa1のN末端ドメイン(32アミノ酸残基)は,他のAnnexinファミリーとの同ドメインにおける相同性が20%程度しかない.一方,ヒトとマウスのN末端ドメインは84%の相同性があり,IF7はヒトとマウスの両方のAnxa1に結合する21).このことは,IF7がAnxa1に特異的であること,マウスを用いた実験結果がヒトにも適用可能であることを示唆するものである.著者らは,Anxa1のN末端ドメインに対するモノクローナル抗体を新たに作製し,さまざまなヒトのがん組織を免疫組織染色法にて確認した.その結果,前立腺がん,乳がん,肺がん,肝がん,脳腫瘍(経膠芽腫)組織の血管内皮細胞においてAnxa1のN末端ドメインの発現が観察された21)(図3).
8. 鏡像スクリーニングによる,安定なペプチドの取得
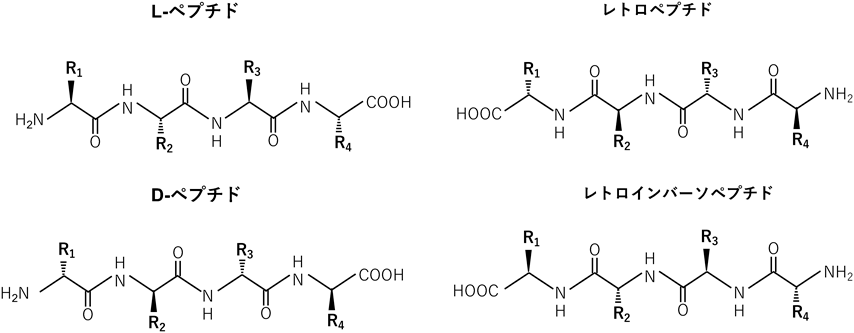
上述の実験で用いたIF7-SN38コンジュゲートでは,IF7は生体内のエステラーゼによって分解可能なリンカーを介してSN38と結合させており,腫瘍血管に到達するとSN38を放出する設計としていた17, 21).しかし,IF7ペプチド自体もプロテアーゼの影響を受けやすいこともあり,生体内ではIF7-SN38は全体として安定性が悪いことが問題であった17).従来,ペプチド薬剤の安定性を高める検討として,環状化ペプチドによるプロテアーゼ耐性化などが考えられているが28),プロテアーゼによる分解を完全に回避するものではない.また,各アミノ酸のキラリティを反転させたD-アミノ酸を用いたペプチドは,体内のペプチダーゼの基質とはならないため,安定性が高いことが知られている.レトロインバーソ(retro-inverso)ペプチドは,ペプチドのアミノ酸残基を逆配列にした上で,D-アミノ酸にしており,元のL-ペプチドの側鎖の配向性が同じ構造をとる(図4).レトロインバーソペプチドは,元のペプチドに比べて,安定性,バイオアベイラビリティ,治療効果を高めることができるとされる29).しかし,レトロインバーソペプチドは完全にはL-ペプチドと構造的に一致するものではないため,ほとんどの場合,生物活性の低下または抑制が起こる可能性がある.実際,IF7ペプチドのレトロインバーソ体(RIF7ペプチド)が報告されているが30),腫瘍組織だけでなく,正常臓器にも非特異的に集積していることが示されている.以上から,レトロインバーソペプチドは安定性を高める可能性があるものの,IF7の機能を完全に保持するには十分ではないと考えた.
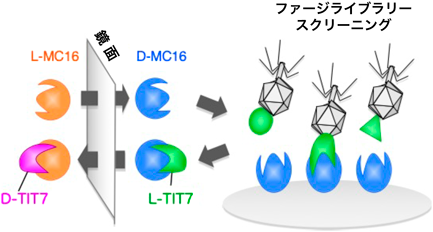
そこで著者らは,Anxa1のN末端領域に直接結合し,かつD-アミノ酸で構成可能なペプチドを探索するために,鏡像スクリーニング31, 32)の手法を用いることとした(図5).この方法であれば,D-アミノ酸に反転させながら標的分子との結合活性を保持できる.この手法は,まず標的分子であるAnxa1のN末端領域のペプチドをD-アミノ酸を用いて化学合成し,D-Anxa1を標的としてファージディスプレイ法によるスクリーニングを実施する.得られたペプチド配列の情報を用いてD-ペプチドを化学合成すれば,元の標的分子であるL-Anxa1 N末端領域に結合するはずである.著者らは,この鏡像スクリーニングを実施することにより,7アミノ酸残基からなるD-ペプチド配列TITWPTM(dTIT7)を取得した33).脳腫瘍モデルを用いたin vivoイメージングにより,dTIT7は72時間もの間,安定的に腫瘍部位に集積した.また,D-ペプチドはプロテアーゼ耐性であるため,この特性を活かすために,安定なリンカーを介してより強力な抗がん剤GeldanamycinをコンジュゲートさせることでdTIT-Geldanamycin(dTIT7-GA)を作製した.ここで,Geldanamycinの類縁体である17-DMAGは経口投与可能であること34)から,dTIT7-GAも経口投与にて抗腫瘍効果を発揮する可能性を考えた.まず,経口投与によりdTIT7-GAがどの程度血液中に吸収されるかを確かめるために,脳腫瘍モデルマウスに同位体標識したdTIT7を経口投与し,LC-MS/MS分析を用いて血中のGA-dTIT7を定量する検討を行った.GA-dTIT7(1 mg)を経口投与すると,血漿中の薬物濃度は30分でピーク(3 µg/mL程度)に達し,経口投与が可能であることが示された.そこで,C57BL/6マウス由来のメラノーマB16細胞を同系統マウスの脳に移植し,腫瘍の増殖をin vivoイメージングにてモニタリングする実験を行った.GA-dTIT7(2 mg, 1.16 µM)を5日間連続で経口投与したところ,腫瘍の増殖が顕著に抑えられたのに対し,GA-C(システインのみ)の薬剤を同当量経口投与したモデルでは脳腫瘍が増殖し続けた.また,この結果は,ラットグリオーマC6細胞をヌードマウスに移植したマウスにおいても同様の傾向が認められた33).以上の結果は,GA-dTIT7がin vivoマウスモデルにおいて経口投与によって脳腫瘍に奏効することを実証するものであった.
IF7やdTIT7は,腫瘍組織に単に拡散するのではなく,積極的に腫瘍組織に集積するという特別な機能を有する.マウスモデルにおいて低容量で治療効果を示したのはこのためだと考えている.これまで高い抗腫瘍効果を示すものの副作用が問題となっていた薬剤においても,IF7とコンジュゲートすることにより,腫瘍領域へ特異的に浸透させることができ,治療薬としての有用性を高めることができるかもしれない.また,IF7の腫瘍への蓄積能は,マウスを用いた実験において,脳腫瘍などの血液–脳腫瘍関門が存在する環境でも認められた.この知見がヒトにも適用可能であれば,既存の抗がん剤を患者の脳腫瘍部位に直接送達することができるようになるかもしれない.興味深いことに,IF7ペプチドは最初から悪性腫瘍に集積するものを意図して発見されたわけではない.むしろ,セレクチン阻害ペプチドを取得するための研究から始まり,研究室内外のさまざまな知見とともに,まさに偶然といえるほどの発見の連鎖によって発展してきた.これは,基礎研究の発見が思いもよらない成果をもたらした一例といってもよいであろう.
Anxa1はほぼすべての細胞において細胞内に発現する分子とされている.IF7ペプチドの研究を通じて,Anxa1の生物学的意義やメカニズムに関して,新たな問いも生じている.たとえば,Anxa1はどのようなメカニズムで新生血管の内皮細胞表面に移動するのか,という問いである.また,マウスではAnxa1を欠損しても,特に発育に遅延はみられない35).ただし,刺激を伴う現象,すなわち腫瘍における血管新生などの場合には,Anxa1欠損マウスにおいて血管形成の遅延が観察されることがわかっている36).この報告から,通常の血管形成と腫瘍内での新生血管形成では特徴が異なり,後者にはAnxa1が関与している可能性が考えられるが,詳細なメカニズムはわかっていない.今後,これらの問いに対する研究成果が得られることが期待される.
ファージライブラリーにおいて,多様性の高さはスクリーニングの成否を決める重要な要素である.これまで著者らは,T7ファージにおいて,シームレスクローニングと無細胞翻訳系を利用することで多様性が109を超えるペプチドライブラリーを効率的に作製できることを明らかにした37).現在,長さの異なる環状短鎖ペプチドライブラリーの他,タンパク質や低分子化抗体などのさまざまなライブラリーを作製している.また,ファージディスプレイ法は次世代シーケンス解析との相性がよく,数百万のペプチド配列を同時に解析することで,エピトープの相同配列を推定することが可能になっている.今後,これらの技術を用いて,より親和性と特異性が高い糖鎖模倣ペプチドを取得し,糖鎖が関与するさまざまな難治性疾患への応用を見据えた研究を展開したいと考えている.
引用文献References
1) Matsubara, T. (2022) Peptide mimotopes to emulate carbohydrates. Chem. Soc. Rev., 51, 8160–8173.
2) Fukuda, M.N. (2012) Peptide-displaying phage technology in glycobiology. Glycobiology, 22, 318–325.
3) Scott, J.K., Loganathan, D., Easley, R.B., Gong, X., & Goldstein, I.J. (1992) A family of concanavalin A-binding peptides from a hexapeptide epitope library. Proc. Natl. Acad. Sci. USA, 89, 5398–5402.
4) Oldenburg, K.R., Loganathan, D., Goldstein, I.J., Schultz, P.G., & Gallop, M.A. (1992) Peptide ligands for a sugar-binding protein isolated from a random peptide library. Proc. Natl. Acad. Sci. USA, 89, 5393–5397.
5) Kaur, K.J., Khurana, S., & Salunke, D.M. (1997) Topological analysis of the functional mimicry between a peptide and a carbohydrate moiety. J. Biol. Chem., 272, 5539–5543.
6) Takada, A., Ohmori, K., Yoneda, T., Tsuyuoka, K., Hasegawa, A., Kiso, M., & Kannagi, R. (1993) Contribution of carbohydrate antigens sialyl Lewis A and sialyl Lewis X to adhesion of human cancer cells to vascular endothelium. Cancer Res., 53, 354–361.
7) Sawada, R., Tsuboi, S., & Fukuda, M. (1994) Differential E-selectin-dependent adhesion efficiency in sublines of a human colon cancer exhibiting distinct metastatic potentials. J. Biol. Chem., 269, 1425–1431.
8) Fukuda, M.N., Ohyama, C., Lowitz, K., Matsuo, O., Pasqualini, R., Ruoslahti, E., & Fukuda, M. (2000) A peptide mimic of E-selectin ligand inhibits sialyl Lewis X-dependent lung colonization of tumor cells. Cancer Res., 60, 450–456.
9) Zhang, J., Nakayama, J., Ohyama, C., Suzuki, M., Suzuki, A., Fukuda, M., & Fukuda, M.N. (2002) Sialyl Lewis X-dependent lung colonization of B16 melanoma cells through a selectin-like endothelial receptor distinct from E- or P-selectin. Cancer Res., 62, 4194–4198.
10) Hatakeyama, S., Sugihara, K., Nakayama, J., Akama, T.O., Wong, S.-M.A., Kawashima, H., Zhang, J., Smith, D.F., Ohyama, C., Fukuda, M., et al. (2009) Identification of mRNA splicing factors as the endothelial receptor for carbohydrate-dependent lung colonization of cancer cells. Proc. Natl. Acad. Sci. USA, 106, 3095–3100.
11) Kannagi, R., Izawa, M., Koike, T., Miyazaki, K., & Kimura, N. (2004) Carbohydrate-mediated cell adhesion in cancer metastasis and angiogenesis. Cancer Sci., 95, 377–384.
12) Laubli, H. & Borsig, L. (2010) Selectins as mediators of lung metastasis. Cancer Microenviron., 3, 97–105.
13) Taverna, D., Moher, H., Crowley, D., Borsig, L., Varki, A., & Hynes, R.O. (2004) Increased primary tumor growth in mice null for β3- or β3/β5-integrins or selectins. Proc. Natl. Acad. Sci. USA, 101, 763–768.
14) Miyake, M., Taki, T., Hitomi, S., & Hakomori, S. (1992) Correlation of expression of H/Le(y)/Le(b) antigens with survival in patients with carcinoma of the lung. N. Engl. J. Med., 327, 14–18.
15) Schwartz, A.M., Silverberg, S.G., Fu, Y.S., Nozawa, S., Huang, S., Tsukasaki, K., & Williams, K.R. (1993) Use of monoclonal antibodies MSN-1 and B72.3 in the prediction of the natural history of endometrial hyperplasia. Int. J. Gynecol. Pathol., 12, 253–258.
16) Oh, P., Li, Y., Yu, J., Durr, E., Krasinska, K.M., Carver, L.A., Testa, J.E., & Schnitzer, J.E. (2004) Subtractive proteomic mapping of the endothelial surface in lung and solid tumours for tissue-specific therapy. Nature, 429, 629–635.
17) Hatakeyama, S., Sugihara, K., Shibata, T.K., Nakayama, J., Akama, T.O., Tamura, N., Wong, S.-M., Bobkov, A.A., Takano, Y., Ohyama, C., et al. (2011) Targeted drug delivery to tumor vasculature by a carbohydrate mimetic peptide. Proc. Natl. Acad. Sci. USA, 108, 19587–19592.
18) Oh, P., Testa, J.E., Borgstrom, P., Witkiewicz, H., Li, Y., & Schnitzer, J.E. (2014) In vivo proteomic imaging analysis of caveolae reveals pumping system to penetrate solid tumors. Nat. Med., 20, 1062–1068.
19) Sarkaria, J.N., Hu, L.S., Parney, I.F., Pafundi, D.H., Brinkmann, D.H., Laack, N.N., Giannini, C., Burns, T.C., Kizilbash, S.H., Laramy, J.K., et al. (2018) Is the blood-brain barrier really disrupted in all glioblastomas? A critical assessment of existing clinical data. Neuro-oncol., 20, 184–191.
20) Arvanitis, C.D., Ferraro, G.B., & Jain, R.K. (2019) The blood–brain barrier and blood–tumour barrier in brain tumours and metastases. Nat. Rev. Cancer, 20, 26–41.
21) Nonaka, M., Suzuki-Anekoji, M., Nakayama, J., Mabashi-Asazuma, H., Jarvis, D.L., Yeh, J.-C., Yamasaki, K., Akama, T.O., Huang, C.-T., Campos, A.R., et al. (2020) Overcoming the blood-brain barrier by Annexin A1-binding peptide to target brain tumours. Br. J. Cancer, 123, 1633–1643.
22) Iguchi, Y., Michiue, H., Kitamatsu, M., Hayashi, Y., Takenaka, F., Nishiki, T.-I., & Matsui, H. (2015) Tumor-specific delivery of BSH-3R for boron neutron capture therapy and positron emission tomography imaging in a mouse brain tumor model. Biomaterials, 56, 10–17.
23) Mishima, Y., Honda, C., Ichihashi, M., Obara, H., Hiratsuka, J., Fukuda, H., Karashima, H., Kobayashi, T., Kanda, K., & Yoshino, K. (1989) Treatment of malignant melanoma by single thermal neutron capture therapy with melanoma-seeking 10B-compound. Lancet, 2, 388–389.
24) Yoneyama, T., Hatakeyama, S., Sutoh Yoneyama, M., Yoshiya, T., Uemura, T., Ishizu, T., Suzuki, M., Hachinohe, S., Ishiyama, S., Nonaka, M., et al. (2021) Tumor vasculature-targeted 10B delivery by an Annexin A1-binding peptide boosts effects of boron neutron capture therapy. BMC Cancer, 21, 72.
25) Gu, X., Jiang, M., Pan, D., Cai, G., Zhang, R., Zhou, Y., Ding, Y., Zhu, B., & Lin, X. (2016) Preliminary evaluation of novel 18F-AlF-NOTA-IF7 as a tumor imaging agent. J. Radioanal. Nucl. Chem., 308, 851–856.
26) Chen, F., Xiao, Y., Shao, K., Zhu, B., & Jiang, M. (2020) Positron emission tomography imaging of a novel Anxa1-targeted peptide 18F-Al-NODA-Bn-p-SCN-GGGRDN-IF7 in A431 cancer mouse models. J. Labelled Comp. Radiopharm., 63, 494–501.
27) Yu, D.-H., Liu, Y.-R., Luan, X., Liu, H.-J., Gao, Y.-G., Wu, H., Fang, C., & Chen, H.-Z. (2015) IF7-conjugated nanoparticles target annexin 1 of tumor vasculature against P-gp mediated multidrug resistance. Bioconjug. Chem., 26, 1702–1712.
28) Zorzi, A., Deyle, K., & Heinis, C. (2017) Cyclic peptide therapeutics: Past, present and future. Curr. Opin. Chem. Biol., 38, 24–29.
29) Chorev, M. & Goodman, M. (1995) Recent developments in retro peptides and proteins—An ongoing topochemical exploration. Trends Biotechnol., 13, 438–445.
30) Chen, X., Fan, Z., Chen, Y., Fang, X., & Sha, X. (2013) Retro-inverso carbohydrate mimetic peptides with annexin1-binding selectivity, are stable in vivo, and target tumor vasculature. PLoS One, 8, e80390.
31) Funke, S.A. & Willbold, D. (2009) Mirror image phage display—A method to generate D-peptide ligands for use in diagnostic or therapeutical applications. Mol. Biosyst., 5, 783–786.
32) Schumacher, T.N., Mayr, L.M., Minor, D.L. Jr., Milhollen, M.A., Burgess, M.W., & Kim, P.S. (1996) Identification of D-peptide ligands through mirror-image phage display. Science, 271, 1854–1857.
33) Nonaka, M., Mabashi-Asazuma, H., Jarvis, D.L., Yamasaki, K., Akama, T.O., Nagaoka, M., Sasai, T., Kimura-Takagi, I., Suwa, Y., Yaegashi, T., et al. (2021) Development of an orally-administrable tumor vasculature-targeting therapeutic using annexin A1-binding D-peptides. PLoS One, 16, e0241157.
34) Ikebe, E., Kawaguchi, A., Tezuka, K., Taguchi, S., Hirose, S., Matsumoto, T., Mitsui, T., Senba, K., Nishizono, A., Hori, M., et al. (2013) Oral administration of an HSP90 inhibitor, 17-DMAG, intervenes tumor-cell infiltration into multiple organs and improves survival period for ATL model mice. Blood Cancer J., 3, e132.
35) Hannon, R., Croxtall, J.D., Getting, S.J., Roviezzo, F., Yona, S., Paul-Clark, M.J., Gavins, F.N.E., Perretti, M., Morris, J.F., Buckingham, J.C., et al. (2003) Aberrant inflammation and resistance to glucocorticoids in annexin 1−/− mouse. FASEB J., 17, 253–255.
36) Yi, M. & Schnitzer, J.E. (2009) Impaired tumor growth, metastasis, angiogenesis and wound healing in annexin A1-null mice. Proc. Natl. Acad. Sci. USA, 106, 17886–17891.
37) Higashi, K., Oda, S., Fujii, M., Nishida, F., Matsumoto, H., Morise, J., Oka, S., & Nonaka, M. (2023) Construction of a T7 phage random peptide library by combining seamless cloning with in vitro translation. J. Biochem., 175, 85–93.
著者紹介Author Profile
 野中 元裕(のなか もとひろ)
野中 元裕(のなか もとひろ)京都大学大学院医学研究科人間健康科学系専攻分子生命基礎医療科学 教授.博士(薬学).
略歴2008年京都大学大学院薬学研究科にて学位取得.11~14年Sanford Burnham Prebys研究所,14~17年産業技術総合研究所,17~19年京都大学大学院薬学研究科,19〜24年医学研究科人間健康科学系専攻准教授を経て,24年より現職.
研究テーマと抱負研究室では,がんや自己免疫疾患などの難治性疾患の新規診断・治療法の開発を行っています.特に,ファージディスプレイ法を用いて,ペプチド,抗体,タンパク質の取得を行っています.
ウェブサイトhttps://nonaka-lab.hs.med.kyoto-u.ac.jp