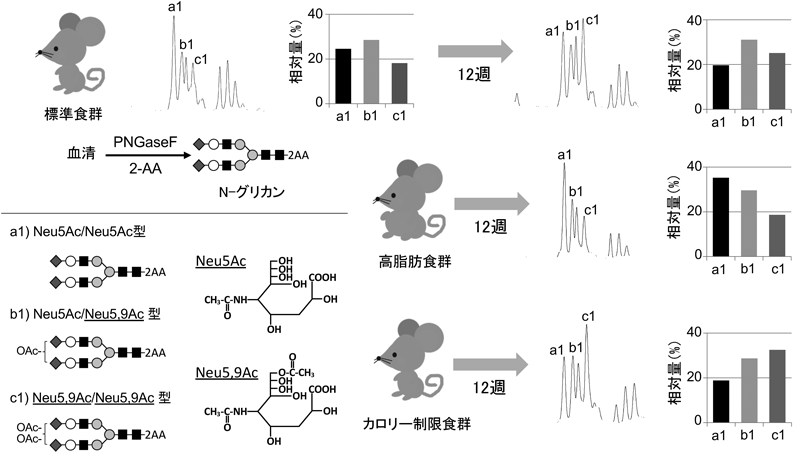
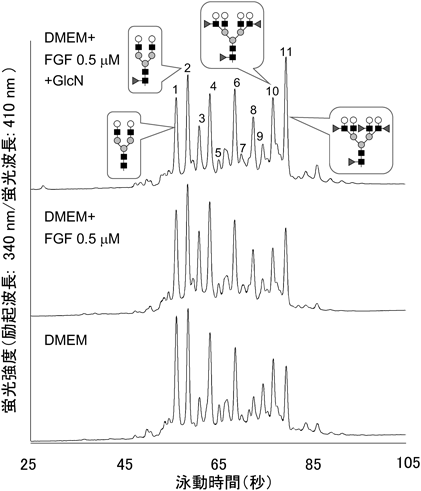
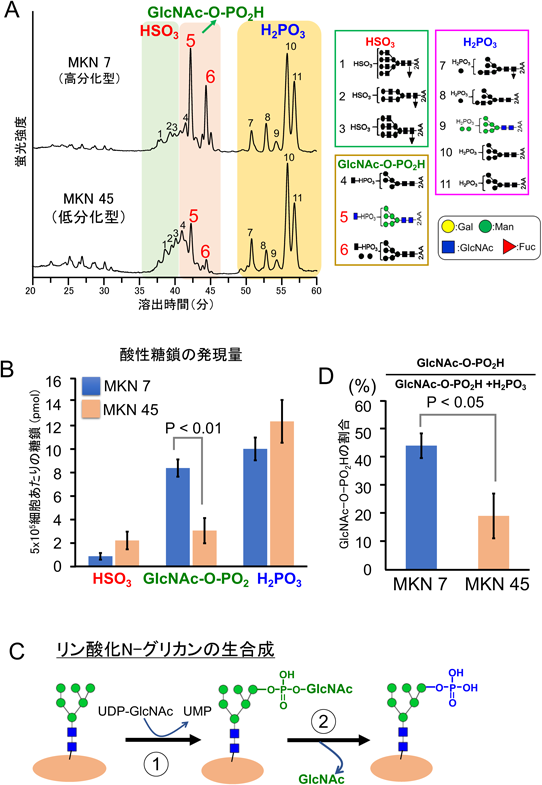
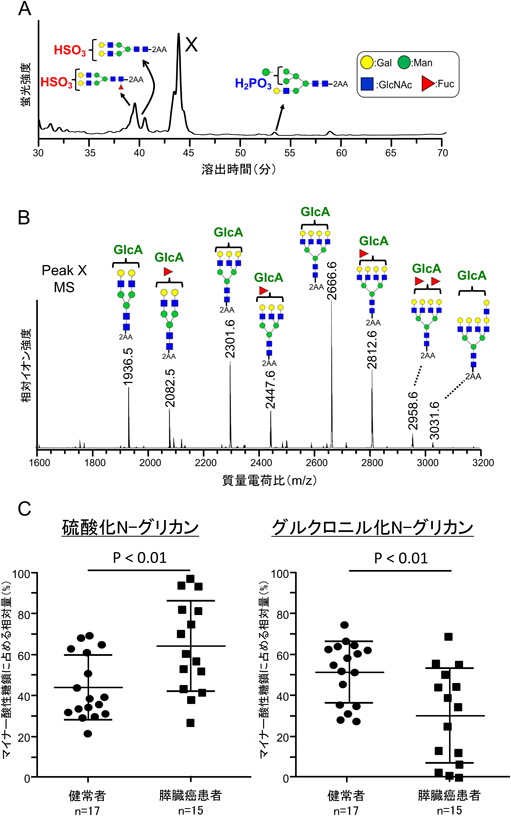
糖鎖の深層理解のための分析技術~糖鎖の定量解析技術が果たす役割~Analytical techniques for deep understanding of significance of glycan: Roles and responsibilities of quantitative glycan analysis in biochemistry
1 近畿大学薬学部創薬科学科Department of Pharmaceutical Sciences, Kindai University ◇ 〒577–8502 大阪府東大阪市小若江3–4–1 ◇ 3–4–1 Kowakae, Higashi-osaka, Osaka 577–8502, Japan
2 大阪大谷大学薬学部Faculty of Pharmacy, Osaka Ohtani University ◇ 〒584–8540 大阪府富田林市錦織北3–11–1 ◇ 3–11–1 Nishikiori-kita, Tondabayashi, Osaka 584–8540, Japan