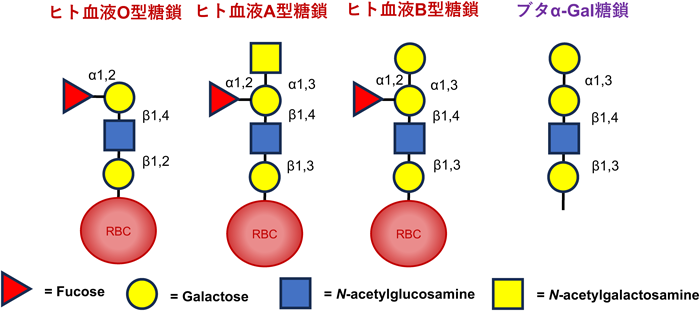
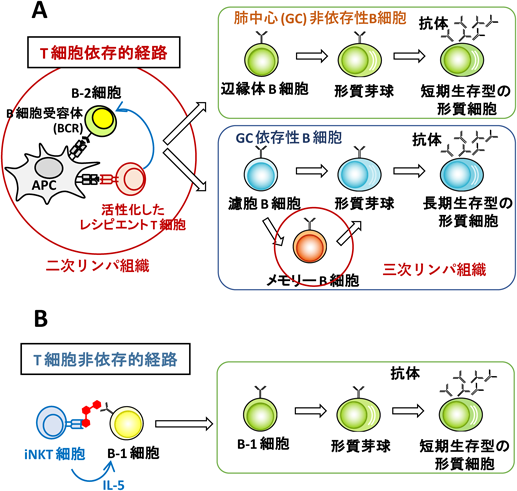
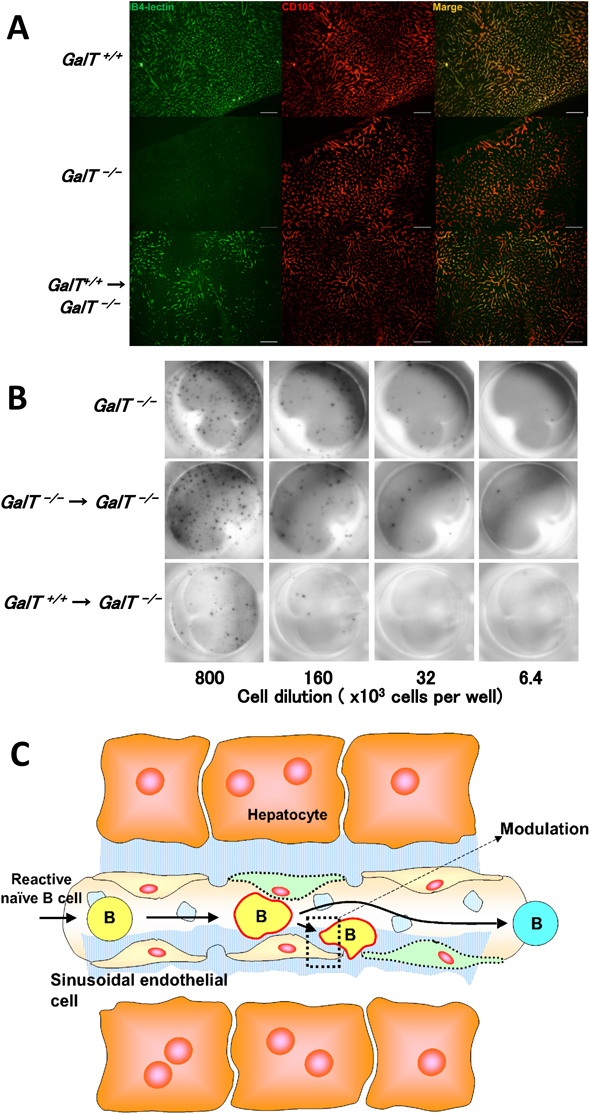
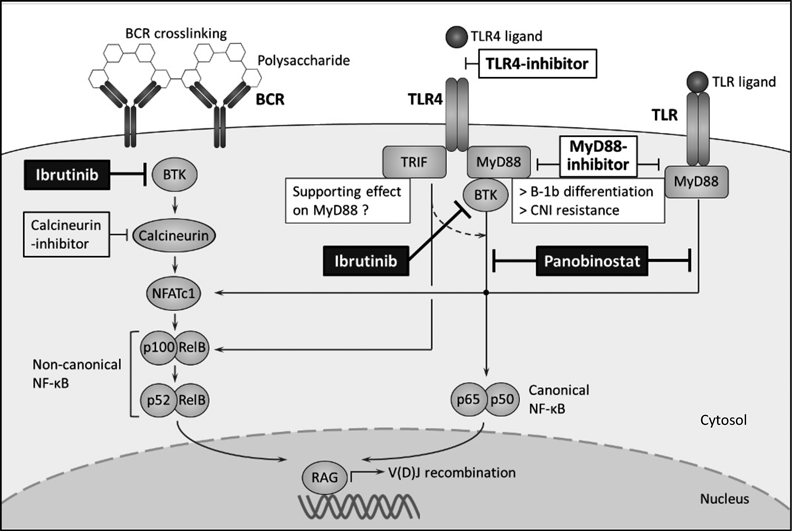
臓器移植における糖鎖抗原に対するB細胞応答B cell responses to carbohydrate antigens in organ transplantation
広島大学大学院医系科学研究科消化器・移植外科学Department of Gastroenterological and Transplant Surgery, Graduate School of Biomedical and Health Sciences, Hiroshima University ◇ 〒734–8551 広島市南区霞1–2–3 ◇ 1–2–3 Kasumi, Minami-ku, Hiroshima 734–8551, Japan