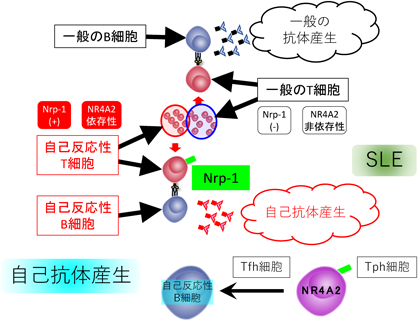
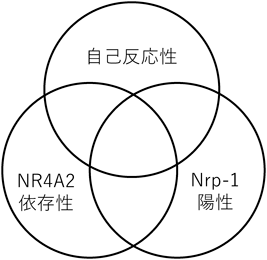
自己反応性ヘルパーT細胞の性状解析と新しい自己免疫疾患治療法の可能性Analysis on self-reactive T helper cells and its therapeutic application for autoimmune diseases
国立精神・神経医療研究センター神経研究所免疫研究部Department of Immunol, NIN, National Center of Neurology and Pshychiatry (NCNP) ◇ 〒187–8502 東京都小平市小川東町4–1–1 ◇ 4–1–1 Ogawahigashi-machi, Kodaira Tokyo 187–8502, Japan