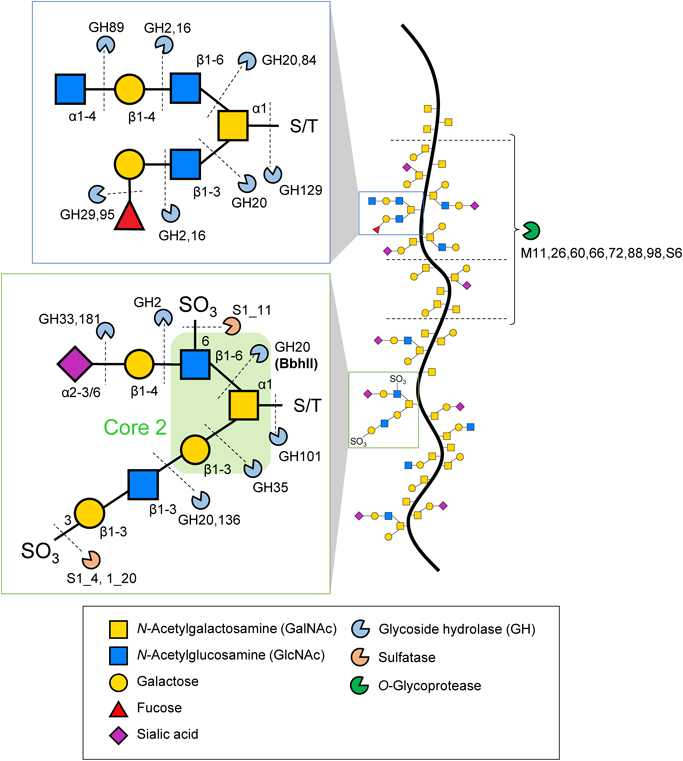
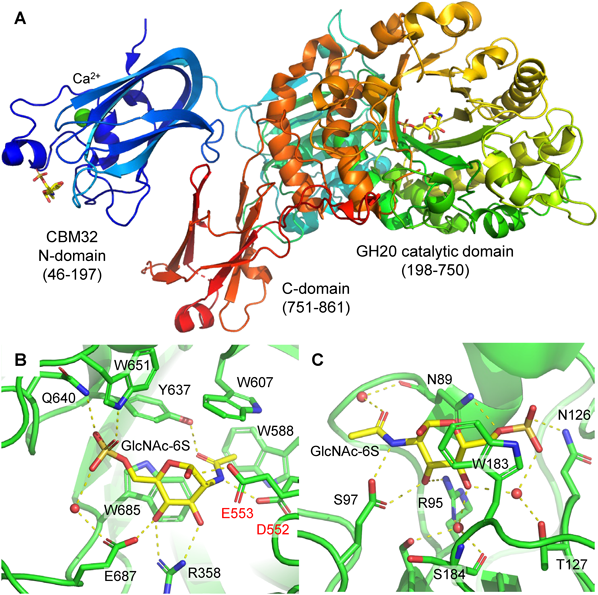
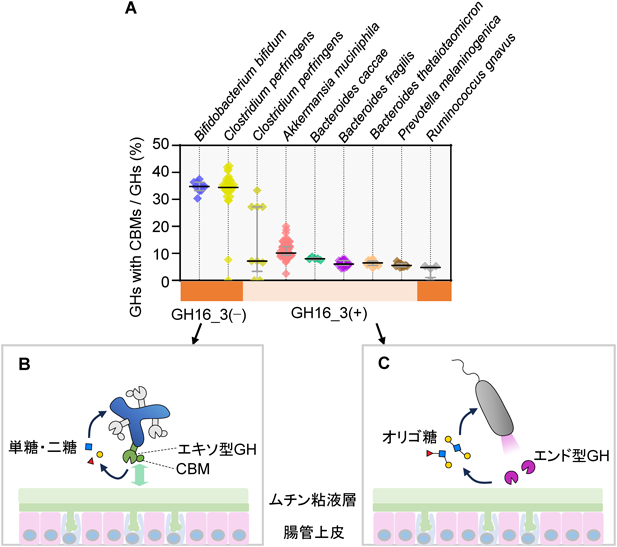
腸内細菌による硫酸化ムチン糖鎖の新規分解経路の発見と解析Discovery and analysis of novel degradation pathway of sulfated mucin O-glycan by gut microbes
1 京都大学大学院生命科学研究科Graduate School of Biostudies, Kyoto University ◇ 〒606–8502 京都市左京区北白川追分町 ◇ Oiwake-cho, Kitashirakawa, Sakyo-ku, Kyoto 606–8502, Japan
2 明治大学農学部School of Agriculture, Meiji University ◇ 〒214–8571 神奈川県川崎市多摩区東三田1–1–1 ◇ 1–1–1 Higashi-Mita, Tama-ku, Kawasaki-shi, Kanagawa 214–8571, Japan
3 東京大学大学院農学生命科学研究科Graduate School of Agricultural and Life Sciences, The University of Tokyo ◇ 〒113–8657 東京都文京区弥生1–1–1 ◇ 1–1–1 Yayoi, Bunkyo-ku, Tokyo 113–8657, Japan