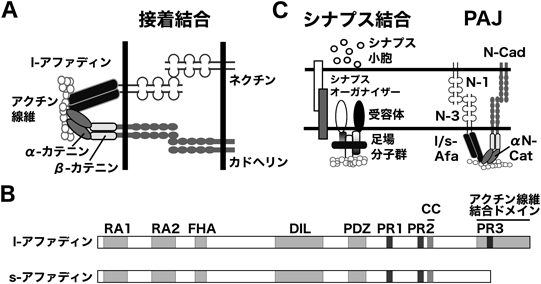
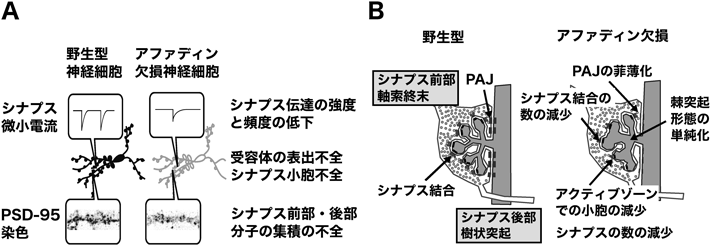
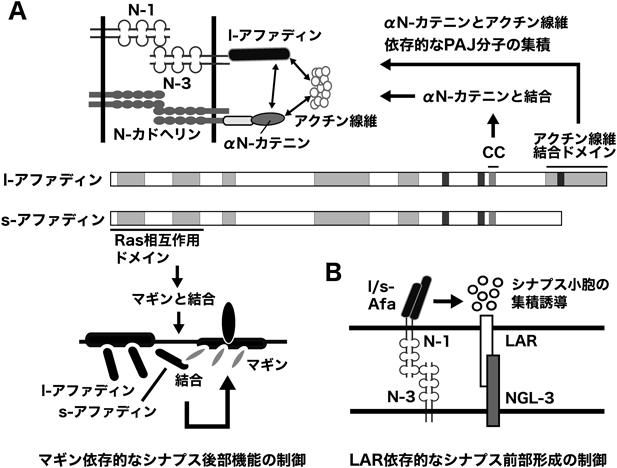
接着結合裏打ち分子アファディンによるシナプスの形成と機能の制御機構Regulation of the synapse formation and function by the adherens junction protein afadin
1 北里大学大学院医療系研究科分子細胞神経生物学Department of Molecular and Cellular Neurobiology, Kitasato University Graduate School of Medical Sciences ◇ 〒252–0374 神奈川県相模原市南区北里1–15–1 ◇ 1–15–1 Kitazato, Minami, Sagamihara, Kanagawa 252–0374, Japan
2 北里大学医学部生化学Department of Biochemistry, Kitasato University School of Medicine ◇ 〒252–0374 神奈川県相模原市南区北里1–15–1 ◇ 1–15–1 Kitazato, Minami, Sagamihara, Kanagawa 252–0374, Japan