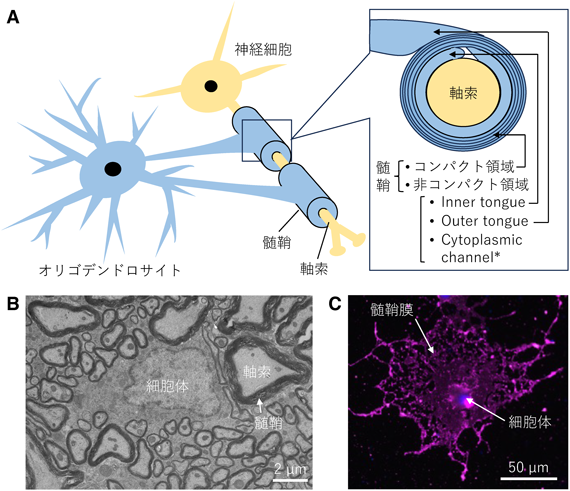
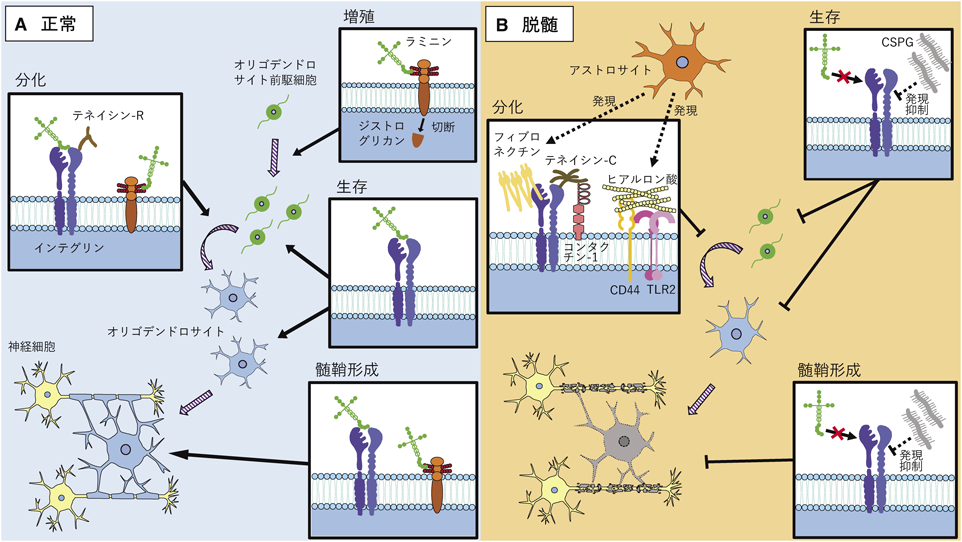
細胞外マトリックス分子によるオリゴデンドロサイトの発生・分化の制御機構The regulatory mechanism of oligodendrocyte development and differentiation by extracellular matrix molecules
東京医科歯科大学大学院医歯学総合研究科Graduate school of Medical and Dental Sciences, Tokyo Medical and Dental University ◇ 〒113–8510 東京都文京区湯島1–5–45 ◇ 1–5–45 Yushima, Bunkyo-ku, Tokyo 113–8510, Japan