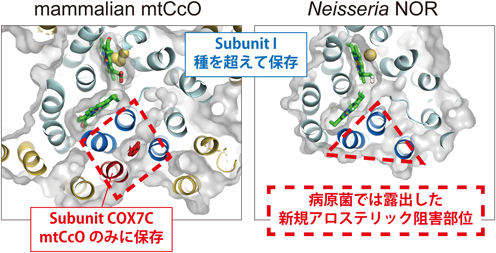
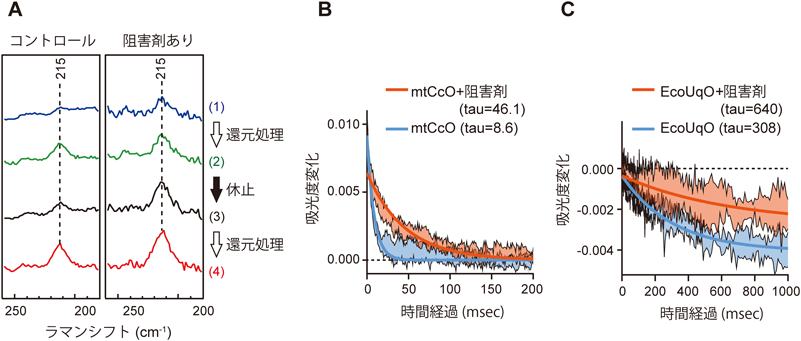
呼吸鎖酵素の新規アロステリック調節機構に基づく抗菌剤開発への展開Conserved allostery buried inside mitochondrial heme-copper oxidases can generate novel antibiotics
国立循環器病研究センター・分子薬理部National Cerebral and Cardiovascular Center ◇ 〒564–8565 大阪府吹田市岸部新町6–1 ◇ 6–1 Kishibe Shimmachi, Suita, Osaka 564–8565, Japan