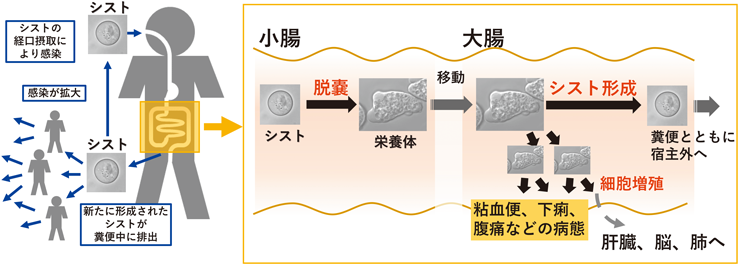
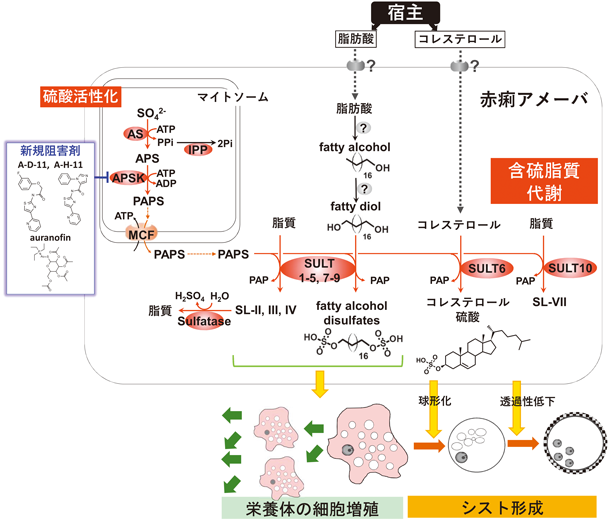
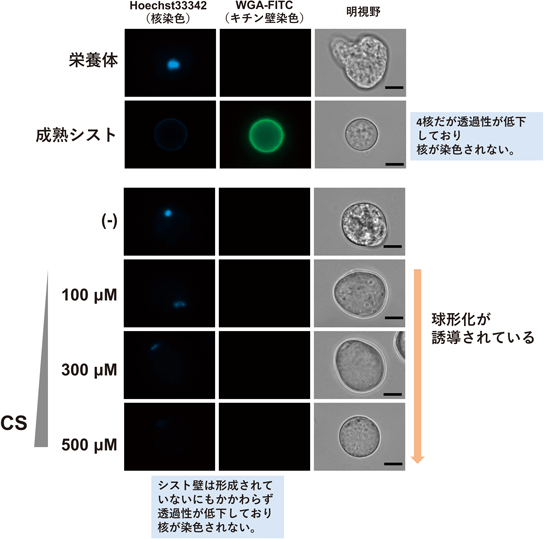
寄生原虫,赤痢アメーバの含硫脂質代謝経路の意義Unique features of Entamoeba sulfolipid metabolism
1 長崎大学熱帯医学研究所・共同研究室Central Laboratory, Institute of Tropical Medicine (NEKKEN), Nagasaki University ◇ 〒852–8523 長崎県長崎市坂本1丁目12–4 ◇ 1–12–4 Sakamoto, Nagasaki 852–8523, Japan
2 長崎大学大学院医歯薬学総合研究科原虫生化学分野Central Laboratory, Institute of Tropical Medicine (NEKKEN), Nagasaki University ◇ 〒852–8523 長崎県長崎市坂本1丁目12–4 ◇ 1–12–4 Sakamoto, Nagasaki 852–8523, Japan