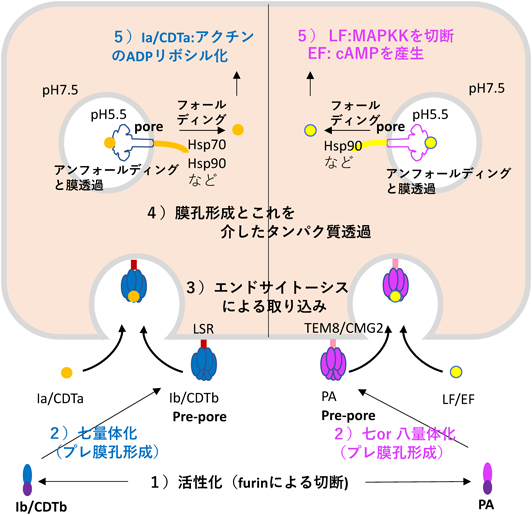
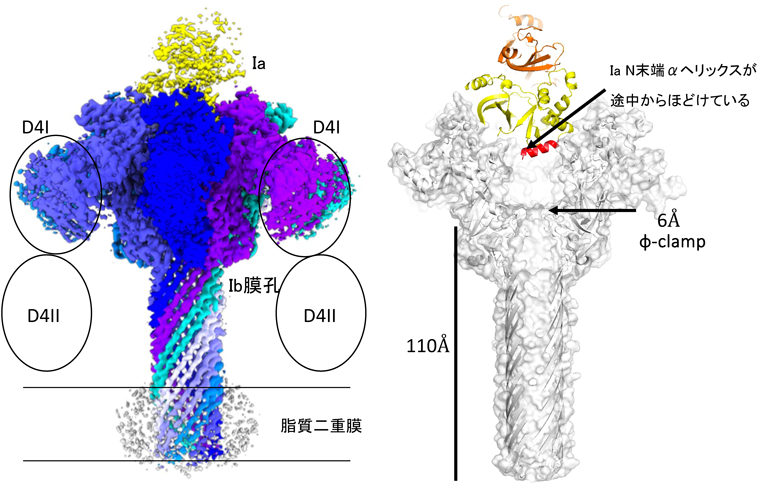
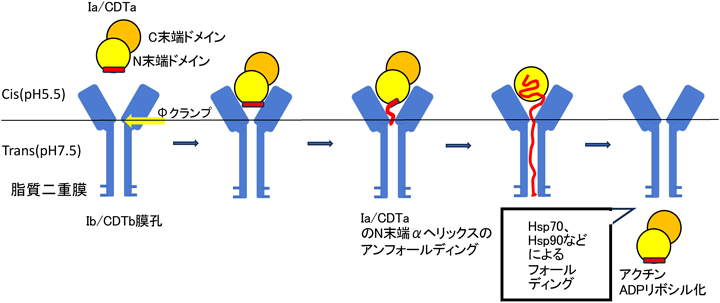
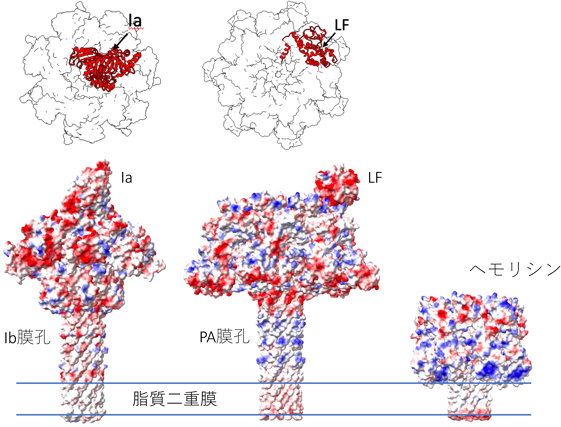
アンフォールディングと共役したタンパク質膜透過を行うナノシリンジ:二成分毒素の構造基盤Structural basis of protein co-translocational unfolding by two component toxins
1 京都産業大学生命科学部Faculty of Life Sciences, Kyoto Sangyo University ◇ 〒603–8555 京都府京都市北区上賀茂本山15322 ◇ 15322 Kamigamo-motoyama, Kita-ku, Kyoto 603–8555, Japan
2 日本女子大学理学部化学生命科学科Department of Chemical and Biological Sciences, Faculty of Science, Japan Women’s University ◇ 〒112–0015 東京都文京区目白台2丁目8–1 ◇ 2–8–1 Mejirodai, Bunkyo-ku, Tokyo 112–8681, Japan