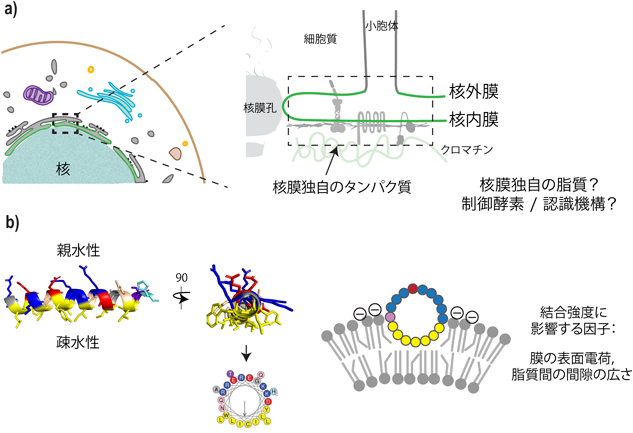
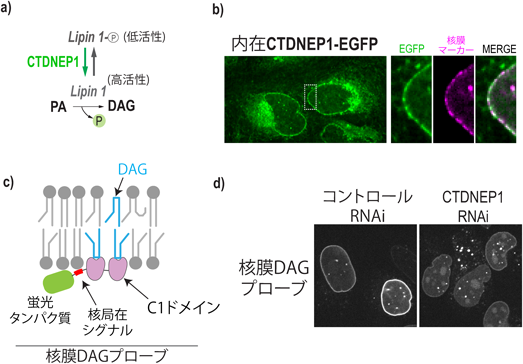
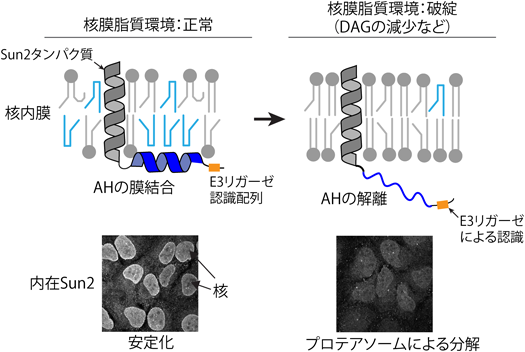
核膜の脂質環境は,両親媒性ヘリックスを介してタンパク質分解を制御するLipid environment of the nuclear membrane is linked to protein degradation by an amphipathic helix
イェール大学分子細胞発生生物学部門Department of Molecular, Cellular and Developmental Biology, Yale University ◇ 266 Whitney Ave., New Haven, CT 06511, USA ◇ 266 Whitney Ave., New Haven, CT 06511, USA