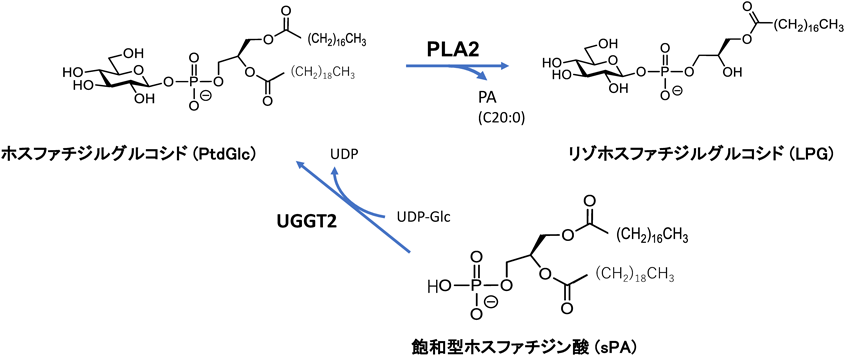
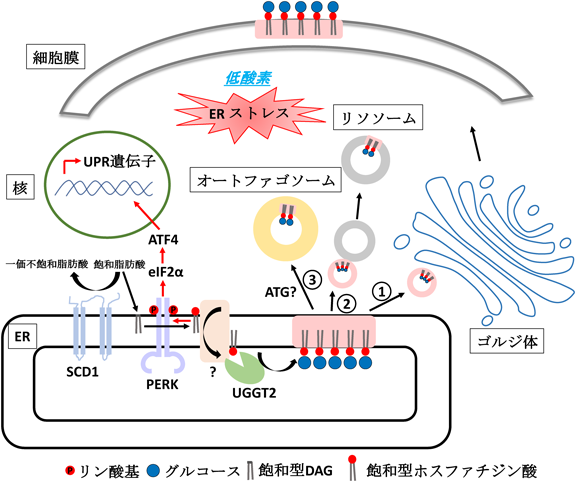
脂質誘導型小胞体ストレスと細胞応答機構—小胞体型糖脂質産生の意義Lipid-induced ER stress and cellular response—Significance of ER-type glycolipid generation
1 理化学研究所脳神経科学研究センターRIKEN Center for Brain Science ◇ 〒351–0198 埼玉県和光市広沢2–1 ◇ Wako, Saitama 351–0198, Japan
2 理化学研究所・開拓研究本部RIKEN Cluster for Pioneering Research ◇ 〒351–0198 埼玉県和光市広沢2–1 ◇ Wako, Saitama 351–0198, Japan
3 順天堂大学環境医学研究所Institute for Environmental and Gender-Specific Medicine, Juntendo University Graduate School of Medicine ◇ 〒279–0021 千葉県浦安市富岡2–1–1 ◇ Urayasu, Chiba 279–0021, Japan