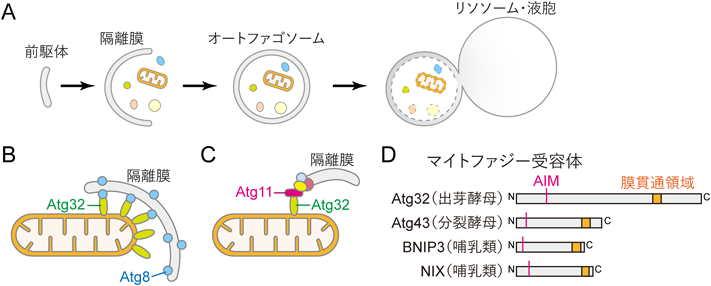
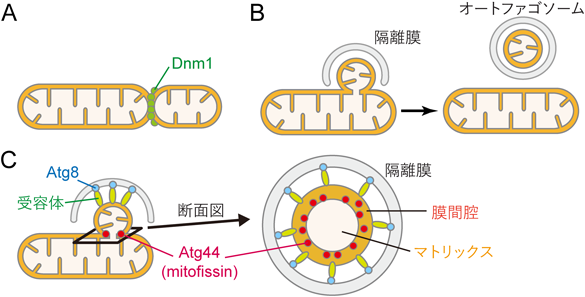
マイトファジーによるミトコンドリア分解の機構Identification and characterization of mitophagy proteins promoting mitochondrial degradation
1 新潟大学大学院医歯学総合研究科Niigata University Graduate School of Medical and Dental Sciences ◇ 〒951–8510 新潟市中央区旭町通1–757 ◇ 1–757 Asahimachi-dori, Chuo-ku, Niigata 951–8510, Japan
2 九州大学大学院医学研究院Graduate School of Medical Sciences, Kyushu University ◇ 〒812–8582 福岡市東区馬出3–1–1 ◇ 3–1–1 Maidashi, Higashi-ku, Fukuoka 812–8582, Japan