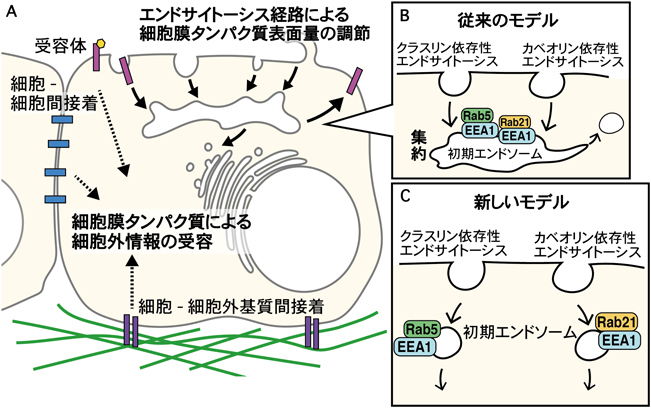
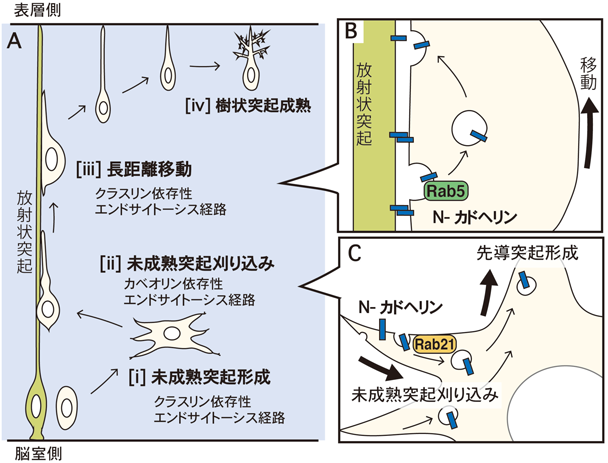
エンドサイトーシス経路の使い分けと生理機能Regulatory mechanisms and physiological function of endocytic pathways
京都大学大学院医学研究科生体環境応答学講座Department of Adaptive and Maladaptive Responses in Health and Disease, Graduate School of Medicine, Kyoto University ◇ 〒606–8507 京都市左京区聖護院川原町53 メディカルイノベーションセンター3階 ◇ Medical Innovation Center 3F, 53 Kawahara-cho, Shogoin, Sakyo-ku, Kyoto 606–8507, Japan