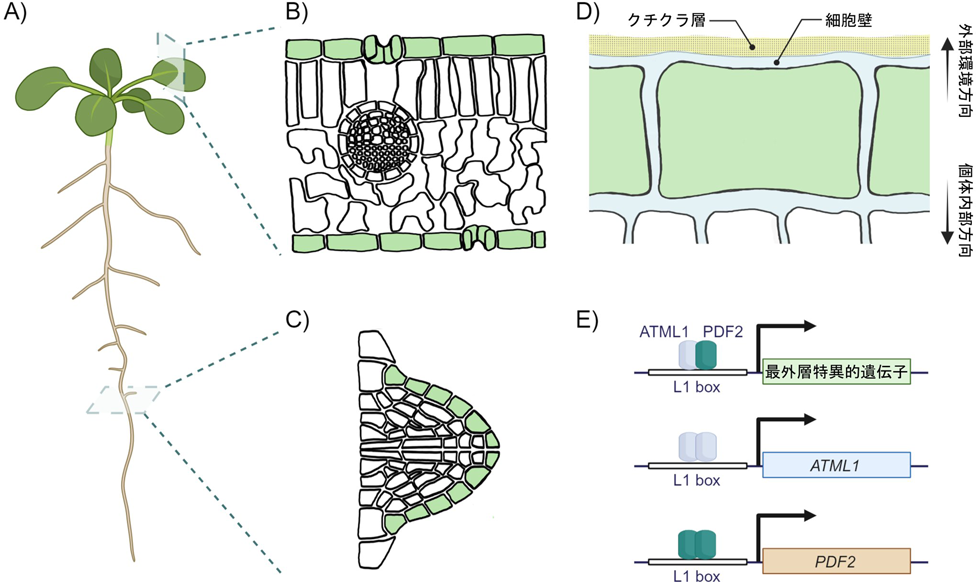
動物の皮膚と同様に,植物の表皮は生物個体の表層を覆うように形成される組織である(図1A~D).皮膚や表皮の獲得は,陸上環境の多様なストレスからの個体内部の保護を可能にし,動物と植物の陸上進出における重要な進化的原動力となった.しかし,両者の解剖学的・発生学的特徴は大きく異なる.第一に,動物の皮膚は表面から表皮,真皮,皮下組織が積み重なった層構造を形成し,最も外側に位置する表皮もまた,複数の細胞層からなる多層性の組織である.一方,植物の表皮は植物体の最外層のみに形成される単層性の組織である(まれに複数の細胞層からなる多層表皮を形成する例も知られている).第二に,動物の皮膚最外層に位置する角質層が死細胞から構成されるのに対して,植物の表皮はすべて生細胞によって構成されている.第三に,動物では増殖と脱離を通じて皮膚が常に新生されるが,植物では初めに形成された表皮と同じアイデンティティーを持つ組織は新生されない.本稿では,動物の皮膚とは異なるユニークな特徴を持つ植物の表皮発生機構に焦点を当てる.特に,植物の表皮が植物体の最外層に正しく分化する分子機構について,我々の最近の研究成果を基に概説する.
2. 表皮の発生を制御するHD-ZIP IV転写因子ATML1, PDF2の多層的制御
植物の表皮発生においては,クラスIVホメオドメイン-ロイシンジッパー(class IV homeodomain-leucine zipper:HD-ZIP IV)転写因子群が中心的な役割を担う1).HD-ZIP IV転写因子群は,ホメオドメインにロイシンジッパーモチーフが隣接する構造を持ち,植物固有のHD-ZIP転写因子群のサブファミリーの一つとして知られている.HD-ZIP IV転写因子群の中でもARABIDOPSIS THALIANA MERISTEM LAYER1(ATML1)とPROTODERMAL FACTOR2(PDF2)は,シロイヌナズナの表皮分化において特に重要な役割を果たす表皮分化のマスター制御因子である2, 3).植物の生活環を通じて最外層特異的な発現様式を示すATML1, PDF2は,ホメオドメインによるシス配列(L1 box)への特異的な結合を介して,標的遺伝子の転写を最外層特異的に制御する(図1E)2, 3).ATML1, PDF2の機能喪失が生じた機能喪失型atml1;pdf2二重変異体は胚発生致死の表現型を示す4)一方,機能が低下した機能低下型atml1;pdf2二重変異体では,表皮が適切に分化せず,葉肉組織が露出した葉が観察される3).以上のことは,ATML1, PDF2によるL1 boxを介した最外層特異的な転写制御が,植物の発生,とりわけ表皮形成においてきわめて重要であることを示している.
興味深いことに,ATML1, PDF2両遺伝子の転写制御領域には,両者の標的遺伝子群と同様にL1 boxが存在する(図1E)3).ATML1転写制御領域の詳細な解析から,ATML1転写制御領域のうちL1 boxを含むごく短い領域が最外層特異的な転写に十分な活性を持つことが示されている5).また,機能低下型atml1;pdf2二重変異体では,ATML1, PDF2の転写活性が野生型や各単独変異体と比較して顕著に減少する4).さらに,ATML1, PDF2の転写制御領域を別の表皮特異的遺伝子の転写制御領域(L1 boxを含む)にスワップしたキメラ型ATML1, PDF2の発現は,依然として最外層特異性を示し,かつ機能喪失型atml1;pdf2二重変異体の表現型を回復する6).すなわち,ATML1, PDF2転写制御領域が持つ最外層特異的な転写活性は,L1 boxを介した自らの翻訳産物によるポジティブフィードバック機構(オートレギュレーション)によって達成されると考えられる.では,このようなシンプルな遺伝子発現制御機構によって,ATML1, PDF2が示す最外層特異的な発現様式は達成可能なのだろうか?
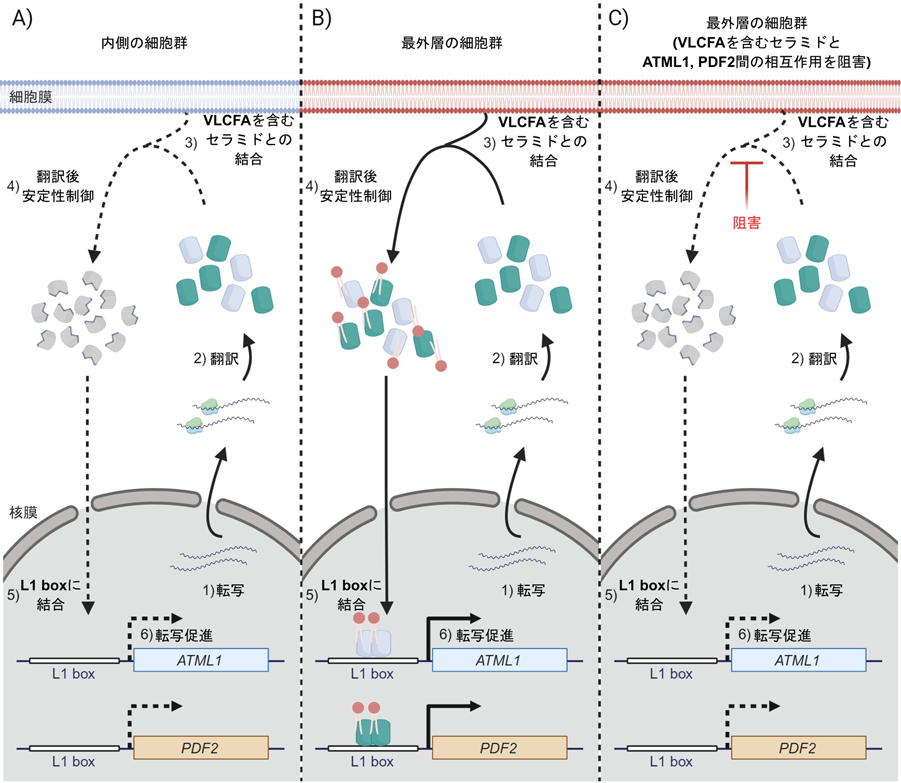
ATML1, PDF2自体が最外層特異的な転写活性を示すため,その最外層特異的な発現様式は一見転写レベルで規定されるように思われる.そのため,ATML1, PDF2の発現制御機構を考える上で翻訳産物であるATML1タンパク質,PDF2タンパク質の動態はほとんど検討されてこなかった.しかし,オートレギュレーションによる発現制御機構ではATML1, PDF2のタンパク質動態は,ATML1, PDF2の転写活性と直接連関する.そこで我々は,ATML1, PDF2が位置依存的な翻訳後制御を受ける可能性を検証した.その結果,ATML1タンパク質,PDF2タンパク質が細胞位置によって異なる安定性を示し,最外層の細胞群のみで安定に存在できることを新たに見いだした(図2A, B)7, 8).すなわち,ATML1, PDF2の発現を制御するオートレギュレーションは,ATML1タンパク質,PDF2タンパク質が安定に存在できる最外層の細胞群のみで維持され,非最外層細胞ではATML1, PDF2の不安定化によってオートレギュレーションが機能しないと考えられる.そこで,ATML1, PDF2の安定性が細胞位置依存的に制御される分子機構のより詳細な理解を試みた.
3. 最外層特異的な脂質によるATML1, PDF2の翻訳後制御
ATML1, PDF2が属するHD-ZIP IV転写因子群の特徴として,steroidogenic acute regulatory protein-related lipid transfer(START)ドメインを有することがあげられる1).STARTドメインは動物・植物を含む真核生物に広く保存された脂質結合ドメインである.植物のSTARTドメインは,植物特異的な転写因子群であるHD-ZIP転写因子群に主に含まれることから,他の真核生物とは異なる独自の役割を果たしていると考えられる9).なかでもHD-ZIP IV転写因子は,陸上植物の祖先に最も近いグループである車軸藻植物と陸上植物の共通祖先で獲得されたとされている10).そのため,植物は陸上化にあたり脂質結合型転写因子群を利用したユニークな表皮分化機構を構築してきた可能性が考えられる.
我々はATML1のSTARTドメインに結合するリガンド脂質候補として,炭素鎖数が20以上の極長鎖脂肪酸(very-long-chain fatty acid:VLCFA)を含むセラミド(スフィンゴ脂質の一種)を同定した7).その後,PDF2のSTARTドメインについても,同様にVLCFAを含むセラミドが結合することが報告されている11).VLCFAの生合成酵素をコードする遺伝子群の多くは,転写制御領域にL1 boxを持ち,ATML1, PDF2のノックダウンによりその転写量が減少する12).そこで,VLCFA生合成の律速段階を触媒する鍵酵素であるPAS2に着目して発現パターンを詳細に調べたところ,ATML1, PDF2同様にPAS2の発現も最外層特異性を示すことが明らかになった7).さらに,機能低下型atml1;pdf2二重変異体におけるVLCFAを含むセラミドの単位重量あたり含量を測定したところ,野生型と比較して顕著な減少が観察された7).すなわち,ATML1タンパク質,PDF2タンパク質のリガンド脂質候補として同定されたVLCFAを含むセラミドは,ATML1, PDF2を介した生合成制御によって最外層特異的に生合成される脂質であるといえる.
VLCFAを含むセラミドとATML1, PDF2の最外層特異的な安定性制御の関係について,我々はさらなる解析を進めた.まず,ATML1, PDF2のSTARTドメイン内の推定リガンド結合部位に1アミノ酸置換を導入した変異型ATML1タンパク質,PDF2タンパク質を作出した.実際に,変異型ATML1ではVLCFAを含むセラミドへの結合能が大きく損なわれる7).変異型ATML1タンパク質,PDF2タンパク質の動態観察の結果,最外層細胞特異的なタンパク質安定性が野生型に比べて大きく低下していることが明らかになった(図2C)7, 8).さらに,VLCFA生合成阻害剤投与下でのATML1タンパク質,PDF2タンパク質の動態解析も併せて行ったところ,VLCFA生合成阻害剤投与下においては,最外層の細胞群におけるATML1, PDF2の安定性が顕著に低下することが判明した(図2C)7, 8).
以上の結果から,VLCFAを含むセラミドは最外層特異的に存在し,ATML1タンパク質,PDF2タンパク質の安定性を位置依存的に制御することが示唆される.これにより,ATML1, PDF2の発現を制御するオートレギュレーションが最外層の細胞群でのみ維持され,植物体の最外層における表皮分化が達成されると考えられる.実際,VLCFAを含むセラミドの生合成阻害剤投与下で生育した植物体では,ATML1, PDF2のmRNA量が顕著に低下する(図2C)7).また,VLCFAを含むセラミドとの結合能が低下した変異型ATML1の転写因子活性は,野生型のATML1と比べて大きく低下する13).これらの結果は,VLCFAを含むセラミドがATML1, PDF2のオートレギュレーションによる発現制御に重要であることを支持している.
前節では,ATML1, PDF2の働きでVLCFAを含むセラミドが最外層特異的に産生される一方で,VLCFAを含むセラミドの働きでATML1タンパク質,PDF2タンパク質の安定性が最外層に限定され,その結果ATML1, PDF2の発現の最外層特異性が生じることを述べた.しかし詰まるところ,「最外層という位置の情報を実際に規定するのはATML1, PDF2とVLCFAを含むセラミドのどちらなのか?」という疑問は依然として残る.
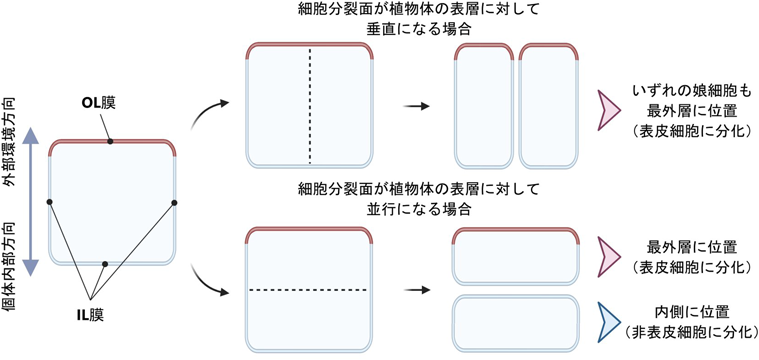
この疑問に対する答えはいまだ完全には得られていないが,我々は表皮細胞が持つ特殊な細胞膜環境に着目し,以下のような表皮分化に関する分子モデルを考えている.表皮細胞膜は高度に極性化しており,二つの特徴的な膜区画に分けられる(図3)7).一つが外部環境と接する区画に形成されるouter lateral(OL)膜であり,もう一つが植物体内部に面するinner lateral(IL)膜である.我々はこのうち,VLCFAを含むセラミドの生合成阻害剤の投与に対してOL膜の形成のみが感受性を示すことを見いだした7).すなわち,正常なOL膜の形成においてVLCFAを含むセラミドの生合成が重要であることが示唆される.VLCFAを含むセラミド(やその派生脂質)が表皮細胞膜の二つの膜区画のうちOL膜に偏在すると考えられることから,我々は
- 1)OL膜とIL膜は,細胞分裂過程で,極性を保持したまま親細胞から娘細胞に継承される.
- 2)OL膜は内側に生じた娘細胞には継承されず,最外層に生じた娘細胞にのみ継承される.
- 3)その結果,OL膜に偏在するVLCFAを含むセラミド(やその派生脂質)は最外層の細胞群にのみ継承され,ATML1, PDF2との相互作用を介してATML1, PDF2の発現を最外層に限定する.
と考えている(図3).
現在のところ,最外層という位置情報を規定するシグナル伝達因子の実体はVLCFAを含むセラミドであると我々は考えているが,依然として「卵(転写因子)が先か? 鶏(脂質)が先か?」というジレンマを解決するには至っていない.これまでに,植物の発生プロセスの比較的初期(胚発生や器官新生の初期段階)の未分化な表皮細胞群においても,細胞膜は高度に極性化・区画化されていることが報告されている14, 15).より包括的な理解を得るためには,今後,植物の発生プロセスのきわめて初期,すなわち配偶子(精子・卵)や受精卵,新生器官の創始細胞などを解析の出発点とし,極性化した細胞膜区画がどのような分子機構で確立されていくのかを,ATML1, PDF2の発現動態と併せて明らかにする必要があるだろう.