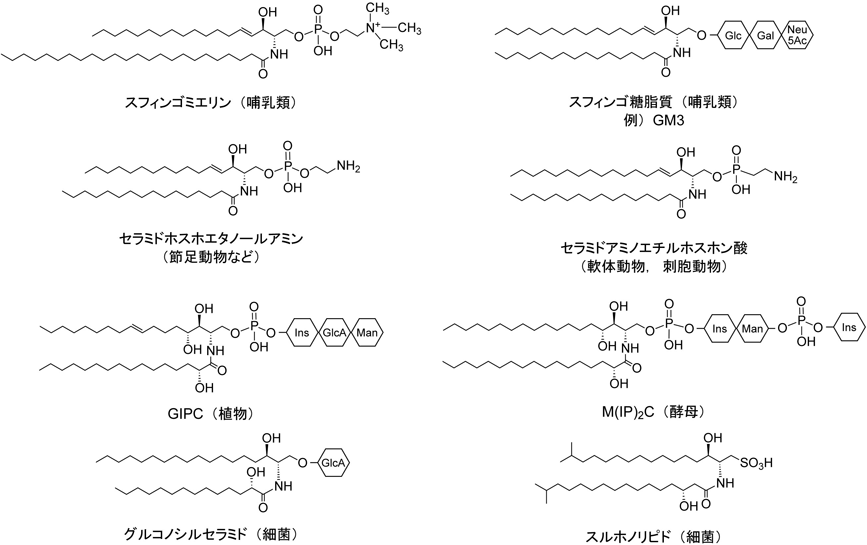
スフィンゴ脂質は長鎖アミノアルコールであるスフィンゴイド塩基を有する脂質の総称であり,セラミドはスフィンゴイド塩基と脂肪酸がアミド結合した構造を持つ.本特集ではスフィンゴイド塩基の代わりに長鎖塩基と記載されている場合もある.長鎖塩基とは本来長鎖脂肪族基を持つ塩基のことを広く表す用語であるが,一般的にスフィンゴイド塩基と同義で扱われることが多い.セラミドの大部分はそのままの状態ではなく,極性基が付加した複合スフィンゴ脂質の疎水骨格として生体に存在する.スフィンゴ脂質はグリセロリン脂質,ステロールとともに真核生物の生体膜を形成し,その割合は生物種や組織によって異なるがおおむねグリセロリン脂質が7–8割,スフィンゴ脂質とステロールが1–2割である.グリセロリン脂質の疎水骨格であるジアシルグリセロールとセラミドはともに二つの疎水鎖を持ち,似たような極性を示すが,ジアシルグリセロールの酸エステル結合が弱アルカリによって加水分解されるのに対し,セラミドのアミド結合はアルカリ耐性である.このようにセラミドの方がより頑強である.
生体膜の主要な成分であるグリセロリン脂質は,多くが不飽和脂肪酸を含有することで生体膜の流動性を保っている.一方,量的に少ないスフィンゴ脂質とステロールは脂質ラフトと呼ばれる膜脂質微小ドメインを形成する.脂質ラフトは強い脂質–脂質間相互作用によって形成されており,流動性が低く(秩序液体相からなる),頑強な領域といえる.脂質ラフト形成のための構造的特徴として,セラミドは水素結合のドナー/アクセプターを持ち,脂肪酸部分は長くて飽和が多い.膜に頑強さを付与するというこのセラミドの特徴が最大限発揮されているのが表皮角質層である.角質層でセラミドはコレステロール,遊離脂肪酸とともにきわめて流動性の低い(ゲル相からなる)脂質構造体(脂質ラメラ)を形成し,強力な透過性バリアをなす(大野の稿を参照).
スフィンゴ脂質は真核生物と一部の細菌に存在する.スフィンゴ脂質を持たない原核生物がいることは,単に膜を形成するだけであればグリセロリン脂質だけで十分であることを表している.スフィンゴ脂質は進化の過程で膜に機能性,あるいはそれぞれの生物が自身の環境下で生存するための最適な特性を付与するために生み出されたと推測される.そのため,スフィンゴ脂質には生物種によってさまざまな多様性がみられる.その多様性は複合スフィンゴ脂質の極性基とセラミド部分の両方にみられる.本特集では哺乳類(木原,稲森ら,大野らの稿),植物(石川の稿),原虫(見市の稿),真菌(谷の稿),細菌(生城らの稿)および食事成分(菅原の稿)におけるセラミド/スフィンゴ脂質の多様性を紹介し,それぞれの生物種でのそれらの産生機構や役割などを概説している.また,木原の稿ではセラミドの分解経路,花田の稿ではセラミドの細胞内輸送,菅原の稿では食事に含まれるセラミド/スフィンゴ脂質の取り込みなどの栄養学な側面について,それぞれ記載している.さらに,セラミドの機能面として,哺乳類における皮膚バリア機能(大野らの稿),細胞死誘導を含む生理活性(谷口,小木曽らの稿),細胞外小胞形成(湯山の稿),自然免疫(稲森らの稿)を,病態面としてセラミド合成/分解関連遺伝子の変異による遺伝性疾患(木原の稿),皮膚疾患(大野らの稿),がんおよび生活習慣病(谷口の稿),アルツハイマー病(湯山の稿),クラジミア感染症(花田の稿),赤痢アメーバ感染症(見市の稿)を記載している.
複合スフィンゴ脂質はリン酸とアルコールからなるスフィンゴリン脂質と糖/糖鎖からなるスフィンゴ糖脂質に分類される.ただし,酵母や植物にみられるホスホイノシトール含有スフィンゴ脂質(後述)はスフィンゴリン脂質に分類されることが多いが,糖を持つものもあり,厳密にはそれらはスフィンゴ糖脂質にも分類されるべきであろう.哺乳類のスフィンゴリン脂質のほとんどはホスホコリン(コリンリン酸)を持つスフィンゴミエリンである(図1).ただし,ホスホエタノールアミンを持つセラミドホスホエタノールアミンも微量存在する.哺乳類のスフィンゴ糖脂質には1から,多いもので10を超える糖が連なっており,その多様性は数百を超える(稲森らの稿を参照).ただし,量的にはすべてのスフィンゴ糖脂質を合わせても,スフィンゴミエリンと同程度かむしろ少ない.なお,節足動物ではセラミドホスホエタノールアミンが,軟体動物や刺胞動物ではセラミドホスホエタノールアミンのリン酸基と炭素間の酸素原子を一つ欠いたセラミドアミノエチルホスホン酸がそれぞれ主要なスフィンゴリン脂質である(菅原の稿を参照)(図1).酵母などの真菌類や植物にはホスホイノシトールを持つセラミドホスホイノシトール(イノシトールホスホセラミド)を基本骨格とする複合スフィンゴ脂質が存在する.植物にはその基本骨格にD-グルクロン酸,D-マンノースなどの糖鎖が付加したグリコシルイノシトールホスホセラミド(glycosylinositol phosphoceramide:GIPC)が存在し(石川の稿を参照),出芽酵母では基本骨格にマンノースともう一つのホスホイノシトールが付加したマンノシルジイノシトールホスホセラミド(mannosyl diinositol phosphoceramide:M(IP)2C)が主要である(谷の稿を参照).植物にはセラミドにD-グルコースが付加したグルコシルセラミドも存在する.一部の細菌にはスフィンゴ脂質が存在する(生城らの稿を参照).それらのスフィンゴ脂質には,上記のセラミドホスホエタノールアミン,セラミドホスホイノシトール,セラミドアミノエチルホスホン酸以外にもセラミドホスホグリセロールや,D-グルクロン酸,D-ガラクツロン酸などを持つものが存在する.さらに,スフィンゴイド塩基部分にスルホン酸基を持つスルホノリピドも存在する(図1).このように細菌のスフィンゴ脂質は属間で大きく異なる.
セラミド部分,特にスフィンゴイド塩基部分には生物種による違いがみられる.スフィンゴイド塩基の多くは共通してC-1位とC-3位に水酸基,C-2位にアミノ基を持つ.哺乳類に最も多いスフィンゴイド塩基部分はC-4位とC-5位間にトランス二重結合を持つスフィンゴシンであり,J. L. W. Thudichumがスフィンゴイド塩基として脳で初めて見いだし,その著書『The chemical constitution of the brain』の中で,“…, while a body remains insoluble, which is of an alkaloidal nature, and to which, in commemoration of the many enigmas which it presented to the inquirer, I have given the name of Sphingosin.”すなわち「アルカロイドの性質を持つ不溶性の物質が謎めいていたことからスフィンゴシンと名づけた」と記載した1).ただし,スフィンゴシンは現在のsphingosineのスペルからみると最後の“e”が抜けている(詳細はセラミド研究会の記事『スフィンゴ脂質およびセラミドの命名事始め』を参照;https://www.ceramide.gr.jp/academic/37/).ちなみにスフィンゴ脂質(sphingolipids)という用語は1947年にH. E. Carterが使用したのが最初のようである(ただし,そのときのスペルはsphingolipides)2).
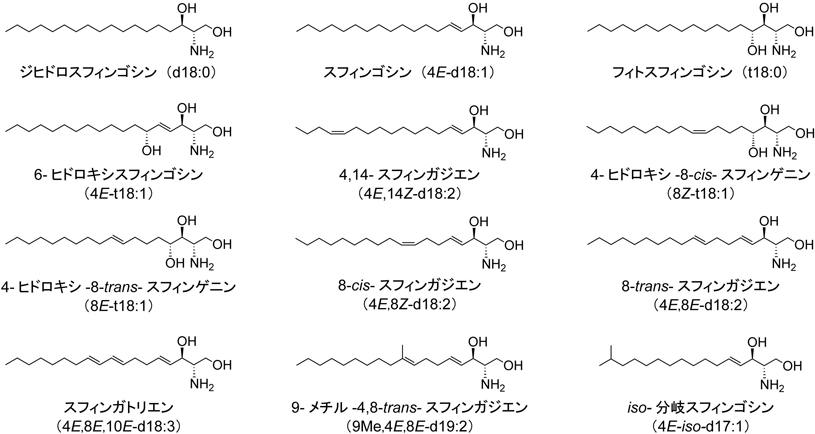
セラミドという用語は広義と狭義があり,広義ではスフィンゴイド塩基と脂肪酸のアミド結合体を指すが,狭義ではスフィンゴイド塩基部分がスフィンゴシンのもの(N-アシルスフィンゴシン)のみを指す.de novoのスフィンゴ脂質合成経路では,L-セリンとアシルCoA(多くの生物では主にパルミトイルCoA)から3-ケトジヒドロスフィンゴシンの産生,還元反応によるジヒドロスフィンゴシンの産生,アシルCoAとの反応によるジヒドロセラミド(N-アシルジヒドロスフィンゴシン)の産生と続く(哺乳類におけるセラミド産生経路については木原の稿を参照).ジヒドロセラミドも広義ではセラミドである.ジヒドロセラミドは幅広い哺乳類組織に存在するが,量はスフィンゴシン型のセラミド(狭義のセラミド)の数分の1から数十分の1である.ジヒドロセラミドの多くは産生後,速やかにスフィンゴシン型のセラミドに変換(C-4位が不飽和化)される.スフィンゴシン型セラミドの一部はさらにスフィンゴシン部分のC-14位が不飽和(シス)化されて4,14-スフィンガジエン(スフィンガジエニン),あるいはC-6位が水酸化されて6-ヒドロキシ(水酸化)スフィンゴシンとなる場合もある.4,14-スフィンガジエン型セラミドはスフィンゴシン型セラミドよりは少ないが,広範な組織に存在し,腎臓には比較的多く存在する.6-ヒドロキシスフィンゴシン型セラミドは表皮特異的に存在する.小腸や表皮などの上皮系の組織ではジヒドロセラミドの一部がC-4位で水酸基され,フィトセラミド(N-アシルフィトスフィンゴシン;フィトスフィンゴシン含有セラミド)になる.このようにヒトの主要なスフィンゴイド塩基はスフィンゴシン,ジヒドロスフィンゴシン,4,14-スフィンガジエン,6-ヒドロキシスフィンゴシン,フィトスフィンゴシンの5種類である(図2).
植物のスフィンゴイド塩基はC-4位に水酸基あるいはトランス二重結合,C-8位にシスあるいはトランス二重結合を持つものが多い(4-ヒドロキシ-8-cis-スフィンゲニン,4-ヒドロキシ-8-trans-スフィンゲニン,8-cis-スフィンガジエン,8-trans-スフィンガジエン;図2).また,植物にはトリエン型スフィンゴイド塩基の存在も確認されている(スフィンガトリエン).スフィンガトリエンはヒトデなど海産無脊椎動物にもみられる(図2)3).出芽酵母の主要なスフィンゴイド塩基はフィトスフィンゴシンであるが,キノコや他の真菌類には9-メチル-4,8-スフィンガジエンも存在する(図2)3).スフィンゴイド塩基の炭素鎖長に関してはC18である生物種が多い(哺乳類を含む)が,ショウジョウバエではC14やC16が多かったり,線虫や細菌のスフィンゴイド塩基にはω末端側が分岐(iso体あるいはanteiso体)した奇数鎖のものがあったりする(図2)4, 5).また,ヒト表皮角質層には例外的にC16からC26までの幅広い鎖長の直鎖のスフィンゴイド塩基が存在する(大野らの稿を参照).
セラミドの脂肪酸部分にも多様性がある.哺乳類のセラミドの脂肪酸は一般的な組織ではC16:0からC24:0までの飽和脂肪酸とC24:1の一価不飽和非水酸化脂肪酸が多い.一方,特定の組織ではC-2位(α位)が水酸化された2-ヒドロキシ脂肪酸や,表皮にはω位が水酸化されたω-ヒドロキシ脂肪酸が存在する.また,表皮にはアシルセラミドや結合型セラミドという脂肪酸部分がさらに代謝された特殊なセラミドも存在し,皮膚バリア形成に働く(大野らの稿を参照).他の生物種でも脂肪酸部分に特徴があるが,詳細はそれぞれの稿を参照してもらうとしてここでは割愛する.
以上のように,本概要では本特集内容を概説し,多様なセラミドについて簡単に紹介した.セラミド/スフィンゴ脂質とステロールの間には脂質ラフト形成などにおいて密接な関係がある.そのため,一部の稿には各生物におけるステロールの記載もしてあるので,進化の過程でスフィンゴ脂質だけでなく,ステロールがどのように変化していったのかを合わせて注目していただきたい.
《スフィンゴイド塩基の表記》
スフィンゴシン
SPH, Sphと略されることがある.また,表皮においては多様なセラミドの記載のためにスフィンゴシン部分は1文字のSで略される.飽和のジヒドロスフィンゴシンが別名スフィンガニンと呼ばれることに対して,スフィンゴシンのような一価不飽和のスフィンゴイド塩基はスフィンゲニンと呼ばれる.スフィンゲニンには不飽和結合の位置やシスまたはトランスの違いによる複数種が存在するが,C-4位にトランス二重結合を持つもののみをスフィンゴシンと呼ぶ.スフィンゴシンの中には炭素数の異なる複数の分子種が存在する.哺乳類ではC18のスフィンゴシンが多く,炭素数を含めた表記法としてd18:1が一般的に用いられる.dは水酸基の数が二つ(di)であることを示す.18は炭素数,1は二重結合の数を表す.さらに二重結合の場所と種類を特定したい場合は,4E-d18:1などと記載する.Eはトランス,Zはシス二重結合を表す.C18スフィンゴシンのIUPAC名は(2S,3R,4E)-2-aminooctadec-4-ene-1,3-diolである.C-2位のアミノ基,C-3位の水酸基の絶対配置はD-エリトロースと同じであり,立体異性を示したい場合はD-erythro-スフィンゴシンと記載する.LIPID MAPS(https://www.lipidmaps.org)の分類ではスフィンゴイド塩基はSPBと略すことになっており,それぞれのスフィンゴイド塩基はその後に炭素鎖長や二重結合の数,酸素/水酸基の数を記載する6).この記載法ではd18:1スフィンゴシンはSPB 18:1;O2(分子種レベル),SPB 18:1;(OH)2(構造レベル),SPB 18:1(4E);1OH,3OH(構造決定レベル)である.
ジヒドロスフィンゴシン
DHS, dihydro-Sph, DS(表皮での表記法)などと略される.別名,スフィンガニン.C18のジヒドロスフィンゴシンはd18:0と表記し,そのIUPAC名は(2S,3R)-2-aminooctadecane-1,3-diol.D-erythro-ジヒドロスフィンゴシン.LIPID MAPSでの表記はSPB 18:0;O2(分子種レベル),SPB 18:0;(OH)2(構造レベル),SPB 18:0;1OH,3OH(構造決定レベル).
フィトスフィンゴシン
PHS, phyto-Sph, P(表皮での表記法)などと略される.C18のフィトスフィンゴシンはt18:0と表記.tは水酸基の数が三つ(tri)であることを示す.そのIUPAC名は(2S,3S,4R)-2-aminooctadecane-1,3,4-triol.D-ribo-フィトスフィンゴシン.LIPID MAPSでの表記はSPB 18:0;O3(分子種レベル),SPB 18:0;(OH)3(構造レベル),SPB 18:0;1OH,3OH,4OH(構造決定レベル).
《セラミドの表記》
スフィンゴシン型のセラミド
狭義のセラミドのこと.スフィンゴイド塩基としてスフィンゴシン,脂肪酸として非水酸化脂肪酸を持つもの(N-アシルスフィンゴシン).単にセラミドと記載した場合,スフィンゴシン型のセラミドを指すことが多い.d18:1/C24:0と記載した場合は,スフィンゴイド塩基部分に炭素数C18のスフィンゴシン,脂肪酸部分にC24:0の脂肪酸を持つセラミドを表す.LIPID MAPSの分類ではセラミドはCerと略すことになっており,たとえばd18:1/C24:0セラミドはCer 42:1;O2(分子種レベル),Cer 18:1;O2/24:0(構造レベル),Cer 18:1(4E);1OH,3OH/24:0(構造決定レベル)のように記載する.表皮角質層には多様なセラミドクラスが存在するため,それらを区別するため脂肪酸とスフィンゴイド塩基の1文字あるいは2文字の略号の組合わせでセラミドを表記することが多い(大野の稿を参照).狭義のセラミドは非水酸化脂肪酸(N;non-hydroxy fatty acid)とスフィンゴシン(S)の組合わせのNSと表記する.また,皮膚科学・化粧品の分野では以前は順相薄層クロマトグラフィー(thin-layer chromatography:TLC)の移動度が大きい順にセラミドに番号をつけて表記することが多かった.NSセラミドは表皮の主要なセラミドクラスの中で2番目に移動度が大きい(疎水性度が高い)のでセラミド2と呼ばれた7).
なお,本特集では,狭義のセラミドはC18:1-セラミドのようにN-アシル基の炭素鎖長と不飽和の数のみ記載することもある.また,飽和脂肪酸に限っては,たとえばN-パルミトイルスフィンゴシンを意味するC16:0-セラミドをC16-セラミドのように簡略化して記載することもある.
ジヒドロセラミド
スフィンゴイド塩基としてジヒドロスフィンゴシン,脂肪酸として非水酸化脂肪酸を持つもの(N-アシルジヒドロスフィンゴシン).他の表記例;d18:0/C24:0, Cer 42:0;O2(LIPID MAPS分子種レベル),Cer 18:0;O2/24:0(LIPID MAPS構造レベル),Cer 18:0;1OH,3OH/24:0(LIPID MAPS構造決定レベル),NDS(表皮での表記法).ジヒドロセラミドはスフィンゴシン型セラミドと順相TLC上でほぼ同じ移動度を示すために移動度順ではないが,セラミド10と名づけられた(皮膚科学・化粧品分野).出芽酵母には5種類のセラミドが存在し,それらをセラミド-A, B, B′, C, Dと記載する慣例があり,ジヒドロセラミドはセラミド-Aと呼ばれる(谷の稿を参照).
フィトセラミド
スフィンゴイド塩基としてフィトスフィンゴシン,脂肪酸として非水酸化脂肪酸を持つもの(N-アシルフィトスフィンゴシン;広義では2-ヒドロキシ脂肪酸などの水酸化脂肪酸を持つものも含める).他の表記例;t18:0/C24:0, Cer 42:0;O3(LIPID MAPS分子種レベル),Cer 18:0;O3/24:0(LIPID MAPS構造レベル),Cer 18:0;1OH,3OH,4OH/24:0(LIPID MAPS構造決定レベル),NP(表皮での表記法),セラミド3(皮膚科学・化粧品分野),セラミド-B(酵母での表記法).
引用文献References
1) Thudichum, J.L.W. (1884) A Treatise on the Chemical Constitution of the Brain, Bailliére, Tindall, and Cox, London.
2) Carter, H.E., Haines, W.J., Ledyard, W.E., & Norris, W.P. (1947) Biochemistry of the sphingolipides; Preparation of sphingolipides from beef brain and spinal cord. J. Biol. Chem., 169, 77–82.
3) Pruett, S.T., Bushnev, A., Hagedorn, K., Adiga, M., Haynes, C.A., Sullards, M.C., Liotta, D.C., & Merrill, A.H. Jr. (2008) Biodiversity of sphingoid bases (“sphingosines”) and related amino alcohols. J. Lipid Res., 49, 1621–1639.
4) Hannich, J.T., Mellal, D., Feng, S., Zumbuehl, A., & Riezman, H. (2017) Structure and conserved function of iso-branched sphingoid bases from the nematode Caenorhabditis elegans. Chem. Sci. (Camb.), 8, 3676–3686.
5) Guan, X.L., Cestra, G., Shui, G., Kuhrs, A., Schittenhelm, R.B., Hafen, E., van der Goot, F.G., Robinett, C.C., Gatti, M., Gonzalez-Gaitan, M., et al. (2013) Biochemical membrane lipidomics during Drosophila development. Dev. Cell, 24, 98–111.
6) Liebisch, G., Fahy, E., Aoki, J., Dennis, E.A., Durand, T., Ejsing, C.S., Fedorova, M., Feussner, I., Griffiths, W.J., Köfeler, H., et al. (2020) Update on LIPID MAPS classification, nomenclature, and shorthand notation for MS-derived lipid structures. J. Lipid Res., 61, 1539–1555.
7) Uchida, Y. & Holleran, W.M. (2008) Omega-O-acylceramide, a lipid essential for mammalian survival. J. Dermatol. Sci., 51, 77–87.