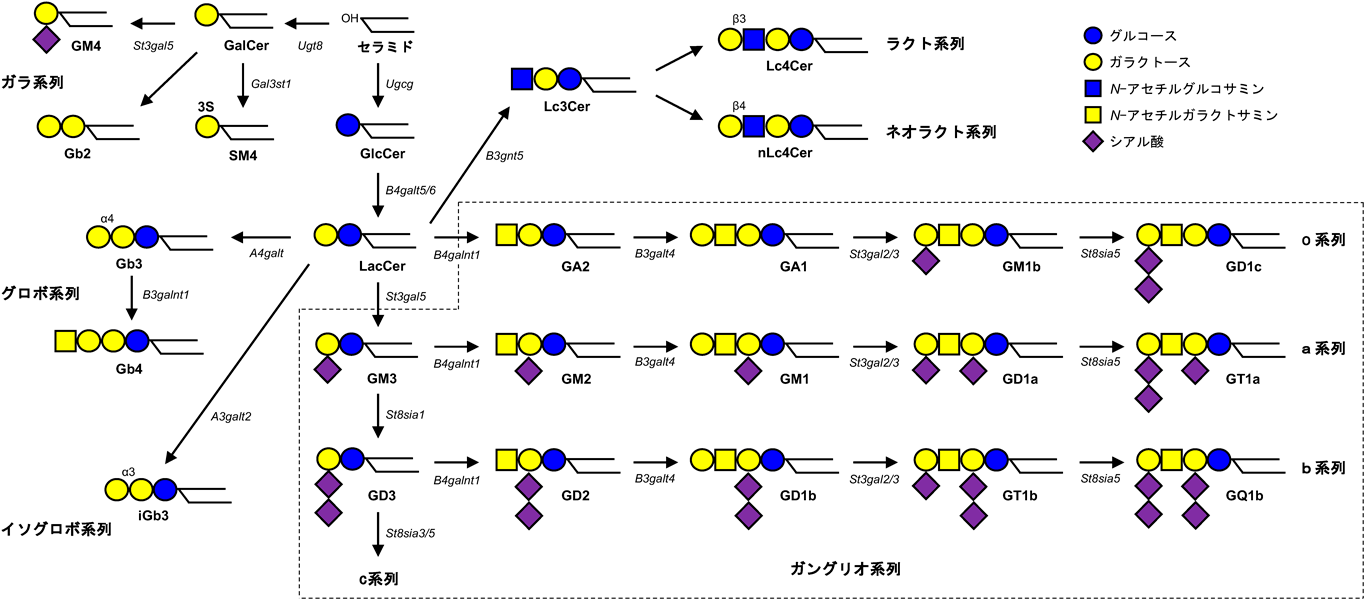
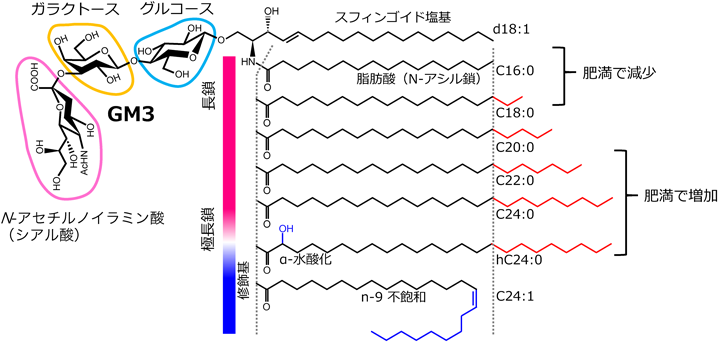
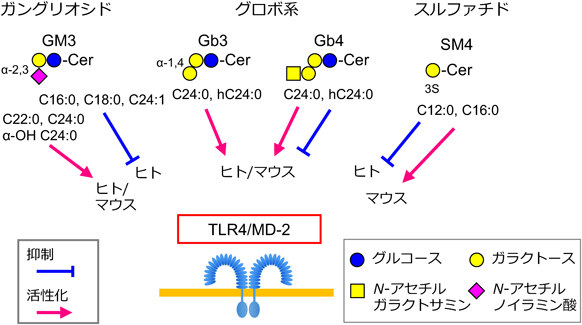
セラミド構造の多様性によるスフィンゴ糖脂質の機能制御Regulation of glycosphingolipid functions by structural diversity of ceramide moiety
1 東北医科薬科大学分子生体膜研究所機能病態分子学教室Division of Glycopathology, Institute of Molecular Biomembrane and Glycobiology, Tohoku Medical and Pharmaceutical University ◇ 〒981–8558 宮城県仙台市青葉区小松島4–4–1 ◇ 4–4–1 Komatsushima, Aoba-ku, Sendai, Miyagi 981–8558, Japan
2 順天堂大学薬学部病態制御学分野Laboratory of Bioregulatory Clinical Pharmacology, Faculty of Pharmacy, Juntendo University ◇ 〒279–0013 千葉県浦安市日の出6–8–1 ◇ 6–8–1 Hinode, Urayasu, Chiba 279–0013, Japan
3 順天堂大学大学院医学研究科環境医学研究所Institute for Environmental and Gender-Specific Medicine, Juntendo University Graduate School of Medicine ◇ 〒279–0021 千葉県浦安市富岡2–1–1 ◇ 2–1–1 Tomioka, Urayasu, Chiba 279–0021, Japan
4 大阪大学大学院理学研究科フォアフロント研究センターForefront Research Center, Graduate School of Science, Osaka University ◇ 〒560–0043 大阪府豊中市待兼山町1–1 ◇ 1–1 Machikaneyama, Toyonaka, Osaka 560–0043, Japan