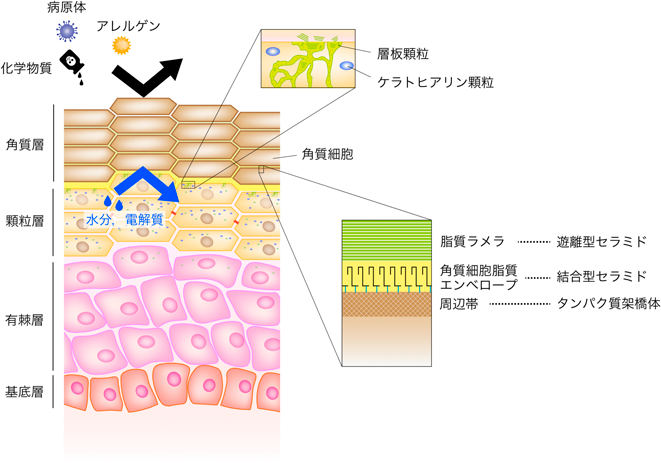
皮膚は皮下組織,真皮,表皮からなり,さらに表皮は内側から基底層,有棘層,顆粒層,角質層によって構成される(図1).このうち,最外層に存在する角質層が皮膚バリア形成において最も重要な役割を果たしている.表皮に存在する細胞の95%はケラチノサイト(角化細胞)であり,各層は分化段階の異なるケラチノサイトによって構成される.基底層を構成する未分化のケラチノサイトが分裂することにより,各層の細胞は押し上げられ,外側へ移動する.この移動に伴ってケラチノサイトの分化が進行し,各層に特徴的な形態および性質を持つようになる.顆粒層にはケラトヒアリン顆粒と呼ばれるプロフィラグリンを含んだ顆粒がみられる.また,顆粒層ではセラミドの産生が活発に行われる.顆粒層のケラチノサイトは空間を満たすのに最適な形状であるケルビンの十四面体様の構造を持ち,顆粒層第二層を構成する細胞どうしがタイトジャンクションによって強固に密着することでその上下間の物質の移行を阻んでいる4).ただし,タイトジャンクションは顆粒層ケラチノサイトが上部(顆粒層第一層)へ移行する過程で分解される.顆粒層ケラチノサイトは角質層に移行して角質細胞になる過程で核やその他の細胞小器官が崩壊し,死細胞となる.角質層はヒトでは十数層からなり,最も外側の層は垢となって剥がれ落ちる.基底層でのケラチノサイトの分裂から垢となって剥がれ落ちるまでの期間はヒトで約28日である.
我々の体の最も外側に位置し,体を防御する働きを持つ角質細胞は他の細胞とは異なるさまざまな特徴を有す.まず,体を覆う細胞が死細胞であることは外界からの刺激に容易に応答して炎症を引き起こすことがないようにするためであろう.また,角質細胞は物理的に非常に強固であるが,その強固さは周辺帯とケラチン繊維によってもたらされている.周辺帯は角質細胞の表面に存在するタンパク質の架橋体であり,インボルクリン,ペリプラキンなどのタンパク質がトランスグルタミナーゼによって架橋されることで形成される5).ケラチンは中間径フィラメントであり,フィラグリンが結合することで凝集する.また,角質層の形質膜は一般的な脂質二重層ではなく,一層の角質細胞脂質エンベロープである6, 7).角質細胞脂質エンベロープは結合型セラミドから構成されており,結合型セラミドは周辺帯のタンパク質に共有結合している(詳細は後述).角質細胞が死細胞になる過程では,リソソームが崩壊し,リソソーム内のプロテアーゼやリパーゼが細胞内のタンパク質や生体膜を分解する.その過程において細胞自体が崩壊しないためには,リソソームプロテアーゼ/リパーゼに耐性となるタンパク質の状態変化(周辺帯でのタンパク質の架橋)および脂質の置換(リン脂質から結合型セラミド)が必要なのであろう.また,角質細胞脂質エンベロープという共有結合型の膜は,物理的・化学的にも,界面活性剤などに対しても安定である.
脂質ラメラはセラミド(遊離型),コレステロール,遊離脂肪酸から主に構成されており,これらがおおよそ等モル比で存在すると考えられている8).脂質ラメラは膜構造体でありながら,高度に“頑強さ”を備えた脂質構造体であり,流動性はほとんどない9).この“頑強さ”を獲得するために,他の組織とは異なった構造と量のセラミドが角質層には存在し,コレステロールと遊離脂肪酸と適度な比率で混ざりあっているのであろう.
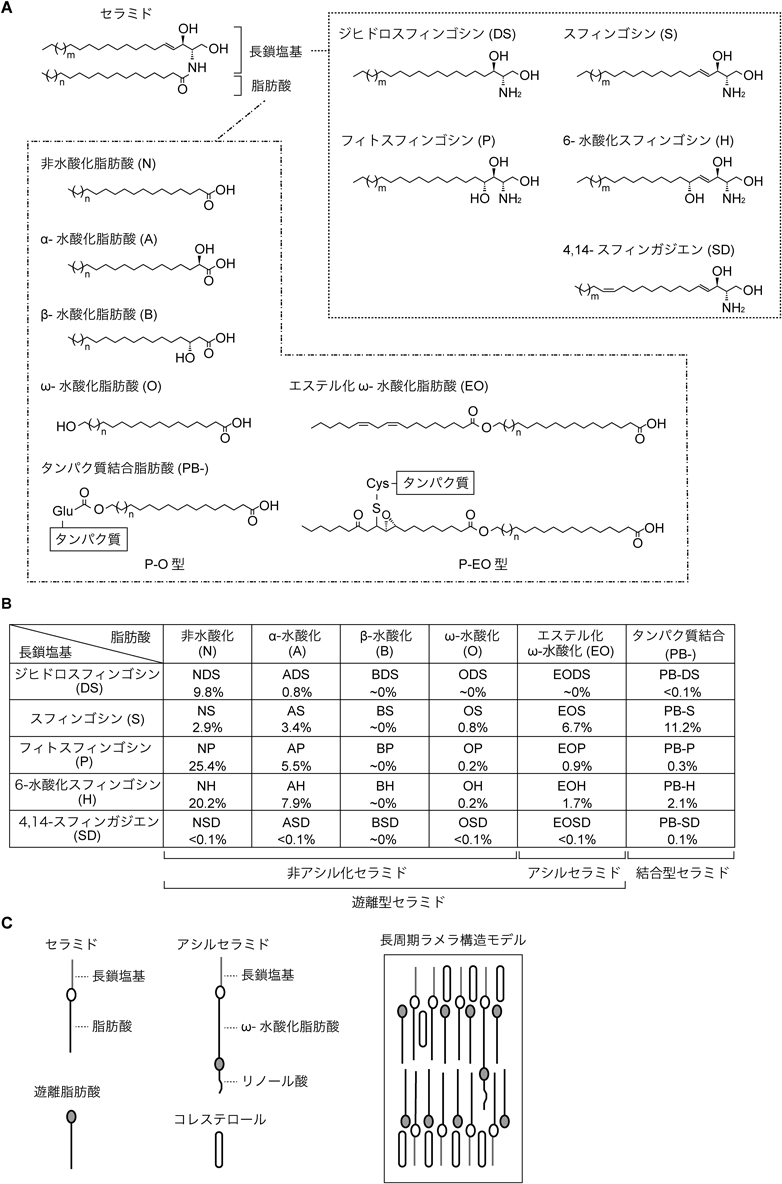
セラミドは長鎖アミノアルコールである長鎖塩基(スフィンゴイド塩基)のアミノ基に脂肪酸が結合した構造を持つ分子の総称である.哺乳類の長鎖塩基としてはジヒドロスフィンゴシン(DS),スフィンゴシン(S),フィトスフィンゴシン(P),6-水酸化スフィンゴシン(H),4,14-スフィンガジエン(SD)の5種類,脂肪酸としては非水酸化脂肪酸(N),α-水酸化脂肪酸(A),β-水酸化脂肪酸(B),ω-水酸化脂肪酸(O)およびエステル化ω-水酸化脂肪酸(EO),タンパク質結合脂肪酸(protein bound-:PB-)の6種類が存在する10–12)(図2A).哺乳類のセラミドはこれらの異なった組合わせからなる30クラスに分類され,それぞれのクラスは脂肪酸と長鎖塩基の略号の組合わせで表記される(図2B).たとえば,ほとんどの組織で主要なセラミドは非水酸化脂肪酸(N)とスフィンゴシン(S)からなり,NSと表記される.
セラミドはタンパク質と共有結合していない遊離型セラミドとPB-タイプ脂肪酸を持つ結合型セラミドに大別される.遊離型セラミドは脂質ラメラの構成成分であり,結合型セラミドは角質細胞脂質エンベロープの成分である.遊離型セラミドはさらにEOタイプ脂肪酸を持つアシルセラミドとそれ以外の脂肪酸を持つ非アシル化セラミドに分類される.各セラミドクラスには炭素鎖長の異なる長鎖塩基,炭素鎖長および二重結合の数が異なる脂肪酸から構成される多くのセラミド分子種が含まれる.
多様なセラミド分子種の存在の解明には,セラミドの定性・定量解析の技術の発展が大きく貢献してきた.特に液体クロマトグラフィー連結タンデム質量分析法(LC-MS/MS)の発展は,長鎖塩基と脂肪酸の水酸基,二重結合の数,炭素鎖長のそれぞれが異なるセラミド分子種を特異的かつ高感度に測定することを可能にした.筆者らは最近,角質層のセラミドを網羅的に解析できるLC-MS/MSシステムを構築し,ヒト角質層に少なくとも23クラス/1581分子種のセラミドが存在していることを明らかにした12)(図2B).この23クラスにはBタイプ脂肪酸含有セラミド(Bタイプセラミド;BDS, BS, BP, BH, BSD)とODS, EODSを除くほとんどのセラミドクラスが含まれていた.角質層セラミドのクラス組成は種によって異なっており,マウスの角質層にはBタイプセラミドが多く,Hタイプセラミドは存在しない11).
炭素鎖長に関しては,多くの組織のセラミドがC18の長鎖塩基とC16–C24の脂肪酸で構成されているのに対し,ヒト角質層のセラミドはC16–C24の長鎖塩基とC16–C36の脂肪酸から構成されている12).このうち,NタイプとAタイプのセラミドの脂肪酸鎖長が主にC16–C28であるのに対し,Oタイプ,EOタイプ(アシルセラミド),PB-タイプ(結合型セラミド)のセラミドの脂肪酸鎖長は主にC30–C36である.これらの脂肪酸のほとんどは飽和脂肪酸であり,例外的にアシルセラミドと結合型セラミドにはC32:1とC34:1の脂肪酸が含まれる.角質層のセラミドが主に飽和脂肪酸で構成されているのは,脂質ラメラ中で脂質が密にパッキングするためであると思われる(不飽和脂肪酸は折れ曲がり構造からパッキングしづらい).
非アシル化セラミドは脂質ラメラの主要成分であり,ヒト角質層セラミド全体の77%を占める.このうち,NPが最も多く,次いでNHであり,この二つのクラスで全体の45%を占める12)(図2B).これらの長鎖塩基部分(フィトスフィンゴシンと6-水酸化スフィンゴシン)は表皮以外の組織に多いスフィンゴシン(Sタイプ)に比べて水酸基を一つ多く持つ.また,脂肪酸部分のα位に水酸基を持つAタイプのセラミド(AHおよびAP)も比較的多く存在する(合わせて13%).このように,ヒト角質層には水酸基を多く持つセラミドが多量に存在するという特徴がある.これは,水素結合を介して脂質–脂質間相互作用を強固にするためであると思われる.あるいはこれらの水酸基は層構造を維持するために,セラミドの極性を高めているのかもしれない.
ヒト角質層に最も多いアシルセラミドはEOSであり,次いでEOH, EOPである12)(図2B).総アシルセラミド量はヒト角質層セラミド全体の約9%と割合は低いが,その特徴的な構造によって脂質ラメラのラメラ構造の形成と維持に重要である.ヒトにおいて最も多い結合型セラミドはPB-Sであり,次いでPB-Hである.アシルセラミド,結合型セラミドともに皮膚バリア機能にきわめて重要であり,それらの合成に関わる遺伝子に変異が入るとヒトでは魚鱗癬を発症し3, 13–20),マウスでは新生致死性の皮膚バリア異常を引き起こす21–30).
アトピー性皮膚炎患者は皮膚バリア異常を示す.その角質層ではセラミドの総量の減少とセラミドクラスの組成変化がみられる31, 32).組成変化としては,患者角質層でNP, AP, NH, AH, EOS, EOHおよびEOPの減少,AS, NSの増加が観察される32, 33).また,類似したセラミドクラスの組成変化は健常人においても皮膚バリア機能と相関してみられる.特にNPに対するNSの比(NP/NS)は経皮水分蒸散量と負に,水分量と正に高い相関性を示すため,透過性バリア機能のよい指標となる34).ただし,どのような分子機構でこのようなセラミドのクラス組成の変化が引き起こされるかはいまだ不明である.
図2Bには記載していないが,上述のセラミドクラス以外にもセラミドの長鎖塩基部分の1位水酸基にアシル鎖が結合した1-O-アシルセラミド(これまで記載してきたω-O-アシルセラミドとは異なることに注意)がヒト,マウスの表皮に存在することが近年明らかにされた35).ただし,1-O-アシルセラミドの皮膚バリアにおける役割は不明である.
X線回折を用いた解析によって,脂質ラメラは側方向に脂質が密にパッキングした六方晶あるいは直方晶(斜方晶)構造を持つことが明らかになっている36).また,縦方向には約13 nmの長周期層が哺乳類に共通してみられ,ヒトにはさらに約6 nmの短周期層もみられる37, 38).脂質ラメラ内での実際の脂質の配向や配置について実験的に明らかにすることは困難であり,いまだ不明であるが,いくつかの構造モデルが提唱されている.その中でも,筆者らが最も妥当と考える分子動力学シミュレーションとクライオ電子顕微鏡を組み合わせて導き出されたモデル39)を下記に紹介する.このモデルはスプレイド二重層モデル(“splayed”とは広がったという意味)と呼ばれるモデル40)を基にし,より実際の脂質ラメラに近い脂質組成(セラミド/コレステロール/遊離脂肪酸/アシルセラミド/脂質ヘッドグループあたりの水分子=33:33:33:5:0.3)を用いることで最適化したものである.このモデルではセラミドの長鎖塩基と脂肪酸は伸展構造をとり(図2C),アシルセラミドのリノール酸部分は対向するセラミドの脂肪酸側に突き出している.遊離脂肪酸はセラミドの脂肪酸鎖にのみ結合するが,コレステロールはやや不均一に分布しており,約25%がセラミドの脂肪酸鎖に,残りが長鎖塩基鎖に結合する.アシルセラミドが二つの層をまたいで存在することはラメラ構造の形成と維持に重要であろう.事実,アシルセラミド合成に関わる遺伝子が欠損したマウスでは脂質ラメラ形成が不全となる21, 27).
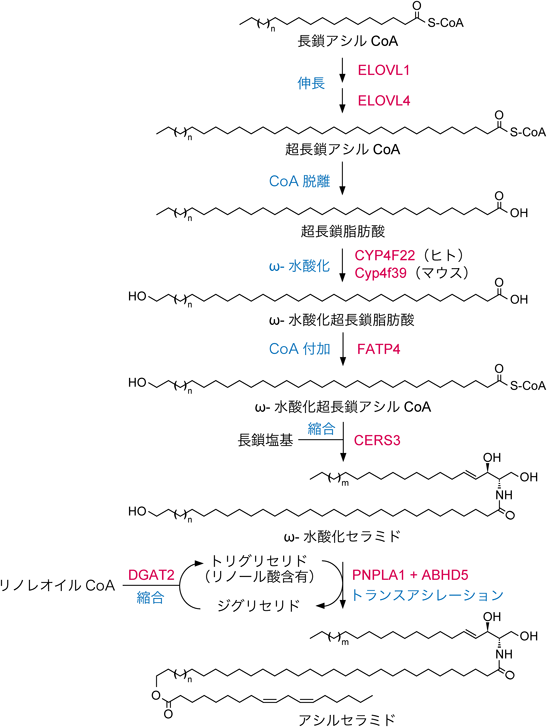
アシルセラミド(EOタイプセラミド)はC30–C36のω-水酸化脂肪酸のω位にリノール酸がエステル結合した構造を持つ.したがって,アシルセラミド産生には非アシル化セラミドの産生経路(木原の稿を参照)に加え,脂肪酸伸長,ω-水酸化,リノール酸のエステル化という反応が必要になる.アシルセラミドの産生に関わる遺伝子,反応の順序や様式を含めたアシルセラミド産生機構は長年不明であったが,筆者らのグループを中心とした研究により,近年その全容が明らかとなった.
脂肪酸は鎖長により,長鎖脂肪酸(long-chain fatty acid, C11–C20),極長鎖脂肪酸(very-long-chain fatty acid, C21以上),超長鎖脂肪酸(ultra-long-chain fatty acid, C26以上)に分類される.アシルセラミドのω-水酸化脂肪酸部分はC30–C36なので,超長鎖である.脂肪酸は活性体であるアシルCoAの状態で小胞体での脂肪酸伸長サイクルによって伸長される.この伸長反応の律速段階を触媒する酵素は脂肪酸伸長酵素(エロンガーゼ)であり,哺乳類に七つのアイソザイム(ELOVL1–7)が存在する41).これらのうち,アシルセラミド産生に必要なC30–C36のアシルCoAの産生にはELOVL1とELOVL4が関与しており,ELOVL1がC26までの伸長を,ELOVL4がそれより長い部分の伸長を担う21, 42, 43)(図3).産生された超長鎖アシルCoAは,CoA部分が脱離されて超長鎖脂肪酸となった後,CYP4F22(マウスではCyp4f39)によってω-水酸化超長鎖脂肪酸へと変換される27, 44).ω-水酸化超長鎖脂肪酸はアシルCoA合成酵素FATP4によって再度CoA付加を受け,ω-水酸化超長鎖アシルCoAとなる22).その後,ω-水酸化超長鎖アシルCoAの超長鎖脂肪酸部位と長鎖塩基はセラミド合成酵素CERS3によって縮合され,ω-水酸化セラミド(Oタイプセラミド)となる.最後にトランスアシラーゼPNPLA1がトリグリセリド中のリノール酸をω-水酸化セラミドに転移することでアシルセラミドが産生される45).PNPLA1によるトリグリセリドの利用は脂肪滴局在タンパク質のABHD5によって促進される46).アシルセラミドの産生は小胞体膜上で行われるが,ABHD5はPNPLA1を小胞体と脂肪滴の境界面にリクルートすることでトランスアシレーション反応を促進しているようである.上述のアシルセラミド産生に関わる酵素をコードする遺伝子の変異はいずれも先天性魚鱗癬を引き起こす.これらのうち,CYP4F22, CERS3, PNPLA1の変異は非症候群性魚鱗癬(魚鱗癬以外の症状を示さない)である常染色体潜性先天性魚鱗癬を,ELOVL1, ELOVL4, FATP4の変異は症候群性の魚鱗癬(魚鱗癬以外の症状も示す)を引き起こす14–18, 20).
顆粒層ケラチノサイトの小胞体で産生されたセラミドの多く(アシルセラミドを含む)は,グルコシル化された後,ABCトランスポーターであるABCA12により層板顆粒内に輸送される47).ただし,NSとASの一部はスフィンゴミエリンへと変換される.層板顆粒は顆粒と名がついているが,顆粒構造は電子顕微鏡観察における化学固定のアーティファクトであるらしく,凍結固定によるクライオ電子顕微鏡観察によってトランスゴルジネットワークから派生したチューブ状のネットワークであることが示されている48).層板顆粒で脂質は初期にはキュービック相の状態にあるが,後期にはラメラ相へと相転移する49).一方,アシルセラミドが産生できないElovl1ノックアウト(KO)マウスあるいはFatp4 KOマウスでは層板顆粒はラメラ相に変換できず,キュービック相のままである21, 27).このことはアシルセラミドがラメラ相の形成・維持に必要であることを示している.上述のようにアシルセラミドはラメラの層間にまたがって存在することでラメラ相を安定化するのであろう.
層板顆粒の先端部が顆粒層と角質層の境界付近で形質膜と融合すると,内容物が細胞外に放出され,脂質ラメラが形成される.層板顆粒に蓄えられたグルコシルセラミドとスフィンゴミエリンはそれぞれβ-グロボセレブロシダーゼとスフィンゴミエリナーゼによる極性基の除去を受けてセラミドになる47).アシルセラミドの一部は結合型セラミドへと変換され(後述),角質細胞脂質エンベロープを形成する7, 50).
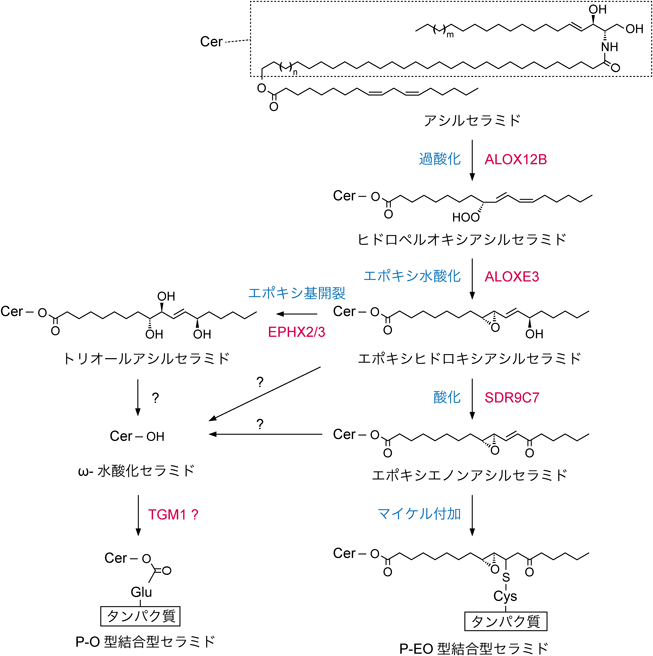
角質細胞脂質エンベロープの構成成分である結合型セラミドの構造にはいまだ不明な点が残されている.現在,その構造モデルとして二つのモデル(P-OモデルとP-EOモデル)が提唱されている30, 51, 52)(図2A).それらの名前はともに脂肪酸部分の構造に由来する.P-O(protein-bound ω-hydroxy)脂肪酸とはタンパク質のグルタミン酸残基とエステル結合をしたω-水酸化脂肪酸を表す.すなわち,P–O型結合型セラミドではω-水酸化セラミド(Oタイプセラミド)がタンパク質と結合している.一方,P-EO(protein-bound modified-linoleic acid esterified ω-hydroxy)脂肪酸とは,タンパク質と結合した修飾リノール酸とエステル結合したω-水酸化脂肪酸を表す.すなわち,P-EO型結合型セラミドではアシルセラミドのリノール酸部位が修飾されてエポキシエノンとなった後にその修飾部分がタンパク質と結合している.一般的な結合型セラミドの測定では,これらの結合型セラミドは区別できない(そのため,図2BではまとめてPB-と表記している).その測定では直接結合型セラミドを検出するのではなく,アルカリ処理(エステル結合の切断)で結合型セラミドからOタイプセラミドを遊離させて検出するからである(P-O型とP-EO型の結合型セラミドからは,ともにこの処理によってOタイプセラミドが遊離する).この測定法が汎用されているのは,タンパク質あるいはペプチドが結合した状態の結合型セラミドを分離・検出するのが難しいという技術的な問題による.
歴史的にはまず,P-O型の結合型セラミドの存在が1998年に報告された51).その報告ではヒト包皮から調製した結合型セラミド画分をプロテイナーゼK処理し,得られたペプチドと結合型セラミドの結合体を質量分析することで構造を予測した.ただし,その解析ではペプチドと結合型セラミドの結合体として6つのピークしか分析されておらず,結合型セラミド全体の15から20%をカバーしたのみであった.それにもかかわらず,P-O型の結合型セラミドが唯一の結合型セラミドであると長い間信じられてきた.
P-EO型の結合型セラミドが提案されたのは2020年である30).この構造は先天性魚鱗癬の原因遺伝子であるSDR9C7の解析の過程で,その遺伝子産物がエポキシエノンアシルセラミド(アシルセラミドから結合型セラミドへの変換経路における中間体)を産生することから推定された(図4).一般的にエノンは反応性が高く,Lys残基やArg残基などのアミノ基とシッフ塩基の形成,およびHis残基,Cys残基,Trp残基などの求核性側鎖とマイケル付加反応によって容易に結合するからである.筆者らは最近,結合型セラミド画分をプロナーゼで処理することによってタンパク質をアミノ酸にまで分解し,アミノ酸と結合型セラミドの結合体を質量分析によって解析する方法を確立した.この方法を用いて,マウス表皮の結合型セラミドを分析したところ,少なくとも6割の結合型セラミドがタンパク質のCys残基とエポキシエノンアシルセラミドがマイケル付加反応によって結合したP-EO型であることを見いだした52).一方,少なくとも筆者らの測定系では従来から提案されてきたP-O型の結合型セラミドは検出されなかった.今後,実際にP-O型の結合型セラミドが存在するのか,残りの4割の結合型セラミドがどのような構造の分子なのかを明らかにする必要がある.
結合型セラミドの産生では,まずアシルセラミドのリノール酸部位が二つのリポキシゲナーゼ(ALOX12BとALOXE3)によって過酸化と引き続くエポキシ水酸化への変換を受け,エポキシヒドロキシ体となる53, 54)(図4).その後,P-EO型の結合型セラミドの産生経路では,上述のようにリノール酸部分がSDR9C7によってエポキシエノンとなった後,エノンがマイケル付加反応で角質細胞の表面タンパク質(周辺帯タンパク質)のCys残基と結合する30, 52).これらの過程に関わる酵素をコードするALOX12B, ALOXE3, SDR9C7遺伝子はいずれも非症候群性魚鱗癬である常染色体潜性先天性魚鱗癬の原因遺伝子である13, 19).
P-O型の結合型セラミドの産生経路では,修飾されたリノール酸(エポキシヒドロキシ体,エポキシエノン体,あるいはエポキシヒドロキシ体がエポキシドヒドロラーゼEPHX2またはEPHX3によってトリオール体に変換された状態)が未同定のエステラーゼによって加水分解を受けた後,産生されたOタイプセラミド(ω-水酸化セラミド)が周辺帯のタンパク質のGln残基と反応してP-O型の結合型セラミドになると予測されている50, 55, 56).この最後の過程ではGln残基からアミノ基が取り除かれる51).最後の反応を触媒する酵素は不明であるが,少なくともin vitroでは周辺帯のタンパク質の架橋に働くトランスグルタミナーゼTGM1が活性を示すことが報告されている57).ただし,in vivoにおいてはTGM1は結合型セラミド形成に関与しないという報告もなされている58).
引用文献References
1) Vahlquist, A., Fischer, J., & Torma, H. (2018) Inherited nonsyndromic ichthyoses: An update on pathophysiology, diagnosis and treatment. Am. J. Clin. Dermatol., 19, 51–66.
2) Goleva, E., Berdyshev, E., & Leung, D.Y. (2019) Epithelial barrier repair and prevention of allergy. J. Clin. Invest., 129, 1463–1474.
3) Akiyama, M. (2021) Acylceramide is a key player in skin barrier function: Insight into the molecular mechanisms of skin barrier formation and ichthyosis pathogenesis. FEBS J., 288, 2119–2130.
4) Yokouchi, M. & Kubo, A. (2018) Maintenance of tight junction barrier integrity in cell turnover and skin diseases. Exp. Dermatol., 27, 876–883.
5) Candi, E., Schmidt, R., & Melino, G. (2005) The cornified envelope: A model of cell death in the skin. Nat. Rev. Mol. Cell Biol., 6, 328–340.
6) Elias, P.M., Gruber, R., Crumrine, D., Menon, G., Williams, M.L., Wakefield, J.S., Holleran, W.M., & Uchida, Y. (2014) Formation and functions of the corneocyte lipid envelope (CLE). Biochim. Biophys. Acta Mol. Cell Biol. Lipids, 1841, 314–318.
7) Muñoz-Garcia, A., Thomas, C.P., Keeney, D.S., Zheng, Y., & Brash, A.R. (2014) The importance of the lipoxygenase-hepoxilin pathway in the mammalian epidermal barrier. Biochim. Biophys. Acta Mol. Cell Biol. Lipids, 1841, 401–408.
8) Yardley, H.J. & Summerly, R. (1981) Lipid composition and metabolism in normal and diseased epidermis. Pharmacol. Ther., 13, 357–383.
9) Norlén, L. (2001) Skin barrier structure and function: The single gel phase model. J. Invest. Dermatol., 117, 830–836.
10) Kihara, A. (2016) Synthesis and degradation pathways, functions, and pathology of ceramides and epidermal acylceramides. Prog. Lipid Res., 63, 50–69.
11) Kawana, M., Miyamoto, M., Ohno, Y., & Kihara, A. (2020) Comparative profiling and comprehensive quantification of stratum corneum ceramides in humans and mice by LC/MS/MS. J. Lipid Res., 61, 884–895.
12) Suzuki, M., Ohno, Y., & Kihara, A. (2022) Whole picture of human stratum corneum ceramides, including the chain-length diversity of long-chain bases. J. Lipid Res., 63, 100235.
13) Jobard, F., Lefevre, C., Karaduman, A., Blanchet-Bardon, C., Emre, S., Weissenbach, J., Ozguc, M., Lathrop, M., Prud’homme, J.F., & Fischer, J. (2002) Lipoxygenase-3 (ALOXE3) and 12(R)-lipoxygenase (ALOX12B) are mutated in non-bullous congenital ichthyosiform erythroderma (NCIE) linked to chromosome 17p13.1. Hum. Mol. Genet., 11, 107–113.
14) Lefèvre, C., Bouadjar, B., Ferrand, V., Tadini, G., Mégarbané, A., Lathrop, M., Prud’homme, J.F., & Fischer, J. (2006) Mutations in a new cytochrome P450 gene in lamellar ichthyosis type 3. Hum. Mol. Genet., 15, 767–776.
15) Klar, J., Schweiger, M., Zimmerman, R., Zechner, R., Li, H., Torma, H., Vahlquist, A., Bouadjar, B., Dahl, N., & Fischer, J. (2009) Mutations in the fatty acid transport protein 4 gene cause the ichthyosis prematurity syndrome. Am. J. Hum. Genet., 85, 248–253.
16) Aldahmesh, M.A., Mohamed, J.Y., Alkuraya, H.S., Verma, I.C., Puri, R.D., Alaiya, A.A., Rizzo, W.B., & Alkuraya, F.S. (2011) Recessive mutations in ELOVL4 cause ichthyosis, intellectual disability, and spastic quadriplegia. Am. J. Hum. Genet., 89, 745–750.
17) Grall, A., Guaguere, E., Planchais, S., Grond, S., Bourrat, E., Hausser, I., Hitte, C., Le Gallo, M., Derbois, C., Kim, G.J., et al. (2012) PNPLA1 mutations cause autosomal recessive congenital ichthyosis in golden retriever dogs and humans. Nat. Genet., 44, 140–147.
18) Eckl, K.M., Tidhar, R., Thiele, H., Oji, V., Hausser, I., Brodesser, S., Preil, M.L., Onal-Akan, A., Stock, F., Muller, D., et al. (2013) Impaired epidermal ceramide synthesis causes autosomal recessive congenital ichthyosis and reveals the importance of ceramide acyl chain length. J. Invest. Dermatol., 133, 2202–2211.
19) Shigehara, Y., Okuda, S., Nemer, G., Chedraoui, A., Hayashi, R., Bitar, F., Nakai, H., Abbas, O., Daou, L., Abe, R., et al. (2016) Mutations in SDR9C7 gene encoding an enzyme for vitamin A metabolism underlie autosomal recessive congenital ichthyosis. Hum. Mol. Genet., 25, 4484–4493.
20) Mueller, N., Sassa, T., Morales-Gonzalez, S., Schneider, J., Salchow, D.J., Seelow, D., Knierim, E., Stenzel, W., Kihara, A., & Schuelke, M. (2019) De novo mutation in ELOVL1 causes ichthyosis, acanthosis nigricans, hypomyelination, spastic paraplegia, high frequency deafness and optic atrophy. J. Med. Genet., 56, 164–175.
21) Sassa, T., Ohno, Y., Suzuki, S., Nomura, T., Nishioka, C., Kashiwagi, T., Hirayama, T., Akiyama, M., Taguchi, R., Shimizu, H., et al. (2013) Impaired epidermal permeability barrier in mice lacking Elovl1, the gene responsible for very-long-chain fatty acid production. Mol. Cell. Biol., 33, 2787–2796.
22) Yamamoto, H., Hattori, M., Chamulitrat, W., Ohno, Y., & Kihara, A. (2020) Skin permeability barrier formation by the ichthyosis-causative gene FATP4 through formation of the barrier lipid ω-O-acylceramide. Proc. Natl. Acad. Sci. USA, 117, 2914–2922.
23) Epp, N., Furstenberger, G., Muller, K., de Juanes, S., Leitges, M., Hausser, I., Thieme, F., Liebisch, G., Schmitz, G., & Krieg, P. (2007) 12R-lipoxygenase deficiency disrupts epidermal barrier function. J. Cell Biol., 177, 173–182.
24) Grond, S., Eichmann, T.O., Dubrac, S., Kolb, D., Schmuth, M., Fischer, J., Crumrine, D., Elias, P.M., Haemmerle, G., Zechner, R., et al. (2017) PNPLA1 deficiency in mice and humans leads to a defect in the synthesis of omega-O-acylceramides. J. Invest. Dermatol., 137, 394–402.
25) Hirabayashi, T., Anjo, T., Kaneko, A., Senoo, Y., Shibata, A., Takama, H., Yokoyama, K., Nishito, Y., Ono, T., Taya, C., et al. (2017) PNPLA1 has a crucial role in skin barrier function by directing acylceramide biosynthesis. Nat. Commun., 8, 14609.
26) Jennemann, R., Rabionet, M., Gorgas, K., Epstein, S., Dalpke, A., Rothermel, U., Bayerle, A., van der Hoeven, F., Imgrund, S., Kirsch, J., et al. (2012) Loss of ceramide synthase 3 causes lethal skin barrier disruption. Hum. Mol. Genet., 21, 586–608.
27) Miyamoto, M., Itoh, N., Sawai, M., Sassa, T., & Kihara, A. (2020) Severe skin permeability barrier dysfunction in knockout mice deficient in a fatty acid ω-hydroxylase crucial to acylceramide production. J. Invest. Dermatol., 140, 319–326.e4.
28) Moran, J.L., Qiu, H., Turbe-Doan, A., Yun, Y., Boeglin, W.E., Brash, A.R., & Beier, D.R. (2007) A mouse mutation in the 12R-lipoxygenase, Alox12b, disrupts formation of the epidermal permeability barrier. J. Invest. Dermatol., 127, 1893–1897.
29) Radner, F.P., Marrakchi, S., Kirchmeier, P., Kim, G.J., Ribierre, F., Kamoun, B., Abid, L., Leipoldt, M., Turki, H., Schempp, W., et al. (2013) Mutations in CERS3 cause autosomal recessive congenital ichthyosis in humans. PLoS Genet., 9, e1003536.
30) Takeichi, T., Hirabayashi, T., Miyasaka, Y., Kawamoto, A., Okuno, Y., Taguchi, S., Tanahashi, K., Murase, C., Takama, H., Tanaka, K., et al. (2020) SDR9C7 catalyzes critical dehydrogenation of acylceramides for skin barrier formation. J. Clin. Invest., 130, 890–903.
31) Imokawa, G., Abe, A., Jin, K., Higaki, Y., Kawashima, M., & Hidano, A. (1991) Decreased level of ceramides in stratum corneum of atopic dermatitis: An etiologic factor in atopic dry skin? J. Invest. Dermatol., 96, 523–526.
32) Ishikawa, J., Narita, H., Kondo, N., Hotta, M., Takagi, Y., Masukawa, Y., Kitahara, T., Takema, Y., Koyano, S., Yamazaki, S., et al. (2010) Changes in the ceramide profile of atopic dermatitis patients. J. Invest. Dermatol., 130, 2511–2514.
33) Kim, D., Lee, N.R., Park, S.Y., Jun, M., Lee, K., Kim, S., Park, C.S., Liu, K.H., & Choi, E.H. (2017) As in atopic dermatitis, nonlesional skin in allergic contact dermatitis displays abnormalities in barrier function and ceramide content. J. Invest. Dermatol., 137, 748–750.
34) Yokose, U., Ishikawa, J., Morokuma, Y., Naoe, A., Inoue, Y., Yasuda, Y., Tsujimura, H., Fujimura, T., Murase, T., & Hatamochi, A. (2020) The ceramide [NP]/[NS] ratio in the stratum corneum is a potential marker for skin properties and epidermal differentiation. BMC Dermatol., 20, 6.
35) Rabionet, M., Bayerle, A., Marsching, C., Jennemann, R., Grone, H.J., Yildiz, Y., Wachten, D., Shaw, W., Shayman, J.A., & Sandhoff, R. (2013) 1-O-acylceramides are natural components of human and mouse epidermis. J. Lipid Res., 54, 3312–3321.
36) van Smeden, J., Janssens, M., Gooris, G.S., & Bouwstra, J.A. (2014) The important role of stratum corneum lipids for the cutaneous barrier function. Biochim. Biophys. Acta Mol. Cell Biol. Lipids, 1841, 295–313.
37) Bouwstra, J.A., Gooris, G.S., Dubbelaar, F.E., & Ponec, M. (2002) Phase behavior of stratum corneum lipid mixtures based on human ceramides: The role of natural and synthetic ceramide 1. J. Invest. Dermatol., 118, 606–617.
38) Bouwstra, J.A., Gooris, G.S., Dubbelaar, F.E., Weerheim, A.M., Ijzerman, A.P., & Ponec, M. (1998) Role of ceramide 1 in the molecular organization of the stratum corneum lipids. J. Lipid Res., 39, 186–196.
39) Lundborg, M., Narangifard, A., Wennberg, C.L., Lindahl, E., Daneholt, B., & Norlen, L. (2018) Human skin barrier structure and function analyzed by cryo-EM and molecular dynamics simulation. J. Struct. Biol., 203, 149–161.
40) Iwai, I., Han, H., den Hollander, L., Svensson, S., Ofverstedt, L.G., Anwar, J., Brewer, J., Bloksgaard, M., Laloeuf, A., Nosek, D., et al. (2012) The human skin barrier is organized as stacked bilayers of fully extended ceramides with cholesterol molecules associated with the ceramide sphingoid moiety. J. Invest. Dermatol., 132, 2215–2225.
41) Kihara, A. (2012) Very long-chain fatty acids: Elongation, physiology and related disorders. J. Biochem., 152, 387–395.
42) Ohno, Y., Suto, S., Yamanaka, M., Mizutani, Y., Mitsutake, S., Igarashi, Y., Sassa, T., & Kihara, A. (2010) ELOVL1 production of C24 acyl-CoAs is linked to C24 sphingolipid synthesis. Proc. Natl. Acad. Sci. USA, 107, 18439–18444.
43) Vasireddy, V., Uchida, Y., Salem, N. Jr., Kim, S.Y., Mandal, M.N., Reddy, G.B., Bodepudi, R., Alderson, N.L., Brown, J.C., Hama, H., et al. (2007) Loss of functional ELOVL4 depletes very long-chain fatty acids (≥C28) and the unique ω-O-acylceramides in skin leading to neonatal death. Hum. Mol. Genet., 16, 471–482.
44) Ohno, Y., Nakamichi, S., Ohkuni, A., Kamiyama, N., Naoe, A., Tsujimura, H., Yokose, U., Sugiura, K., Ishikawa, J., Akiyama, M., et al. (2015) Essential role of the cytochrome P450 CYP4F22 in the production of acylceramide, the key lipid for skin permeability barrier formation. Proc. Natl. Acad. Sci. USA, 112, 7707–7712.
45) Ohno, Y., Kamiyama, N., Nakamichi, S., & Kihara, A. (2017) PNPLA1 is a transacylase essential for the generation of the skin barrier lipid ω-O-acylceramide. Nat. Commun., 8, 14610.
46) Ohno, Y., Nara, A., Nakamichi, S., & Kihara, A. (2018) Molecular mechanism of the ichthyosis pathology of Chanarin–Dorfman syndrome: Stimulation of PNPLA1-catalyzed ω-O-acylceramide production by ABHD5. J. Dermatol. Sci., 92, 245–253.
47) Uchida, Y. & Holleran, W.M. (2008) Omega-O-acylceramide, a lipid essential for mammalian survival. J. Dermatol. Sci., 51, 77–87.
48) Norlén, L., Al-Amoudi, A., & Dubochet, J. (2003) A cryotransmission electron microscopy study of skin barrier formation. J. Invest. Dermatol., 120, 555–560.
49) Narangifard, A., den Hollander, L., Wennberg, C.L., Lundborg, M., Lindahl, E., Iwai, I., Han, H., Masich, S., Daneholt, B., & Norlen, L. (2018) Human skin barrier formation takes place via a cubic to lamellar lipid phase transition as analyzed by cryo-electron microscopy and EM-simulation. Exp. Cell Res., 366, 139–151.
50) Hirabayashi, T., Murakami, M., & Kihara, A. (2019) The role of PNPLA1 in ω-O-acylceramide synthesis and skin barrier function. Biochim. Biophys. Acta Mol. Cell Biol. Lipids, 1864, 869–879.
51) Marekov, L.N. & Steinert, P.M. (1998) Ceramides are bound to structural proteins of the human foreskin epidermal cornified cell envelope. J. Biol. Chem., 273, 17763–17770.
52) Ohno, Y., Nakamura, T., Iwasaki, T., Katsuyama, A., Ichikawa, S., & Kihara, A. (2023) Determining the structure of protein-bound ceramides, essential lipids for skin barrier function. iScience, 26, 108248.
53) Zheng, Y., Yin, H., Boeglin, W.E., Elias, P.M., Crumrine, D., Beier, D.R., & Brash, A.R. (2011) Lipoxygenases mediate the effect of essential fatty acid in skin barrier formation: A proposed role in releasing omega-hydroxyceramide for construction of the corneocyte lipid envelope. J. Biol. Chem., 286, 24046–24056.
54) Krieg, P., Rosenberger, S., de Juanes, S., Latzko, S., Hou, J., Dick, A., Kloz, U., van der Hoeven, F., Hausser, I., Esposito, I., et al. (2013) Aloxe3 knockout mice reveal a function of epidermal lipoxygenase-3 as hepoxilin synthase and its pivotal role in barrier formation. J. Invest. Dermatol., 133, 172–180.
55) Chiba, T., Thomas, C.P., Calcutt, M.W., Boeglin, W.E., O’Donnell, V.B., & Brash, A.R. (2016) The precise structures and stereochemistry of trihydroxy-linoleates esterified in human and porcine epidermis and their significance in skin barrier function: Implication of an epoxide hydrolase in the transformations of linoleate. J. Biol. Chem., 291, 14540–14554.
56) Edin, M.L., Yamanashi, H., Boeglin, W.E., Graves, J.P., DeGraff, L.M., Lih, F.B., Zeldin, D.C., & Brash, A.R. (2021) Epoxide hydrolase 3 (Ephx3) gene disruption reduces ceramide linoleate epoxide hydrolysis and impairs skin barrier function. J. Biol. Chem., 296, 100198.
57) Nemes, Z., Marekov, L.N., Fesus, L., & Steinert, P.M. (1999) A novel function for transglutaminase 1: Attachment of long-chain ω-hydroxyceramides to involucrin by ester bond formation. Proc. Natl. Acad. Sci. USA, 96, 8402–8407.
58) Elias, P.M., Schmuth, M., Uchida, Y., Rice, R.H., Behne, M., Crumrine, D., Feingold, K.R., Holleran, W.M., & Pharm, D. (2002) Basis for the permeability barrier abnormality in lamellar ichthyosis. Exp. Dermatol., 11, 248–256.
59) Sassa, T. & Kihara, A. (2023) Involvement of ω-O-acylceramides and protein-bound ceramides in oral permeability barrier formation. Cell Rep., 42, 112363.
60) Groeger, S. & Meyle, J. (2019) Oral mucosal epithelial cells. Front. Immunol., 10, 208.