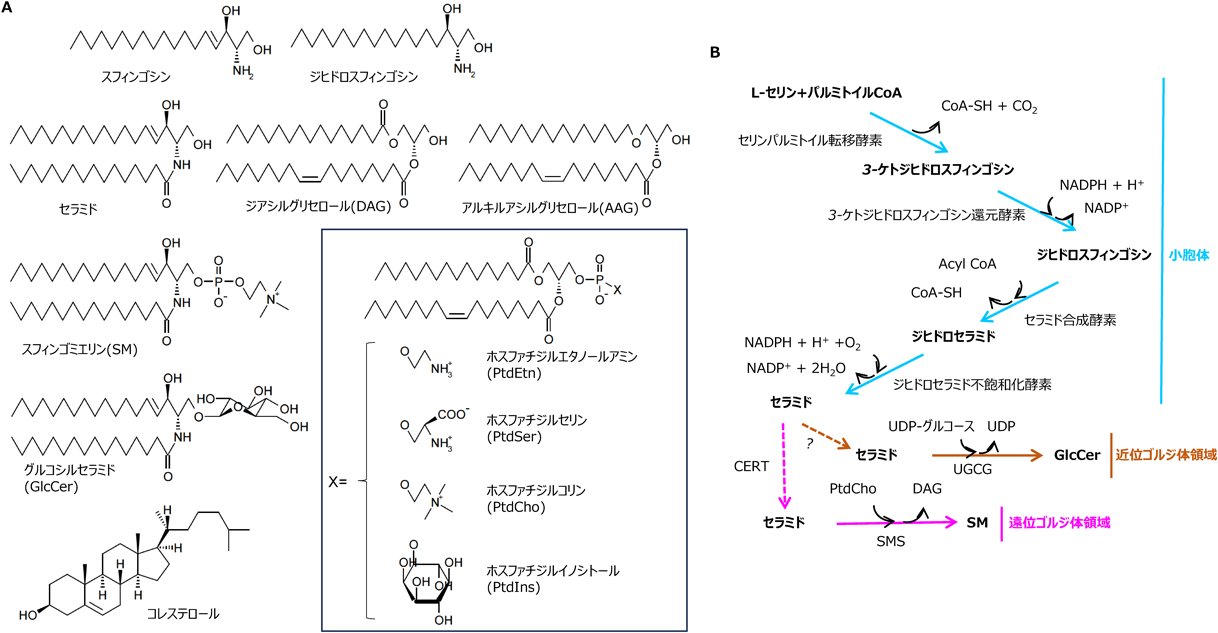
本稿は特集「頑強な不思議脂質セラミドを考える」をなす一部であるので,最初にセラミドの構造,生合成経路,および化学的性質について簡単に紹介する.
長鎖アミノアルコールの一種である長鎖塩基(long-chain base;スフィンゴイド塩基ともいう)を骨格としてもつ一群の脂質がスフィンゴ脂質である.広義のセラミド(ceramide)は,長鎖塩基のアミノ基にアシル基がアミド結合した化合物であり,セラミドにさまざまな親水性の頭部が結合した脂質を複合スフィンゴ脂質と総称する(図1A).セラミドや複合スフィンゴ脂質中の長鎖塩基の構造の違いを区別する場合,スフィンンゴシンのN-アシル化体のみをセラミドと称し,たとえば,ジヒドロスフィンゴシンのN-アシル化体はジヒドロセラミドとして区別する.詳細な化学構造は進化系統樹的に離れた生物種間で異なるものの,スフィンゴ脂質はすべての真核生物および一部の原核生物に存在すると考えられている1).日本セラミド研究会Webサイトにはセラミド研究史の概略を述べているので,興味のある方はご覧いただきたい(https://www.ceramide.gr.jp/academic/36/).
哺乳動物細胞における主たるスフィンゴ脂質の生合成経路を図1Bに示した.セリンとパルミトイルCoAとの縮合からセラミド生産までは小胞体で起こり,セラミドはゴルジ体に運ばれて複合スフィンゴ脂質に変換される.セラミド輸送タンパク質(ceramide transporter:CERT)を介して遠位ゴルジ体領域[distal Golgi region;後期ゴルジ体領域(late Golgi region)ともいう]に運ばれたセラミドはホスホコリンセラミドすなわちスフィンゴミエリン(sphingomyelin:SM)へと,CERT非依存性の経路で近位ゴルジ体領域[proximal Golgi region;前期ゴルジ体領域(early Golgi region)ともいう]に運ばれたセラミドはグルコシルセラミド(glucosylceramide:GlcCer)へとそれぞれ変換される.GlcCerはゴルジ体内を移動しながらさらに複雑なスフィンゴ糖脂質へと変換される.その後,SMやスフィンゴ糖脂質は主に形質膜,それも,細胞外側の半葉に分配される.
グリセロールを構造骨格とするグリセロ脂質(図1A)は,スフィンゴ脂質よりも生物界に広く存在し,その生物進化的出現時期もより早いと考えられる.スフィンゴ脂質生産システムの進化経路は,スフィンゴ脂質生合成を担う酵素およびそれらに類似の反応を担う酵素群の配列比較を基にした系統樹解析によって,モデルの構築が可能である.一方,スフィンゴ脂質が重要な生物因子としてどのようにして選択されていったのかを現在の方法論だけで推定するのは難しいものの,スフィンゴ脂質が必要とされた理由にはグリセロ脂質との間にある化学的性質の差が関与したと想像される1).長鎖塩基と脂肪酸のアミド結合によって形成されているセラミドは,酸エステル結合で成り立っているジアシルグリセロール(diacylglycerol:DAG)よりも,弱酸性・弱アルカリ性の両方で加水分解されにくい.さらに,複合スフィンゴ脂質の一つであるSMはそのホスホコリン部分も化学的に安定であり,他の分子と共有結合を作ることはない一方で,他の分子とイオン結合,水素結合および疎水相互作用など多彩な非共有性の相互作用をすることができる1, 2).なお,SMはリン酸部分の負電荷とコリン部分の正電荷を有する両イオン性分子であり,生理的pHでは電荷的に中性である.スフィンゴ脂質のこういった化学特性を生物はうまく活用してきたのかもしれない.
クラミジア門(Chlamydiota/Chlamydiae)に属する生物は,グラム陰性の真正細菌でありながら動物細胞内でしか増殖できない偏性細胞内寄生というユニークな特性を持つ.門・綱・目・科・属・種と細分化されていく分類において,クラミジア科(Chlamydiaceae)に属がいくつあるかは解釈の変更がしばしば起きている.1990年代末ごろにクラミジア(Chlamydia)とクラミドフィラ(Chlamydophila)の二つの属からなるとされていたが3),系統樹解析を16SリボソームRNA配列から行っていた時代から全ゲノム配列比較をする時代への移行もあり,10年後にはクラミジア属の1属のみに整理された4).さらに約10年後の2020年代には新たに見いだされた新種のためのクラミジフラター属(Chlamydiifrater)を加えて2属とされている5).
ヒトに感染する主たるクラミジア種は角結膜炎や性器感染症を引き起こすC. trachomatis,肺炎を引き起こすC. pneumoniae,鳥類クラミジアで人には重篤な肺炎を引き起こすC. psittaciの3種であるが,ネコのクラミジアC. felisなど他のいくつかのクラミジア種もヒトへの感染例がある6).自然環境下でヒト特異的に感染するのはC. trachomatisのみであるが,培養細胞のレベルであればさまざまな動物に由来する細胞にもC. trachomatisは感染して増殖する.
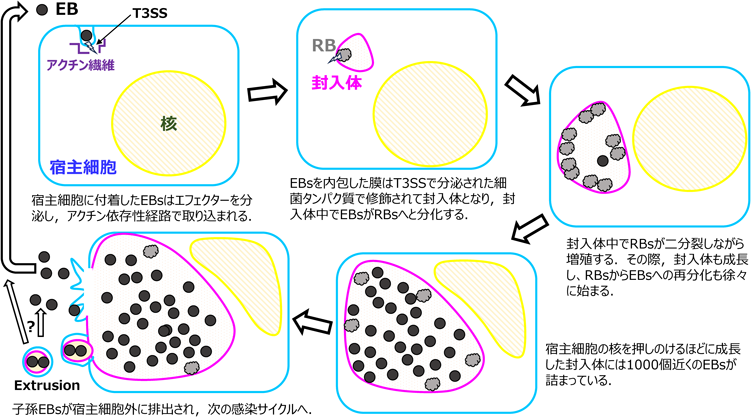
クラミジアはさまざまな低分子化合物の合成を寄生宿主細胞に負っている間に多くの遺伝子を失っていったと考えられ,そのゲノムサイズは約1 Mbしかなく,タンパク質をコードする遺伝子数も900から1500しかない(クラミジア種によって遺伝子数はかなり異なる.なお,大腸菌のゲノムサイズは約3 Mbで遺伝子数は約5000)7, 8).このような小さなゲノムサイズにもかかわらず,クラミジアはその生活環の中で形態的にも機能的にも大きく異なる二相性変化をする(図2)9).基本小体(elementary bodies:EBs)と呼ばれる小型球状の形態型は比較的丈夫であり,感染性を有するが分裂はしない(EBsは代謝的に不活性とされていた時代もあったが,EBsでも物質代謝は起きている10–12)).一方,網様体(reticulate bodies:RBs)と呼ばれる比較的大きくて不定形の形態型は構造的に脆弱であり,二分裂しながら増殖するが感染性はない.
クラミジアのおおよその生活環を図2に示した9, 13).EBsの宿主細胞への付着にはEB表面因子と宿主細胞表面のへパラン硫酸含有因子との間の弱い静電気的作用が関わる.また,この反応の後でEBsと宿主膜が不可逆的に結合する段階があると示唆されていることなどから14, 15),EB付着には複数のステップが関わるとされている.EBsは宿主細胞に付着後,III型分泌装置(type III secretion system:T3SS)を介してエフェクターを宿主細胞サイトゾルに注入し,宿主のアクチン依存性経路によって細胞内に取り込まれる.そして,EBsを内包する宿主膜区画はクラミジア依存性タンパク質によって修飾された封入体と呼ばれる膜区画へと変化する.感染後約2–3時間で,封入体内のEBsはRBsに変化し始め,RBsは分裂しながら増えて子孫RBsを作り,子孫RBsはEBsへと再分化して,感染後約48–72時間に宿主細胞から放出された子孫EBsは次の感染サイクルへと移行する.子孫EBsの放出時に宿主細胞の細胞死を伴う経路と伴わない経路があり,この差をなす仕組みについてもわかり始めている16–18)(本稿9節も参照).
EBsに比べて物理的に脆弱なRBsを分離する方法も報告されているが19),分離したRBsに分裂能があるかは不明である.また,RBsと同様またはそれ以上に封入体も脆弱であり,RBsを内包した封入体を分離して解析できるようになったのは2015年のことである20).Aeberhardらの方法で分離した封入体画分のプロテオーム解析結果をみると,宿主由来のvesicle-associated membrane protein(VAMP)-associated protein(VAP),CERT,および,特定のRabタンパク質やシンタキシンなども含まれていることから20),封入体と接触している宿主オルガネラ膜の少なくとも一部を含む画分と思われる.
宿主動物種だけでなく臓器の種類についてもクラミジア種によって宿主域が異なる宿主トロピズム(host tropism)に関わるクラミジア因子の同定は進みつつある21–23).しかし,個体レベルでは特定の動物種にしか感染しないクラミジア種でも培養細胞レベルなら多様な動物由来細胞に感染できてしまう理由はいまだに謎である.動物体内のような複雑な環境で感染をなすには宿主トロピズムが明確になるような多段階的付着機序が必須であるが,培養細胞条件下ではどの動物細胞の表面にも発現しているヘパラン硫酸含有因子との結合だけで宿主細胞への感染性侵入が成立してしまうのかもしれない.
3. ヒト感染症病原体としてのC. trachomatis
C. trachomatisについてヒト感染症の側面を簡単に述べる.C. trachomatisは,伝染性角結膜炎(trachoma)を起こすことから派生した学名である.衛生状態が悪く,治療も十分に受けられない時代や地域では,角結膜へのC. trachomatis感染が完治せずに再発し,その度に繰り返す炎症によって視力が損なわれ,場合によっては失明に至る.世界的にみてC. trachomatis感染は現在でも後天性失明の主要な原因であるが,著効を示す抗菌薬が複数あることもあり,先進国でのC. trachomatis感染による失明はほぼなくなった.
一方で,C. trachomatisは,先進国を含めた全世界において性器感染症の最多起因病原体であり,2020年時点での世界保健機構の試算によれば,性的に活発とされる15歳から49歳の平均値で女性の4%,男性の2.5%がC. trachomatis性器感染症に罹患しているとされている(https://www.who.int/news-room/fact-sheets/detail/chlamydia;2024年1月5日アクセス).日本においても性器クラミジア感染症の発生動向から推察するに,罹患率は低くない(https://www.niid.go.jp/niid/ja/chlamydia-std-m/chlamydia-std-idwrs/12086-chlamydia-16jun.html;2024年1月5日アクセス).この高い罹患率の背後には,女性の性器クラミジア感染は無症状であることが多い上,たとえ症状に気がついても,結膜炎で眼科にかかるのとは異なり,専門医(主には婦人科または泌尿器科)に行く心的ハードルが高いといった性感染症特有の理由もある.また,性感染症全般において性別に関係なく不特定多数を相手にする行為が大きなリスク因子として知られているが,危険行為をしがちな人ほど基本的な医学知識に不足している可能性もあるなど,特効薬があっても社会的側面の問題は残ったままで罹患者数が減らないといった背景もあろう.性器クラミジア感染症は早期に適切な治療を受ければ多くの場合完治するが,放置すると卵管癒着などの重篤な状態に進行して不妊の原因にもなるので注意が必要である.
C. trachomatisの血清型(serovar)L1, L2,およびL3は,リンパ節に侵入して鼠径リンパ肉芽腫(lymphogranuloma venereum:LGV)を引き起こす.以前は日本でもLGVは多発していたが現在ではほとんどみられなくなった.なお,C. trachomatisの実験室標準株はC. trachomatis serovar L2であることが一般的である.
RBsへの分化途中にある中間体(intermediate bodies:IBs)までなら宿主細胞外でもEBsから分化できる実験条件が最近見いだされた.この成功の鍵はグルタミンである.クラミジアゲノムは,解糖系の最初のステップ[グルコース+ATP→グルコース6-リン酸(G6P)+ADP]を担うヘキソキナーゼ遺伝子を欠いているが他の解糖系遺伝子群は保持しており,また,EBsでは好気的呼吸鎖は働いていないため,EBsにおける主なエネルギーは外部から取り込んだG6Pと考えられている13).2020年,Rajeeveらは,G6Pに加えてグルタミンを添加した培地では,C. trachomatis EBsがIBs形態に変化し,その際,EBsに取り込まれたグルタミンが各種アミノ酸やTCAサイクルメンバーの前駆体として使われて,DNAやペプチドグリカンを含むいくつかの高分子合成も起きることを見いだした12).分裂能を持つRBsまでには至っていないものの12),この発見はクラミジアの二相性変化の分子機序を解く上で画期的な出来事といえよう.
結膜と生殖器のそれぞれの感染病変部から分離したC. trachomatisのゲノム比較をすると,生殖器由来菌ではインドールからトリプトファンを合成する能力を持つ一方で,結膜由来菌では当該能が欠失しているという特徴的な差が見いだされた24).この差を生み出した選択圧として,(特に女性の)生殖器内ではクラミジア以外の微生物によってインドールが供給され,それをクラミジアがトリプトファンに変換して,宿主側の細菌感染応答の一つであるインターフェロンγが惹起するトリプトファン飢餓状況へ耐性を与えるというシナリオが提唱されている24).多様な因子によって決まる感染宿主域トロピズムにおいて,感染する場の微生物叢も無視できない因子と考えられる.
クラミジアがさまざまな面で興味深い特性を持つ生物ということは以上述べた事柄だけでも伝わったかと思う.さて,次節からはセラミドに関するテーマに戻るが,断りのない限り,以下でのクラミジアという記載はC. trachomatisを意味すると捉えていただきたい.
4. 脂質転送タンパク質を介するオルガネラ間脂質輸送
クラミジア感染細胞においては,さまざまな宿主由来の代謝産物が封入体に取り込まれてRBs複製のために利用されており,その中には脂質も含まれる.水溶性の代謝物であれば宿主細胞のサイトゾルから単純拡散で封入体表面に届くであろうが,脂質のような不溶性分子が宿主オルガネラ膜から封入体に移動するには特別の仕組みが必要である.この仕組みについて,早くから提唱されていたのが,宿主細胞の生産する輸送膜小胞が封入膜に融合するという機序である.粗面小胞体で合成された分泌性タンパク質や膜タンパク質はゴルジ体を通って形質膜や他のオルガネラへと輸送される.クラミジア感染細胞においては,宿主ゲノムにコードされるさまざまな膜タンパク質が封入体膜にも分配されており,このことはゴルジ体と形質膜との間で働くべき輸送膜小胞が封入体膜へと誤輸送されてなされる.この膜融合の際には,輸送膜小胞の成分である脂質も封入体膜に混合することになるので,高等動物に特徴的にみられるタイプの複合スフィンゴ脂質やコレステロールは少なくとも一部は宿主由来膜との融合で封入体膜にもたらされると考えられる25–28).
真核細胞全般において,小胞体は脂質の主たる生合成場である29, 30).そして,脂質のオルガネラ間選別輸送では,脂質転送タンパク質群(lipid transfer proteins:LTPs)が中心的な役割を担っていること,それも,異なるオルガネラ膜が近接している部位でLTPsが両方のオルガネラに会合しながらすばやくかつ正確な脂質転送を果たしているとわかってきた30, 31).
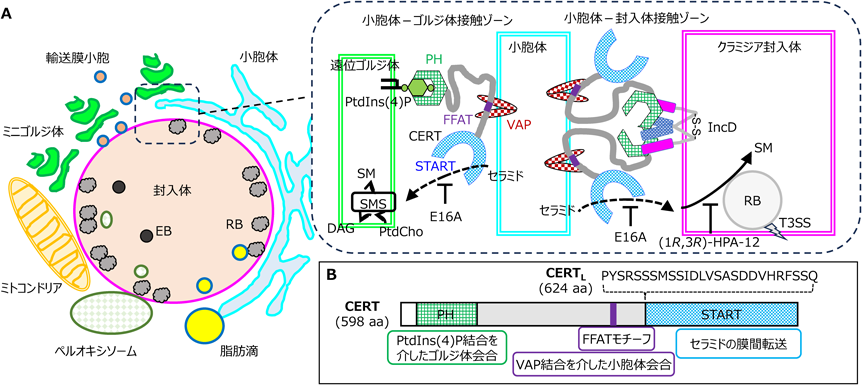
CERTは小胞体で合成されたセラミドをゴルジ体へと運ぶLTPである.CERTは,ゴルジ体に多いホスホイノシチドであるホスファチジルイノシトール4-リン酸[phosphatidylinositol 4-monophosphate:PtdIns(4)P]結合性のプレクストリン相同(Pleckstrin homology:PH)ドメインと,セラミドの膜間転送を触媒するSTARTドメイン,および,小胞体膜タンパク質VAPに結合するペプチドモチーフ・FFATモチーフを有している(図3B)32, 33).CERTは,ゴルジ体と小胞体に同時に結合し,STARTドメインを動かすことで小胞体膜からセラミドを引き抜き,ゴルジ体膜へとすばやくかつ正確に転送していると考えられている(図3A,挿入図)32, 33).
CERTはヒトゲノム遺伝子CERT1から転写され,スプライシングの違いによってCERTとCERTL(別名GPBP)の二つのアイソフォームが生産される(図3B).両アイソフォームともにほぼすべてのヒト臓器で発現していているものの,脳ではCERTLが優勢である一方で,他の臓器ではCERTが優勢である34).
クラミジア感染において,CERTは宿主セラミドを利用する重要な因子として機能している.クラミジアの分離EBsの脂質組成において,通常の細菌が持たないSMやコレステロールが検出される一方で,クラミジアのゲノムにはこれらの脂質の生合成酵素と思われる遺伝子が存在しない.しかし,スフィンゴ脂質合成の初発段階を担う酵素セリンパルミトイル転移酵素が欠損した動物細胞変異株や当該酵素阻害剤を用いた解析から,クラミジアの感染増殖に宿主細胞のスフィンゴ脂質合成が必要ということがわかった35, 36).その後,ゲノムワイドな研究から,クラミジア感染において必要なさまざまな宿主因子が同定され,CERTの必要性も明らかになった37, 38).そして,クラミジア感染細胞では,宿主小胞体とクラミジア封入体との間の接触部位にCERTが分布し,クラミジアゲノムがコードする封入体膜タンパク質IncDがCERTのPHドメインと結合することも示された38, 39).
IncDはジスルフィド結合によってホモ二量体を形成し,このホモ二量体がさらなる大きなオリゴマーを形成する40).CERT PHドメインのPtdIns(4)P結合活性の有無はIncDとの結合に関係しておらず,IncDは膜上に並んだピンセットのような構造でCERT PHドメインのPtdIns(4)P結合領域とは異なる部分を挟み込んで結合するとされている(図3A,挿入図)40).CERTがマウス・クラミジアC. muridarumやオウム病の原因となるC. psittaciの感染増殖においても重要であることは実験的に示されている37, 41).さまざまなクラミジア種のIncDホモログ間のアミノ酸配列同一性は50%程度であるが,CERT PHとの相互作用に関わるアミノ酸残基は保存されており,クラミジア種全般でCERT機能ハイジャックが起きている可能性がある40).
これに基づき,図3で示したような「クラミジアが宿主セラミドを利用する機序」が提案されている.すなわち,小胞体VAPとFFATモチーフを介して会合しているCERTのPHドメインにIncDが結合することで,小胞体–封入体膜接触ゾーンにCERTがリクルートされる.この機能的にハイジャックされたCERTは宿主小胞体で合成されたセラミドを封入体膜へと転送し,封入体に至ったセラミドはSMへと代謝されるため,小胞体から封入体への一方向的なセラミド転送が起きる.ただし,小胞体–封入体接触ゾーン形成の詳細な機序は未解明である.小胞体–封入体間を架橋できる因子はCERT以外にも封入膜タンパク質IncVなど複数存在しそうなので42),冗長性があると考えられている.
6. クラミジア感染細胞におけるセラミドからSMへの変換
ヒトゲノムにはSM合成酵素(SM synthase:SMS)をコードする二つの遺伝子SGMS1とSGMS2が存在し,SGMS1にコードされるSMS1はゴルジ体に局在して,SMの新規合成で主要な役割を果たしている一方で,SGMS2にコードされるSMS2は形質膜とゴルジ体の両方に分布して,形質膜上のSMが分解されてできたセラミドをSMへと再合成する役割を担うと考えられている43).クラミジアのゲノムにSGMS1/SGMS2のホモログは存在せず,また,クラミジア感染細胞ではSMS2が封入体に分布することから,封入体に運ばれたセラミドはSMS2によってSMへと変換されると考えられていた37).しかし,この考えには修正が必要となってきた.
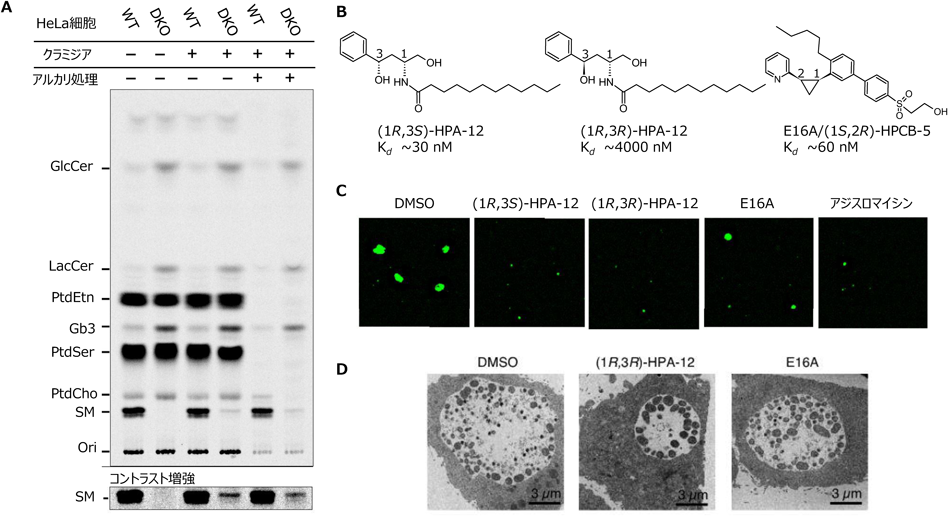
スフィンゴ脂質合成に関わる複数の遺伝子をHeLa細胞で破壊した変異細胞株を樹立し,クラミジア感染に与える影響を調べたところ,以下のような発見があった44).
- 1) CERT欠失細胞では,予想どおりクラミジア増殖に負の影響がみられた.
- 2) SMS1/SMS2の二重欠失細胞では,予想に反してクラミジアは親細胞同様に増殖した.
- 3) SMS1/SMS2/CERTの三重欠失にするとクラミジアは増殖できなかった.
これらの結果は,HeLa細胞へのクラミジアの感染増殖において,宿主細胞のCERTは必要だがSMS1およびSMS2は必要ではないことを示している.また,セラミドをSMへと変換する活性はSMS1/SMS2二重欠損細胞自体にはみられないが,クラミジアが感染すると活性が検出されるという思いがけない発見もあった(図4A)44).このクラミジア感染依存的に出現するSM合成活性(以後,本活性を「クラミジア感染依存SMS」と呼ぶ)は,以下で説明するように,新たな抗クラミジア剤の分子標的となりそうだ.
7. 新たな機序の抗クラミジア活性を持つセラミド類似体
筆者らは有機合成の専門家たちと共同研究をしながら二つのタイプのCERT阻害剤を開発してきた(図4B)45).一つは,セラミドと構造類似性を持つ(1R,3S)-HPA-12であり46),2001年に発表した当初は,小胞体からゴルジ体へのセラミド移動を抑制する化合物として発表し,後になってその分子標的がCERTであると判明した47).もう一つのCERT阻害剤は,セラミド類似構造がない新規化合物として開発したE16A[化学構造に即した略名は(1S,2R)-HPCB-5]であり,E16Aの開発にはCERTとセラミドの共結晶構造など今まで蓄積してきた知見を基盤とした構造ベース創薬の手法が駆使されている48).
HPA-12には四つの立体異性体があるが,CERT阻害活性があるのは(1R,3S)型だけである46).阻害剤を使ってクラミジア感染におけるCERTの重要性を確認してみたところ,E16Aや(1R,3S)-HPA-12には予想どおり抗クラミジア活性を認めたものの,陰性対照として使用したCERT阻害活性のない(1R,3R)-HPA-12にもE16Aよりも強い抗クラミジア活性が認められた(図4B, C)49).この予想外の結果の原因を明らかにすべく実施した解析から,セラミド類似構造を持つ(1R,3R)-HPA-12がクラミジア感染依存SMS活性を阻害し,さらに,この化合物自体がクラミジア感染依存SMSの基質となりホスホコリン修飾されることが判明した49).ホスホコリン修飾された(1R,3R)-HPA-12は界面活性剤のような両親媒性の物性を持つと想像される.クラミジアEBsと共培養したHeLa細胞の電子顕微鏡像観察から(図4D),CERT阻害剤E16A処理細胞でも小型の封入体は形成されており,その中でRBsへと分化して分裂し,EBsへの再分化もみられるが,(1R,3R)-HPA-12処理細胞では小型の封入体形成とその中である程度の分裂は起きていてもEBsへの再分化がみられなかった49).(1R,3R)-HPA-12は,宿主細胞のSM合成にはほとんど影響せずに,クラミジア感染依存SMSでホスホコリン修飾型になることで膜毒性を持つようになって,クラミジアの菌体もしくは封入体を機能不全に陥らせるというような機序によってクラミジア感染細胞に選択毒性を発揮する化合物なのかもしれない.
グリセロリン脂質はどの細胞でも主要な膜構成リン脂質である.しかし,グリセロリン脂質のサブグループまで目を向けると,ホスファチジルコリン(phosphatidylcholine:PtdCho)の合成能はおそらくすべての真核生物が持っている一方で,限られた細菌しかPtdCho合成能は持っていない50).クラミジアのゲノムにはPtdCho合成酵素ホモログはコードされていないが,分離EBsにはPtdCho,それも細菌に特徴的な分岐型脂肪酸で修飾されたPtdChoが検出されると報告されている51).この一見矛盾した結果は,宿主の合成したPtdChoが封入体の内腔側に移行して,クラミジアゲノムにコードされた酵素で脂肪酸部分の置換が起こるためとされている51).
宿主細胞中にはPtdChoの膜間転送活性を有するLTPsが複数存在している30, 52).しかし,当該LTPsが宿主オルガネラから封入体膜へPtdChoを供給したとしても,PtdChoのように電荷を持つ脂質は内在性膜タンパク質の助けがないと封入体膜中のサイトゾル側半葉から内腔側半葉に移動できないと考えられる.この問題はヒトゲノムにコードされている膜タンパク質をクラミジアが活用して解決しているようだ.ATP-binding cassette transporter A1(ABCA1)はATPの加水分解と共役しながらコレステロールとPtdChoを細胞内から細胞外に排出して,これら脂質分子を受容体CLA1に結合したリポタンパク質apoA1に渡すことにより,高密度リポタンパク質(high-density lipoprotein:HDL)形成に関わる.興味深いことに,クラミジア感染細胞ではABCA1を含むHDL形成装置セットが封入体にも部分的に分布しており,蛍光性PtdChoプローブの封入体内蓄積はACBA1阻害剤グリブリド処理でブロックされる53).したがって,LTPを介して封入体膜サントゾル側半葉に転送されたPtdChoは封入体膜上のABCA1を介して内腔側半葉に移行しうると考えられる.
なお,分離EBsに由来するPtdChoはすべて宿主細胞膜の混在が原因であり,クラミジア自身で合成系を持っているホスファチジルエタノールアミン(phosphatidylethanolamine:PtdEtn)の分岐脂肪酸型は感染依存的に検出されるが,クラミジア感染依存の分岐脂肪酸型PtdCho生産はそもそも検出されないとの報告もある54).
9. クラミジアにとってなぜセラミドやCERTが必要なのか?
本節タイトルの問いに対する明確な答えはまだないが,いくつかの可能性を考察したい.
上述したように,CERT阻害剤処理細胞でもクラミジア感染後に小型の封入体は形成されており,その中でRBsは分裂してEBsへの再分化も部分的に起きるが,大型封入体への成長がほぼみられない(図4C, D)49).この傾向はCERT欠失細胞でも同様にみられる(山本,花田ら,未発表).また,非感染状態での観察ではあるが,CHO細胞において形質膜のSMが減少すると形質膜中にコレステロールをとめ置きにくくなり55),形質膜の脂質ラフトと称される秩序液相(liquid ordered phase)の特性や膜強度の減少が起きる56).これらの知見から想像するに,SMは封入体膜上でラフト様の脂質ドメインを形成し,それが封入体の機能や成長に必要なのかもしれない.
分離EBsの脂質組成は細菌というよりはむしろ宿主細胞に近く51, 57),分離EB画分への宿主細胞由来膜の混在が疑われてきた54).しかし,本稿の前半でふれた「宿主細胞の細胞死を伴わずに子孫EBが放出される」場合,EBsを内包した封入体の一部が押し出されて,宿主形質膜を覆った小胞(これをextrusionsと呼ぶ)として放出される(図2)16).よって,分離EBsの脂質組成に宿主細胞膜脂質が混在するのはextrusionsの性質を反映した結果とも考えられる.37°C処理による感染性失活タイムコースを比較した場合,宿主細胞外に出たフリーのEBsに比べて分離extrusions中のEBsの方が安定である58).Extrusions表面にはホスファチジルセリン(phosphatidylserine:PtdSer,正常の形質膜リン脂質二重層においては細胞質側を向いており,細胞外側に表出するとeat-meシグナルとなる)が表出しており,マクロファージに貪食されるが,フリーEBsに比べてextrusions中のEBsの方がマクロファージ貪食後でも安定に存在する58).EBsは宿主動物に近い脂質組成を持つ膜構造(封入体もしくはextrusions)の中にいるほうが,宿主細胞外でも比較的安定に存在でき,さらに,宿主動物の細菌侵入監視システムからも見逃されやすいといったような利点があるのかもしれない.
DAGは,グリセロリン脂質代謝の重要な中間体であるだけでなく,それ自身がさまざまなタンパク質機能の制御リガンドとしても機能するので,各オルガネラ膜内DAG量は適正レベル内に収まるようにコントロールされているはずであるが,その実際はよくわかっていない.無細胞系のアッセイにおいてCERTは,セラミドだけではなく,構造的にセラミドに類似したDAGやアルキルアシルグリセロール(sn-1-alkyl-2-acylglycerol:AAG)(図1A)も膜間転送する32, 59, 60).よって,CERTは,単にセラミドを封入体に運ぶだけでなく,封入体からDAG/AAGを宿主細胞小胞体に転送する可能性がある.封入体にDAGが蓄積することが知られており61),また,封入体の内腔側には宿主細胞で形成されたオルガネラである脂肪滴62, 63),ペルオキシソーム64),後期エンドソームの一つである多胞体(multivesicular bodies:MVBs)が17, 65),部分的に存在している.脂肪滴にはトリアシルグリセロール(triacylglycerol:TAG)が多量に存在し,TAGリパーゼが働けばDAGと脂肪酸が生産される.ペルオキシソームはアルキルアシル型グリセロリン脂質(alkylacyl glycerophospholipids:AAGPL)生合成の重要な前駆体であるアルキルジヒドロアセトンリン酸(1-alkyl dihydroxyacetone 3-phosphate:ADHAP)を生産する66).クラミジアは宿主由来ADHAPを利用してAAGPLを合成できると示唆されており64),AAGPLの極性頭部がホスホリパーゼC反応で外れればAAGとなる.クラミジアにとって必要以上のDAG/AAGが封入体内にたまった場合に,それを宿主小胞体に“廃棄”する仕組みとして小胞体–封入体間にリクルートしたCERTを活用しているのかもしれない.
CERTとクラミジアという特異な組合わせの研究から,宿主細胞と細胞内寄生性微生物との間の脂質輸送の仕組みの理解が進み,生物の共進化に関する洞察をする一つの手がかりも得られた.このような課題に若手研究者が興味を抱き,積極的に取り組んでくれることを期待したい.
謝辞Acknowledgments
クラミジアというユニークな生物の存在を私が知ったきっかけは,大学生時代に読んだ『細菌とウイルスの間』(東 昇・著 岩波新書)であった.その後,博士課程まで進み,学位取得した後の職場では,主にスフィンゴ脂質の代謝やオルガネラ間輸送の研究に従事してきた.この間の1990年代終盤ごろ,私が樹立したスフィンゴ脂質合成欠損CHO細胞を,著名なクラミジア研究者である米国カルフォルニア大のJoanne Engel博士の研究グループに提供したことで,クラミジア研究に関わる契機が生まれた.その後,自身が部長を務めた研究部でも2010年ごろからクラミジアについての基礎研究に参画し,新たな視点での研究に取り組むことができた.この期間中,国立感染症研究所・ウイルス一部の安藤秀二博士には疫学を含むクラミジア感染症の日本の現状を教えていただき,同研究所・細胞化学部の熊谷圭悟博士にはクラミジア培養系の導入を含むさまざまな実験作業において中心的な役割をしていただいた.これらの方々以外にも多くの皆様のご支援があり,研究を進めることができたこと,この場を借りて,感謝申し上げます.
引用文献References
1) Hanada, K. (2014) Co-evolution of sphingomyelin and the ceramide transport protein CERT. Biochim. Biophys. Acta Mol. Cell Biol. Lipids, 1841, 704–719.
2) Murata, M., Matsumori, N., Kinoshita, M., & London, E. (2022) Molecular substructure of the liquid-ordered phase formed by sphingomyelin and cholesterol: Sphingomyelin clusters forming nano-subdomains are a characteristic feature. Biophys. Rev., 14, 655–678.
3) Everett, K.D., Bush, R.M., & Andersen, A.A. (1999) Emended description of the order Chlamydiales, proposal of Parachlamydiaceae fam. nov. and Simkaniaceae fam. nov., each containing one monotypic genus, revised taxonomy of the family Chlamydiaceae, including a new genus and five new species, and standards for the identification of organisms. Int. J. Syst. Evol. Microbiol., 49, 415–440.
4) Stephens, R.S., Myers, G., Eppinger, M., & Bavoil, P.M. (2009) Divergence without difference: Phylogenetics and taxonomy of Chlamydia resolved. FEMS Immunol. Med. Microbiol., 55, 115–119.
5) Vorimore, F., Holzer, M., Liebler-Tenorio, E.M., Barf, L.M., Delannoy, S., Vittecoq, M., Wedlarski, R., Lecu, A., Scharf, S., Blanchard, Y., et al. (2021) Evidence for the existence of a new genus Chlamydiifrater gen. nov. inside the family Chlamydiaceae with two new species isolated from flamingo (Phoenicopterus roseus): Chlamydiifrater phoenicopteri sp. nov. and Chlamydiifrater volucris sp. nov. Syst. Appl. Microbiol., 44, 126200.
6) Borel, N. & Sachse, K.(2023) Zoonotic Transmission of Chlamydia spp.: Known for 140 Years, but Still Underestimated. in Zoonoses: Infections Affecting Humans and Animals, pp. 1–28, Springer.
7) Sigalova, O.M., Chaplin, A.V., Bochkareva, O.O., Shelyakin, P.V., Filaretov, V.A., Akkuratov, E.E., Burskaia, V., & Gelfand, M.S. (2019) Chlamydia pan-genomic analysis reveals balance between host adaptation and selective pressure to genome reduction. BMC Genomics, 20, 710.
8) Luu, L.D.W., Kasimov, V., Phillips, S., Myers, G.S.A., & Jelocnik, M. (2023) Genome organization and genomics in Chlamydia: Whole genome sequencing increases understanding of chlamydial virulence, evolution, and phylogeny. Front. Cell. Infect. Microbiol., 13, 1178736.
9) Gitsels, A., Sanders, N., & Vanrompay, D. (2019) Chlamydial infection from outside to inside. Front. Microbiol., 10, 2329.
10) Haider, S., Wagner, M., Schmid, M.C., Sixt, B.S., Christian, J.G., Hacker, G., Pichler, P., Mechtler, K., Muller, A., Baranyi, C., et al. (2010) Raman microspectroscopy reveals long-term extracellular activity of Chlamydiae. Mol. Microbiol., 77, 687–700.
11) Omsland, A., Sager, J., Nair, V., Sturdevant, D.E., & Hackstadt, T. (2012) Developmental stage-specific metabolic and transcriptional activity of Chlamydia trachomatis in an axenic medium. Proc. Natl. Acad. Sci. USA, 109, 19781–19785.
12) Rajeeve, K., Vollmuth, N., Janaki-Raman, S., Wulff, T.F., Baluapuri, A., Dejure, F.R., Huber, C., Fink, J., Schmalhofer, M., Schmitz, W., et al. (2020) Reprogramming of host glutamine metabolism during Chlamydia trachomatis infection and its key role in peptidoglycan synthesis. Nat. Microbiol., 5, 1390–1402.
13) Stelzner, K., Vollmuth, N., & Rudel, T. (2023) Intracellular lifestyle of Chlamydia trachomatis and host-pathogen interactions. Nat. Rev. Microbiol., 21, 448–462.
14) Carabeo, R.A. & Hackstadt, T. (2001) Isolation and characterization of a mutant Chinese hamster ovary cell line that is resistant to Chlamydia trachomatis infection at a novel step in the attachment process. Infect. Immun., 69, 5899–5904.
15) Fudyk, T., Olinger, L., & Stephens, R.S. (2002) Selection of mutant cell lines resistant to infection by Chlamydia spp. Infect. Immun., 70, 6444–6447.
16) Hybiske, K. & Stephens, R.S. (2007) Mechanisms of host cell exit by the intracellular bacterium Chlamydia. Proc. Natl. Acad. Sci. USA, 104, 11430–11435.
17) Beatty, W.L. (2007) Lysosome repair enables host cell survival and bacterial persistence following Chlamydia trachomatis infection. Cell. Microbiol., 9, 2141–2152.
18) Lutter, E.I., Barger, A.C., Nair, V., & Hackstadt, T. (2013) Chlamydia trachomatis inclusion membrane protein CT228 recruits elements of the myosin phosphatase pathway to regulate release mechanisms. Cell Rep., 3, 1921–1931.
19) Scidmore, M.A. (2005) Cultivation and laboratory maintenance of Chlamydia trachomatis. Curr. Protoc. Microbiol., Chapter 11, 1.
20) Aeberhard, L., Banhart, S., Fischer, M., Jehmlich, N., Rose, L., Koch, S., Laue, M., Renard, B.Y., Schmidt, F., & Heuer, D. (2015) The proteome of the isolated Chlamydia trachomatis containing vacuole reveals a complex trafficking platform enriched for retromer components. PLoS Pathog., 11, e1004883.
21) Gomes, J.P., Nunes, A., Bruno, W.J., Borrego, M.J., Florindo, C., & Dean, D. (2006) Polymorphisms in the nine polymorphic membrane proteins of Chlamydia trachomatis across all serovars: Evidence for serovar Da recombination and correlation with tissue tropism. J. Bacteriol., 188, 275–286.
22) Lutter, E.I., Bonner, C., Holland, M.J., Suchland, R.J., Stamm, W.E., Jewett, T.J., McClarty, G., & Hackstadt, T. (2010) Phylogenetic analysis of Chlamydia trachomatis Tarp and correlation with clinical phenotype. Infect. Immun., 78, 3678–3688.
23) Abdelsamed, H., Peters, J., & Byrne, G.I. (2013) Genetic variation in Chlamydia trachomatis and their hosts: Impact on disease severity and tissue tropism. Future Microbiol., 8, 1129–1146.
24) Caldwell, H.D., Wood, H., Crane, D., Bailey, R., Jones, R.B., Mabey, D., Maclean, I., Mohammed, Z., Peeling, R., Roshick, C., et al. (2003) Polymorphisms in Chlamydia trachomatis tryptophan synthase genes differentiate between genital and ocular isolates. J. Clin. Invest., 111, 1757–1769.
25) Hackstadt, T., Rockey, D.D., Heinzen, R.A., & Scidmore, M.A. (1996) Chlamydia trachomatis interrupts an exocytic pathway to acquire endogenously synthesized sphingomyelin in transit from the Golgi apparatus to the plasma membrane. EMBO J., 15, 964–977.
26) Carabeo, R.A., Mead, D.J., & Hackstadt, T. (2003) Golgi-dependent transport of cholesterol to the Chlamydia trachomatis inclusion. Proc. Natl. Acad. Sci. USA, 100, 6771–6776.
27) Capmany, A. & Damiani, M.T. (2010) Chlamydia trachomatis intercepts Golgi-derived sphingolipids through a Rab14-mediated transport required for bacterial development and replication. PLoS One, 5, e14084.
28) Elwell, C.A. & Engel, J.N. (2012) Lipid acquisition by intracellular Chlamydiae. Cell. Microbiol., 14, 1010–1018.
29) Vance, J.E. (2015) Phospholipid synthesis and transport in mammalian cells. Traffic, 16, 1–18.
30) Hanada, K. (2018) Lipid transfer proteins rectify inter-organelle flux and accurately deliver lipids at membrane contact sites. J. Lipid Res., 59, 1341–1366.
31) 花田賢太郎(2023)オルガネラ膜接触ゾーンにおける脂質選別輸送システムの動作原理.生化学,95, 279–295.
32) Hanada, K., Kumagai, K., Yasuda, S., Miura, Y., Kawano, M., Fukasawa, M., & Nishijima, M. (2003) Molecular machinery for non-vesicular trafficking of ceramide. Nature, 426, 803–809.
33) Kawano, M., Kumagai, K., Nishijima, M., & Hanada, K. (2006) Efficient trafficking of ceramide from the endoplasmic reticulum to the Golgi apparatus requires a VAMP-associated protein-interacting FFAT motif of CERT. J. Biol. Chem., 281, 30279–30288.
34) Murakami, H., Tamura, N., Enomoto, Y., Shimasaki, K., Kurosawa, K., & Hanada, K. (2020) Intellectual disability-associated gain-of-function mutations in CERT1 that encodes the ceramide transport protein CERT. PLoS One, 15, e0243980.
35) van Ooij, C., Kalman, L., van Ijzendoorn, Nishijima, M., Hanada, K., Mostov, K., & Engel, J.N. (2000) Host cell-derived sphingolipids are required for the intracellular growth of Chlamydia trachomatis. Cell. Microbiol., 2, 627–637.
36) Robertson, D.K., Gu, L., Rowe, R.K., & Beatty, W.L. (2009) Inclusion biogenesis and reactivation of persistent Chlamydia trachomatis requires host cell sphingolipid biosynthesis. PLoS Pathog., 5, e1000664.
37) Elwell, C.A., Jiang, S., Kim, J.H., Lee, A., Wittmann, T., Hanada, K., Melancon, P., & Engel, J.N. (2011) Chlamydia trachomatis co-opts GBF1 and CERT to acquire host sphingomyelin for distinct roles during intracellular development. PLoS Pathog., 7, e1002198. Correction: ibid (2013) https://doi.org/10.1371/annotation/f8e7c7e3-c347-4243-9146-db77900cb90c.
38) Derré, I., Swiss, R., & Agaisse, H. (2011) The lipid transfer protein CERT interacts with the Chlamydia inclusion protein IncD and participates to ER-Chlamydia inclusion membrane contact sites. PLoS Pathog., 7, e1002092.
39) Agaisse, H. & Derre, I. (2014) Expression of the effector protein IncD in Chlamydia trachomatis mediates recruitment of the lipid transfer protein CERT and the endoplasmic reticulum-resident protein VAPB to the inclusion membrane. Infect. Immun., 82, 2037–2047.
40) Kumagai, K., Elwell, C.A., Ando, S., Engel, J.N., & Hanada, K. (2018) Both the N- and C- terminal regions of the Chlamydial inclusion protein D (IncD) are required for interaction with the pleckstrin homology domain of the ceramide transport protein CERT. Biochem. Biophys. Res. Commun., 505, 1070–1076.
41) Koch-Edelmann, S., Banhart, S., Saied, E.M., Rose, L., Aeberhard, L., Laue, M., Doellinger, J., Arenz, C., & Heuer, D. (2017) The cellular ceramide transport protein CERT promotes Chlamydia psittaci infection and controls bacterial sphingolipid uptake. Cell. Microbiol., 19, e12752.
42) Murray, R., Flora, E., Bayne, C., & Derre, I. (2017) IncV, a FFAT motif-containing Chlamydia protein, tethers the endoplasmic reticulum to the pathogen-containing vacuole. Proc. Natl. Acad. Sci. USA, 114, 12039–12044.
43) Huitema, K., van den Dikkenberg, J., Brouwers, J.F., & Holthuis, J.C. (2004) Identification of a family of animal sphingomyelin synthases. EMBO J., 23, 33–44.
44) Tachida, Y., Kumagai, K., Sakai, S., Ando, S., Yamaji, T., & Hanada, K. (2020) Chlamydia trachomatis-infected human cells convert ceramide to sphingomyelin without sphingomyelin synthases 1 and 2. FEBS Lett., 594, 519–529.
45) Hanada, K., Sakai, S., & Kumagai, K. (2022) Natural ligand-mimetic and nonmimetic inhibitors of the Ceramide Transport Protein CERT. Int. J. Mol. Sci., 23, 2098.
46) Yasuda, S., Kitagawa, H., Ueno, M., Ishitani, H., Fukasawa, M., Nishijima, M., Kobayashi, S., & Hanada, K. (2001) A novel inhibitor of ceramide trafficking from the endoplasmic reticulum to the site of sphingomyelin synthesis. J. Biol. Chem., 276, 43994–44002. Correction: ibid (2013) 288, 24162.
47) Kumagai, K., Yasuda, S., Okemoto, K., Nishijima, M., Kobayashi, S., & Hanada, K. (2005) CERT mediates intermembrane transfer of various molecular species of ceramides. J. Biol. Chem., 280, 6488–6495.
48) Nakao, N., Ueno, M., Sakai, S., Egawa, D., Hanzawa, H., Kawasaki, S., Kumagai, K., Suzuki, M., Kobayashi, S., & Hanada, K. (2019) Natural ligand-nonmimetic inhibitors of the lipid-transfer protein CERT. Commun. Chem., 2, 20.
49) Kumagai, K., Sakai, S., Ueno, M., Kataoka, M., Kobayashi, S., & Hanada, K. (2022) Chlamydial infection-dependent synthesis of sphingomyelin as a novel anti-chlamydial target of ceramide mimetic compounds. Int. J. Mol. Sci., 23, 14697.
50) Geiger, O., Lopez-Lara, I.M., & Sohlenkamp, C. (2013) Phosphatidylcholine biosynthesis and function in bacteria. Biochim. Biophys. Acta Mol. Cell Biol. Lipids, 1831, 503–513.
51) Wylie, J.L., Hatch, G.M., & McClarty, G. (1997) Host cell phospholipids are trafficked to and then modified by Chlamydia trachomatis. J. Bacteriol., 179, 7233–7242.
52) Wong, L.H., Gatta, A.T., & Levine, T.P. (2019) Lipid transfer proteins: The lipid commute via shuttles, bridges and tubes. Nat. Rev. Mol. Cell Biol., 20, 85–101.
53) Cox, J.V., Naher, N., Abdelrahman, Y.M., & Belland, R.J. (2012) Host HDL biogenesis machinery is recruited to the inclusion of Chlamydia trachomatis-infected cells and regulates chlamydial growth. Cell. Microbiol., 14, 1497–1512.
54) Yao, J., Cherian, P.T., Frank, M.W., & Rock, C.O. (2015) Chlamydia trachomatis relies on autonomous phospholipid synthesis for membrane biogenesis. J. Biol. Chem., 290, 18874–18888.
55) Fukasawa, M., Nishijima, M., Itabe, H., Takano, T., & Hanada, K. (2000) Reduction of sphingomyelin level without accumulation of ceramide in Chinese hamster ovary cells affects detergent-resistant membrane domains and enhances cellular cholesterol efflux to methyl-beta -cyclodextrin. J. Biol. Chem., 275, 34028–34034.
56) Monasterio, B.G., Jimenez-Rojo, N., Garcia-Arribas, A.B., Riezman, H., Goni, F.M., & Alonso, A. (2021) CHO/LY-B cell growth under limiting sphingolipid supply: Correlation between lipid composition and biophysical properties of sphingolipid-restricted cell membranes. FASEB J., 35, e21657.
57) Hatch, G.M. & McClarty, G. (1998) Phospholipid composition of purified Chlamydia trachomatis mimics that of the eucaryotic host cell. Infect. Immun., 66, 3727–3735.
58) Zuck, M., Ellis, T., Venida, A., & Hybiske, K. (2017) Extrusions are phagocytosed and promote Chlamydia survival within macrophages. Cell. Microbiol., 19, e12683.
59) Kudo, N., Kumagai, K., Tomishige, N., Yamaji, T., Wakatsuki, S., Nishijima, M., Hanada, K., & Kato, R. (2008) Structural basis for specific lipid recognition by CERT responsible for nonvesicular trafficking of ceramide. Proc. Natl. Acad. Sci. USA, 105, 488–493.
60) Horibata, Y. & Sugimoto, H. (2023) The ceramide transport protein CERT is involved in alkylacylglycerol transfer from the ER to the Golgi for the biosynthesis of ether phospholipid. Arch. Biochem. Biophys., 752, 109871.
61) Tse, S.M., Mason, D., Botelho, R.J., Chiu, B., Reyland, M., Hanada, K., Inman, R.D., & Grinstein, S. (2005) Accumulation of diacylglycerol in the Chlamydia inclusion vacuole: Possible role in the inhibition of host cell apoptosis. J. Biol. Chem., 280, 25210–25215.
62) Kumar, Y., Cocchiaro, J., & Valdivia, R.H. (2006) The obligate intracellular pathogen Chlamydia trachomatis targets host lipid droplets. Curr. Biol., 16, 1646–1651.
63) Cocchiaro, J.L., Kumar, Y., Fischer, E.R., Hackstadt, T., & Valdivia, R.H. (2008) Cytoplasmic lipid droplets are translocated into the lumen of the Chlamydia trachomatis parasitophorous vacuole. Proc. Natl. Acad. Sci. USA, 105, 9379–9384.
64) Boncompain, G., Muller, C., Meas-Yedid, V., Schmitt-Kopplin, P., Lazarow, P.B., & Subtil, A. (2014) The intracellular bacteria Chlamydia hijack peroxisomes and utilize their enzymatic capacity to produce bacteria-specific phospholipids. PLoS One, 9, e86196.
65) Gambarte Tudela, J., Capmany, A., Romao, M., Quintero, C., Miserey-Lenkei, S., Raposo, G., Goud, B., & Damiani, M.T. (2015) The late endocytic Rab39a GTPase regulates the interaction between multivesicular bodies and chlamydial inclusions. J. Cell Sci., 128, 3068–3081.
66) Lodhi, I.J. & Semenkovich, C.F. (2014) Peroxisomes: A nexus for lipid metabolism and cellular signaling. Cell Metab., 19, 380–392.
67) Heuer, D., Rejman Lipinski, A., Machuy, N., Karlas, A., Wehrens, A., Siedler, F., Brinkmann, V., & Meyer, T.F. (2009) Chlamydia causes fragmentation of the Golgi compartment to ensure reproduction. Nature, 457, 731–735.
68) Revert, F., Revert-Ros, F., Blasco, R., Artigot, A., Lopez-Pascual, E., Gozalbo-Rovira, R., Ventura, I., Gutierrez-Carbonell, E., Roda, N., Ruiz-Sanchis, D., et al. (2018) Selective targeting of collagen IV in the cancer cell microenvironment reduces tumor burden. Oncotarget, 9, 11020–11045.
69) Goto, A., Egawa, D., Tomishige, N., Yamaji, T., Shimasaki, K., Kumagai, K., & Hanada, K. (2022) Involvement of a cluster of basic amino acids in Phosphorylation-dependent functional repression of the Ceramide Transport Protein CERT. Int. J. Mol. Sci., 23, 8576.
70) Gehin, C., Lone, M.A., Lee, W., Capolupo, L., Ho, S., Adeyemi, A.M., Gerkes, E.H., Stegmann, A.P., Lopez-Martin, E., Bermejo-Sanchez, E., et al. (2023) CERT1 mutations perturb human development by disrupting sphingolipid homeostasis. J. Clin. Invest., 133, e165019.
著者紹介Author Profile
 花田 賢太郎(はなだ けんたろう)
花田 賢太郎(はなだ けんたろう)国立感染症研究所品質管理研究センター 主任研究官(名誉所員).薬学博士.
略歴1983年東京大学薬学部卒業.88年東京大学薬学系大学院博士課程修了.88年国立予防衛生研究所化学部研究員.98年国立感染症研究所細胞化学部室長.2006年国立感染症研究所細胞化学部部長.09~12年国立感染症研究所品質保証室室長併任.21年定年退任.21~23年国立感染症研究所品質保証・管理部主任研究官(名誉所員).24年より現職.
研究テーマと抱負CERTは,本稿で紹介した病原体感染への関与だけでなく,その機能制御不全が先天性精神疾患の原因になることも分かってきており.これらに関する研究を細々とでも継続していきたいと思っています.
ウェブサイトhttps://www.niid.go.jp/niid/ja/from-biochem/3257-2013-02-25-06-28-53.html
趣味神社仏閣巡り,古書・雑本,家庭菜園.