1. 赤痢アメーバ(Entamoeba histolytica)の生活環
赤痢アメーバは,アメーバ症を引き起こす単細胞真核生物の寄生虫である.全世界で5000万人が感染し,毎年4–7万人の死亡者が報告されている.わが国でも年間数百例の報告があり,その罹患率は年々増加の傾向にある.治療薬が限られること,有効なワクチンが存在しないことから,病原性の解明,新規薬剤開発が喫緊の課題である.
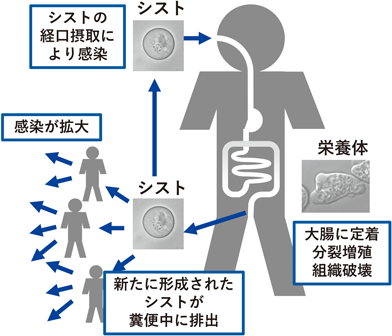
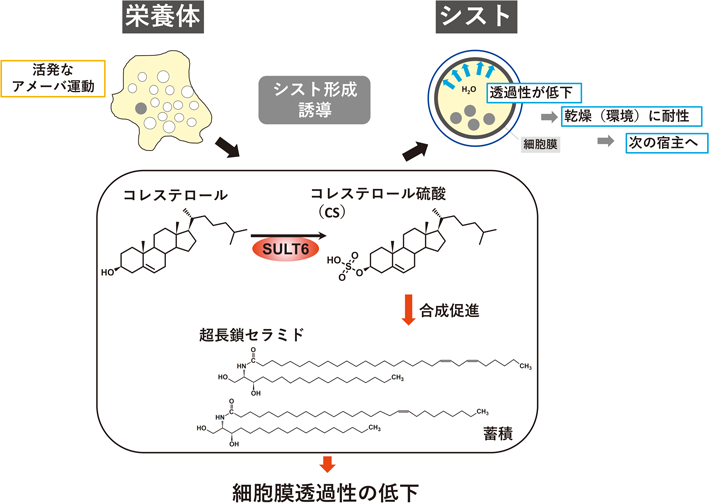
赤痢アメーバの生活環は,栄養体とシストの二つのステージからなる(図1).ヒトへの感染はシストの経口摂取によって引き起こされる.摂取されたシストは胃を通過し,小腸に達して脱嚢し,栄養体となる.その後大腸へ移動し,活発な増殖を繰り返す.この際,組織破壊が伴うとさまざまな病態(粘血便,下痢,腹痛)が発症する.一方で,大腸内で栄養体の一部がシストになり糞便とともに排出され,次の宿主へ伝播し,感染を拡大させる(図1).
栄養体は激しいアメーバ運動をする細胞で,二分裂で増殖をする.赤血球や宿主細胞をファゴサイトーシス(貪食)により取り込んで栄養を得る他,トロゴサイトーシス(齧作用)で宿主細胞の一部を取り込むことで宿主の殺傷を引き起こし組織への侵入を行う.そのため,細胞内小胞輸送が活発である.一方のシストは,四核の球形の休眠細胞で,固いシスト壁に覆われており動きがない.シスト壁は,キチン線維と構造タンパク質(Jacobs, Jessies),キチン分解酵素(キチナーゼ)で構成された透明な固い構造で,物資の透過性が大きく低下している.この構造・生理的特徴により,シストは宿主内・外においてさらされる環境変化[栄養源の枯渇,乾燥,胃酸(強酸)]に耐えることができる.
栄養体からシストへの細胞の形態変化を“シスト形成”と呼ぶ.ヒトへの感染がシストの経口摂取によって引き起こされることは前節で述べたとおりである.シスト形成は次の宿主への唯一の伝播経路であり,その阻害は感染拡大の阻止につながるため,公衆衛生上重要であり着目されてきた.しかし,シスト形成の分子機構,特に制御機構についてはいまだに解明されていない.その理由の一つとして,赤痢アメーバの培養株がシスト形成能を失っていることがあげられる.臨床分離株は,感染者の糞便から栄養体またはシストを回収し,in vitro培養へ適応できたものをさす.現在さまざまな赤痢アメーバの臨床分離株由来のin vitro培養株が解析に用いられているが,共通の特徴として,理由は不明であるがシスト形成を誘導することができない.そのためシスト形成機構の解析には,モデル生物であるEntamoeba invadensを用いた解析が主となっている.E. invadensは爬虫類に感染する赤痢アメーバの近縁種で,26°Cで培養を行う(赤痢アメーバの培養は37°C).シスト形成は,栄養体を低浸透圧・低グルコースの培地で培養することで誘導され,72時間後に成熟シストを得ることができる.本稿で述べるシスト形成機構に関する知見はすべてE. invadensを用いたものである.
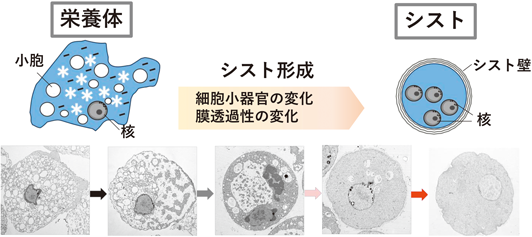
シスト形成過程では,短時間内に膜構造や細胞小器官の劇的な変化が観察される(図2)1).栄養体期の原虫は,細胞内小胞輸送活性が高く,多くの代謝経路が活性化状態にある.一方のシスト期の原虫は,動きがなく,細胞内膜構造がほとんどみられない.シスト形成に伴う膜構造の劇的な変化は,脂質代謝の関与が大きいと考えられるが,その詳細はほとんど解明されていなかった.
近年のシスト形成に伴う脂質組成の変化の網羅的解析により,脂質代謝のダイナミックな変化が明らかにされた2).ノンターゲティングリピドミクスの結果,栄養体からシストへの細胞形態の大きな変化にもかかわらず,グリセロリン脂質[ホスファチジルコリン(PtdCho),ホスファチジルエタノールアミン(PtdEtn),ホスファチジルセリン(PtdSer),ホスファチジルイノシトール(PtdIns)]の量的な変動は小さかった.一方変動が大きかったものとしては,セラミド(Cer),リゾホスファチジルセリン(LysoPtdSer),リゾホスファチジルイノシトール(LysoPtdIns)が増加,リゾホスファチジルコリン(LysoPtdCho)は減少していた.Cerはスフィンゴ脂質へと代謝されるが,モデル生物であるEntamoeba invadensの場合,スフィンゴリン脂質として,セラミドホスホエタノールアミン(CPE),スフィンゴミエリン(SM),セラミドホスホイノシトール(CPI)が検出されている.その中ではシスト形成に伴い,CPIのみが増加しており,SM, CPEの変動はほとんどなかった.
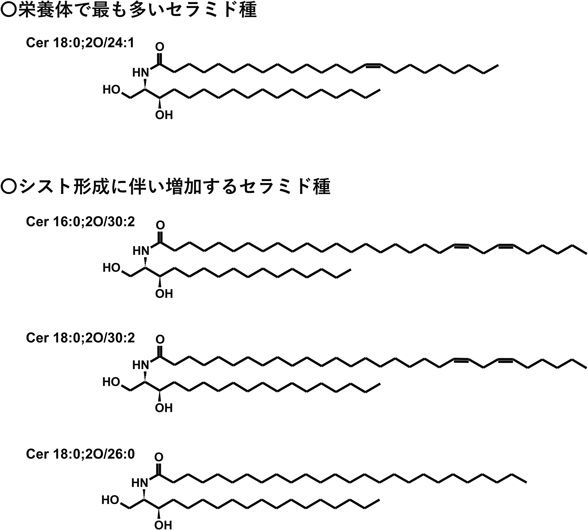
E. invadensのセラミドの特徴は,ジヒドロセラミドが主であること,また,アシル基が超長鎖(炭素数が26以上)のものが多いことである2).具体的には,Cer 18:0;2O/26:0, Cer 18:0;2O/28:0, Cer 18:0;2O/30:1, Cer 16:0;2O/30:2, Cer 18:0;2O/30:2といったセラミド種である(図3).さらに,これらの超長鎖ジヒドロセラミドの量は,シスト形成が誘導された細胞で特異的に増加する.その急増は,シスト形成誘導16時間後にみられ,最終的に完成した成熟シスト内の全セラミド量の1/3に達する.一方,誘導前の栄養体期の原虫内には,炭素数26以上のものはほとんど検出されず,Cer 18:0;2O/24:1が全セラミド量の60%以上を占め,次いで,炭素数24以下のCer 18:0;2O/24:0, Cer 19:0;2O/24:1, Cer 18:0;2O/16:0, Cer 17:0;2O/24:1が検出された2).
赤痢アメーバの解析は栄養体に限られる(シスト形成能を失っているため)が,E. invadensの栄養体と同様ジヒドロセラミドの量が多く,炭素数24以下のものが主であった.ただし微量ではあるが,炭素数26以上の超長鎖ジヒドロセラミドも検出されている2).次節に示すセラミド合成酵素の強制発現によって,超長鎖ジヒドロセラミドの合成量を亢進させることができたことから,E. invadens同様,赤痢アメーバのシスト形成においても超長鎖ジヒドロセラミドが増加することが十分推測される.
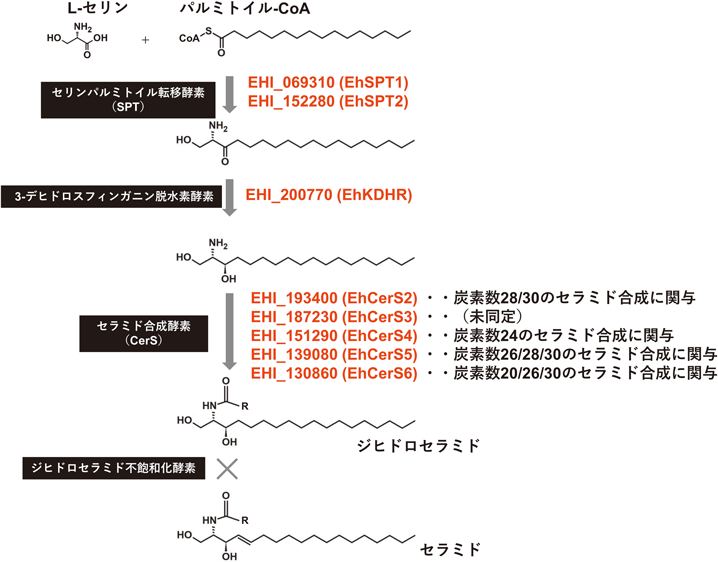
セラミドの新規合成は,真核生物に広く保存されている経路であり,4ステップで構成されている.赤痢アメーバおよびE. invadensのゲノム上には,4ステップのうち,1–3ステップまでを触媒する酵素の遺伝子が存在する.4ステップ目を触媒するジヒドロセラミド不飽和化酵素の遺伝子は存在しない(図4).このことは,ジヒドロセラミドをセラミドにする酵素を欠くことを示し,赤痢アメーバおよびE. invadensのリピドミクスにおいてジヒドロセラミドが主として検出される結果と一致する.
一般にセラミドのアシル基の多様性は,第3ステップを触媒する酵素であるセラミド合成酵素(CerS)によって形成される.赤痢アメーバは5個(CerS2–6遺伝子),E. invadensは6個(CerS1–6遺伝子)のCerS遺伝子がそれぞれのゲノム上に存在する.なお,赤痢アメーバはE. invadens CerS1遺伝子のオルソログを保持していない2).赤痢アメーバにおいてもこれらのCerSアイソザイムがセラミドのアシル基の多様性創出に関与していることが,強制発現株の脂質組成解析により明らかになった.具体的には,CerS2が炭素数28, 30のセラミドの合成,CerS4が炭素数24のセラミドの合成,CerS5が炭素数26, 28, 30のセラミドの合成,CerS6が炭素数20, 26, 30の合成に関与していた(図4)2).このように赤痢アメーバの5個のCerSアイソザイムは,その基質特異性において重複がみられる.例外はCerS4で,CerS4遺伝子発現抑制株では,C24:1を含むセラミド(Cer 18:0;2O/24:1, Cer 17:0;2O/24:1, Cer 19:0;2O/24:1)だけが減少していた2).Cer 18:0;2O/24:1は,赤痢アメーバの栄養体において最も量の多いセラミドであり,そちらを1遺伝子産物で特異的に合成していることが明らかとなった.ただし,CerS4遺伝子発現抑制株では,Cer 18:0;2O/24:1が劇的に減少し,代わりにCer 18:0;2O/26:0, Cer 18:0;2O/24:0といった鎖長や不飽和度が異なるセラミドを主に含む赤痢アメーバの栄養体となっているが,野生株とCerS4遺伝子発現抑制株の増殖に差はみられず,Cer 18:0;2O/24:1そのもの,またCerS4遺伝子が細胞増殖に必須な脂質種および遺伝子ではないということも同時に明らかになった.CerS3遺伝子発現抑制株は顕著な増殖阻害を示し,細胞株の樹立ができなかった.また,CerS3遺伝子強制発現株は各セラミド種の量の変化は観察されず,CerS3が担う合成産物は不明であるが,赤痢アメーバの栄養体増殖に必須なセラミドの合成を担っていると考えられる2).
6. 赤痢アメーバ生活環維持におけるセラミド合成経路の重要性
赤痢アメーバ栄養体の増殖は,セラミド新規合成経路第一酵素であるセリンパルミトイル転移酵素(serine palmitoyltransferase:SPT)の阻害剤(ミリオシン)に対して高い感受性を示し,その50%阻害濃度(IC50)は46.7±11.5 nMであった.また,E. invadensのシスト形成も高い感受性を示し,そのIC50は68.6±12.5 nMであった2).ここで特筆すべきは,ミリオシン処理した細胞のノンターゲティングリピドミクスにより,そのシスト形成時に,長鎖セラミドの量に変化がないのに対して,超長鎖ジヒドロセラミドの量が激減していることが明らかになったことである.さらに,ミリオシン処理した細胞を光学顕微鏡下で観察すると,シスト壁は正常に形成されているが膜の透過性は低下していない像が観察された.通常のシスト形成過程において,シスト壁の合成に付随して膜の透過性低下が観察される.処理細胞を電子顕微鏡で観察すると,正常細胞にはみられない細胞膜の分断と,細胞質成分の細胞膜とシスト壁の間への流出が観察された2).これらのことから,シスト形成に伴い新規合成される超長鎖ジヒドロセラミドは,シストの膜透過性低下を担う脂質であることが明らかとなった.シストの物質透過性の低下は,シスト壁の構造タンパク質によって形成されるとされていた3).今回の発見は,物質透過性の低下におけるシスト壁の関与を否定するものではないが,追加として,脂質(おそらく膜構造の変化)による膜の透過性低下も大きく貢献していることを示した.シスト壁の構造タンパク質による物質の透過性低下と超長鎖ジヒドロセラミドによる膜の透過性低下の関係性は,シスト形成の分子機構解析における今後の重要な課題の一つといえる.
ミリオシンを用いた各種実験結果をまとめると,赤痢アメーバの生活環維持において,セラミドの新規合成が必須であることが明らかとなった.ミリオシンは,宿主であるヒトの,SPTに対しても高い阻害作用を示すため,選択毒性には優れておらず,新規アメーバ症治療薬としてのリード化合物とはならないであろう.しかし,赤痢アメーバの生活環を構成する栄養体期とシスト期の両方において,セラミドの新規合成が不可欠であることを実験的に示せたことにより,この経路の薬剤標的としての有用性は示された.今後,組換え酵素を用いた酵素活性を指標とした阻害剤のスクリーニングから新規アメーバ症治療薬創生につながるリード探索への展開が大いに期待される.
7. シスト形成に伴う超長鎖ジヒドロセラミド合成を制御する分子として同定されたコレステロール硫酸(CS)
CSは,赤痢アメーバ自身がコレステロールを硫酸化することにより合成する含硫脂質の一種であり,赤痢アメーバおよびE. invadensにおいて,その細胞内濃度は非常に高く維持されている.赤痢アメーバおよびE. invadensは,コレステロール新規合成経路を欠いていることから,宿主体内(=赤痢アメーバ細胞外)から取り込んだコレステロールを前駆体として利用している.E. invadensの栄養体期の細胞内CS濃度は243±37 µMであり,シスト細胞内のCS濃度は539±37 µMであった4).ヒト血清中の濃度が3.7–6.9 µMであることを考えると非常に高濃度である.赤痢アメーバのゲノム上には,硫酸化を触媒する硫酸基転移酵素遺伝子が10個(SULT1–10遺伝子)存在する.そのうちCS合成を担うのはSULT6遺伝子である5).
SULT6遺伝子発現抑制赤痢アメーバ株の栄養体増殖は野生株と差がないことから,栄養体期の細胞増殖にCSは必要ない.一方,E. invadensシスト形成時にみられるSULT6遺伝子の転写産物の上昇と一致したCS蓄積量の亢進が観察される.また,シスト形成誘導時のCS添加は,濃度依存的なシスト形成数の増加がみられた5).その逆となる各種阻害剤(硫酸活性化の第一酵素ATP sulfurylase阻害剤のchlorate,硫酸活性化の第二酵素adenylyl-sulfate(APS)キナーゼ阻害剤のauranofin, A-D-11, A-H-11)処理により,濃度依存的なシスト形成数の減少がみられた5, 6).以上のことから,CSはシスト形成に必須な含硫脂質であることが示された.そして近年,シスト形成におけるCSの機能の一つとしてセラミド合成促進の制御因子であることが報告された(図5).具体的には,シスト形成誘導に必須な血清をCSに置き換えた無血清培地を用いて栄養体を誘導すると,CS濃度依存的に膜透過性が低下した.この細胞では,セラミド新規合成促進による超長鎖ジヒドロセラミドの蓄積に伴い細胞膜の透過性低下が生じた4).
8. 超長鎖ジヒドロセラミドのアシル基の供給を担う脂肪酸伸長サイクル
赤痢アメーバは,脂肪酸新規合成経路を持たないことから,必要な脂肪酸は宿主からの取り込みに依存している7).また,炭素数26以上の超長鎖脂肪酸は宿主であるヒトでは限られた量しか合成されていない8).したがって,赤痢アメーバ生活環維持に重要なセラミドのアシル基は宿主において主たる脂肪酸[パルミチン酸(C16:0),ステアリン酸(C18:0),オレイン酸(C18:1),リノール酸(C18:2)]を前駆体に赤痢アメーバ自身が合成していると考えらえる.その合成経路は,一般にグリセロリン脂質やセラミドに取り込まれるアシル基の伸長を担う脂肪酸伸長サイクルであると考えられる.赤痢アメーバのゲノム上には,4ステップで構成される脂肪酸伸長サイクル(脂肪酸の活性型であるアシルCoAを基質として2炭素ユニットずつ伸長させるサイクル)の各ステップを触媒する酵素遺伝子はすべて存在している2, 9).赤痢アメーバのリピドミクスの結果から,超長鎖アシル基の組成は,飽和,1価・2価不飽和のものが中心で,多価不飽和のものはほとんど検出されない2).これは,ゲノム上に脂肪酸不飽和化酵素の遺伝子を持たない赤痢アメーバは7),脂肪酸伸長サイクルを中心にして,飽和度の違いではなく,炭素数の違いでアシル基の多様性を形成していると考えられる.
赤痢アメーバにおいて,超長鎖アシル基はセラミドだけに検出されるわけではない.ノンターゲティングリピドミクスにより,グリセロリン脂質にも同様に検出された.ただし,すべてのグリセロリン脂質に超長鎖アシル基が均一に検出されるのではない.PtdEtnでは8割以上のPtdEtn脂質種に検出された.PtdInsの場合は,長鎖アシル基(C12–14)と超長鎖アシル基の組合わせを持つものが全PtdIns中の9割以上,PtdSerの場合は,中鎖アシル基(C8–10)と超長鎖アシル基の組合わせを持つものが全PtdSerの9割以上であった.一方,PtdChoとしては,超長鎖アシル基を持つものは全PtdChoの2%以下であった2, 10).これらの超長鎖アシル基を持つグリセロリン脂質は,主に栄養体期に合成される.つまり,超長鎖アシル基は栄養体期にはグリセロリン脂質合成に,シスト期にはセラミド合成に優先的に利用されているといえる.以上のことから,赤痢アメーバにおける栄養体期の超長鎖グリセロリン脂質合成およびシスト期の超長鎖ジヒドロセラミド合成の制御機構,そして脂肪酸伸長サイクルとの機能的リンクが,今後の重要な課題である.
セラミドはスフィンゴ脂質へと代謝される.赤痢アメーバの場合,ノンターゲティングリピドミクスによりスフィンゴ脂質としてCPEやSMが検出されている.一方近縁種のE. invadensの場合,CPE, SMに加え,CPIが検出された2).両種の栄養体を同時に調整し,解析に供した場合もE. invadensのみで検出されることから,種特異性と考えられる.赤痢アメーバでは,CPIの合成経路がない可能性,もしくは,合成経路があったとしても,合成量が検出限界以下であると考えられる.CPIについてはその機能解析はほとんど進んでいないため,SMと比べ情報量が少ない.そのため赤痢アメーバとE. invadens間の種特異性について,その意義は不明である.検出されたCPE, SM, (E.invadensの場合はCPIも)すべての種のアシル基の組成は,セラミドと一致しており2),セラミドを前駆体として合成されていると考えられる.シスト形成に伴って増加するのは,CPE, CPI, SMのうちCPIのみであり,その中でも超長鎖アシル基を含むCPIが顕著に増加している2).超長鎖CPIの機能について,今後の解析が興味深い.
CPEおよびCPIは無脊椎動物,植物,単細胞真核生物,一部の細菌で合成が報告されているスフィンゴ脂質であるが,ヒトを含めた脊椎動物ではほとんど存在しない(ヒトではSMが主である)11).寄生原虫の中でも,トキソプラズマ症を引き起こすToxoplasma gondii,眠り病を引き起こすTrypanosoma brucei,膣トリコモナス症を引き起こすTrichomonas vaginalisで報告があり,宿主であるヒトのそれらとの違いから,CPEおよびCPIの合成経路が治療薬標的として有用である可能性,および原虫の検出の指標としての診断への応用が検討されている11–13).今後は,赤痢アメーバも含めた寄生原虫症に対して,CPEおよびCPIの合成経路を薬剤標的とした研究課題が展開されていくことが十分に期待できる.
赤痢アメーバのシスト形成は,緻密に制御された機構によって進行,完結する.特に膜構造の劇的な変化は,電子顕微鏡解析により古くから着目されており,脂質代謝の重要性は認識されてはいたが,知見は不十分であった.近年発表された一連の研究により,超長鎖ジヒドロセラミドおよびCSがシスト形成の鍵分子の一つとして機能することが示され,これまで未解明であった膜透過性の低下の分子機構の解明の一端を担った(図5).膜透過性低下は宿主内外での耐性獲得の重要な機構であり,宿主間伝播を成立させる寄生適応戦略の一つとして重要な課題が提供されたといえる.
もちろん,超長鎖ジヒドロセラミド・CSだけで,シスト形成に伴う細胞構造の劇的な変化を説明できるわけではない.シスト形成に伴い量を大きく変動する脂質種として,リゾリン脂質を見いだしていることに加え,グリセロリン脂質種についても,鎖長によって大きく変動する脂質種を見いだしている.これらの脂質種の生理的機能の解析を通して,いまだ解明されていない貪食胞・細胞小器官の消失などシスト形成に伴う顕著な形態・生理変化の分子機構が解明されていくことが期待できる.今後は,緻密に制御されているシスト形成の分子機構の理解を深めることにより赤痢アメーバの寄生適応戦略の解明につなげていければと考えている.
引用文献References
1) Mousa, E.A.A., Sakaguchi, M., Nakamura, R., Abdella, O.H., Yoshida, H., Hamano, S., & Mi-Ichi, F. (2020) The dynamics of ultrastructural changes during Entamoeba invadens encystation. Parasitology, 147, 1305–1312.
2) Mi-Ichi, F., Ikeda, K., Tsugawa, H., Deloer, S., Yoshida, H., & Arita, M. (2021) Stage-specific de novo synthesis of very-long-chain dihydroceramides confers dormancy to Entamoeba parasites. MSphere, 6, e0017422.
3) Chatterjee, A., Ghosh, S.K., Jang, K., Bullitt, E., Moore, L., Robbins, P.W., & Samuelson, J. (2009) Evidence for a “wattle and daub” model of the cyst wall of entamoeba. PLoS Pathog., 5, e1000498.
4) Mi-Ichi, F., Tsugawa, H., Arita, M., & Yoshida, H. (2022) Pleiotropic roles of cholesteryl sulfate during Entamoeba encystation: Involvement in cell rounding and development of membrane impermeability. MSphere, 7, e0029922.
5) Mi-ichi, F., Miyamoto, T., Takao, S., Jeelani, G., Hashimoto, T., Hara, H., Nozaki, T., & Yoshida, H. (2015) Entamoeba mitosomes play an important role in encystation by association with cholesteryl sulfate synthesis. Proc. Natl. Acad. Sci. USA, 112, E2884–E2890.
6) Mi-Ichi, F., Ishikawa, T., Tam, V.K., Deloer, S., Hamano, S., Hamada, T., & Yoshida, H. (2019) Characterization of Entamoeba histolytica adenosine 5′-phosphosulfate (APS) kinase; Validation as a target and provision of leads for the development of new drugs against amoebiasis. PLoS Negl. Trop. Dis., 13, e0007633.
7) Clark, C.G., Alsmark, U.C., Tazreiter, M., Saito-Nakano, Y., Ali, V., Marion, S., Weber, C., Mukherjee, C., Bruchhaus, I., Tannich, E., et al. (2007) Structure and content of the Entamoeba histolytica genome. Adv. Parasitol., 65, 51–190.
8) Tsugawa, H., Ikeda, K., Takahashi, M., Satoh, A., Mori, Y., Uchino, H., Okahashi, N., Yamada, Y., Tada, I., Bonini, P., et al. (2020) A lipidome atlas in MS-DIAL 4. Nat. Biotechnol., 38, 1159–1163.
9) Mi-Ichi, F., Miyamoto, T., & Yoshida, H. (2017) Uniqueness of Entamoeba sulfur metabolism: Sulfolipid metabolism that plays pleiotropic roles in the parasitic life cycle. Mol. Microbiol., 106, 479–491.
10) Mi-Ichi, F., Tsugawa, H., Yoshida, H., & Arita, M. (2023) Unique features of Entamoeba histolytica glycerophospholipid metabolism; has the E. histolytica lipid metabolism network evolved through gene loss and gain to enable parasitic life cycle adaptation? MSphere, 8, e0017423.
11) Panevska, A., Skočaj, M., Križaj, I., Maček, P., & Sepčić, K. (2019) Ceramide phosphoethanolamine, an enigmatic cellular membrane sphingolipid. Biochim. Biophys. Acta Biomembr., 1861, 1284–1292.
12) Sutterwala, S.S., Hsu, F.F., Sevova, E.S., Schwartz, K.J., Zhang, K., Key, P., Turk, J., Beverley, S.M., & Bangs, J.D. (2008) Developmentally regulated sphingolipid synthesis in African trypanosomes. Mol. Microbiol., 70, 281–296.
13) Welti, R., Mui, E., Sparks, A., Wernimont, S., Isaac, G., Kirisits, M., Roth, M., Roberts, C.W., Botté, C., Maréchal, E., et al. (2007) Lipidomic analysis of Toxoplasma gondii reveals unusual polar lipids. Biochemistry, 46, 13882–13890.
著者紹介Author Profile
 見市 文香(みいち ふみか)
見市 文香(みいち ふみか)長崎大学熱帯医学研究所共同研究室 教授.長崎大学大学院医歯薬学総合研究科原虫生化学分野 教授.博士(薬学,東京大学)
略歴2000年東京大学薬学部卒.05年同大学院薬学系研究科博士課程修了.大阪大学,群馬大学,国立感染症研究所で博士研究員.10年2月より佐賀大学医学部分子生命科学講座免疫学分野助教.22年4月より現職.
研究テーマと抱負赤痢アメーバを研究対象として 〇脂質代謝(セラミド代謝,含硫脂質代謝)の全容解明 〇シスト形成の分子機構の全容解明 がテーマです.寄生虫が織り成す現象の分子機構を1つずつ紐解き,研究を重ねていく事が抱負です.
ウェブサイトhttps://www.tm.nagasaki-u.ac.jp/central-lab/
趣味娘と女子旅,城,石橋,鉄道,料理,GENERATIONS,深海魚.