2. 食品に含まれるスフィンゴ脂質の種類と化学構造の特徴
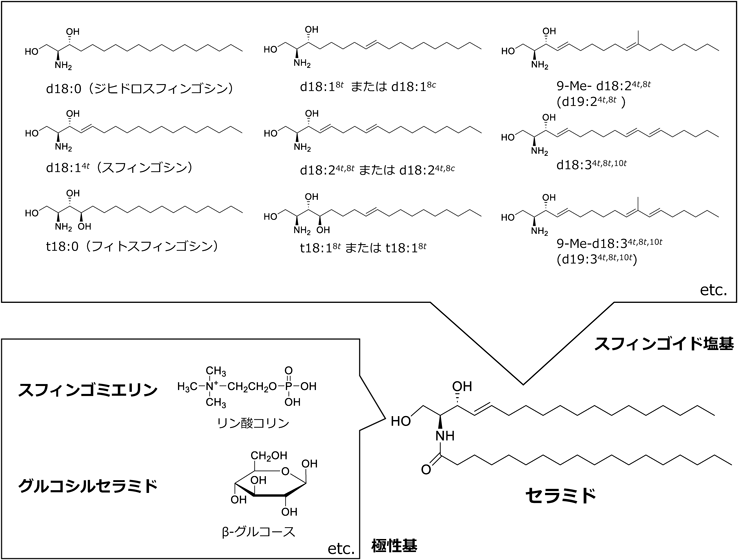
複合スフィンゴ脂質の骨格成分であるセラミドは,スフィンゴイド塩基と呼ばれる長鎖アミノアルコールと脂肪酸がアミド結合した構造を有する.脂肪酸ほどではないものの,スフィンゴイド塩基にも,炭素数や二重結合数,水酸基数などが異なる多彩な分子種が自然界に存在し,生物種によってその構造や組成に特徴があることがよく知られている(図1).したがって,食品もまた由来となる生物種(農畜水産物)によって,異なる特徴を持ったスフィンゴ脂質が含まれていることになる.哺乳動物を含む脊椎動物が主体である畜産物(いわゆる動物性食品ともいえる)に含まれるスフィンゴイド塩基は,炭素数18でジヒドロキシ型のいわゆるスフィンゴシン(2-アミノ-4-オクタデセン-1,3-ジオール,d18:14t)が主要であり,飽和型のスフィンガニン(ジヒドロスフィンゴシン,d18:0)とトリヒドロキシ型のフィトスフィンゴシン(t18:0)も存在し,その組成はヒトとも類似している.一方,農産物は高等植物が主体であるが(いわゆる植物性食品),8位に不飽和結合を持つものが主要であり,ジヒドロキシ型の8-モノエン(8-スフィンゲニン,d18:18tまたはd18:18c)や4,8-ジエン(4,8-スフィンガジエニン,d18:24t,8tまたはd18:24t,8c),トリヒドロキシ型の8-モノエン(4-ヒドロキシ-8-スフィンゲニン,t18:18tまたはt18:18c)といった特有のスフィンゴイド塩基が存在し,その組成は植物種や組織,脂質クラスの違い(極性基の違い)にも依存する2)(石川の稿を参照).またこのとき,4位の不飽和結合はtrans型のみであるが,8位の不飽和結合にはcisとtransのどちらの異性体も存在することから,畜産物に比べると多様な構造を有している.さらに特殊なスフィンゴイド塩基構造として,キノコや酵母などの真菌類に含まれる9-メチル型(9-メチル-4,8-スフィンガジエニン,9-Me-d18:24t,8t)や3),イカやタコといった軟体動物など海産無脊椎動物からはトリエン型スフィンゴイド塩基も確認されている4, 5).さらに筆者らは,高等植物のグルコシルセラミドにもトリエン型が存在することを見いだしている6).
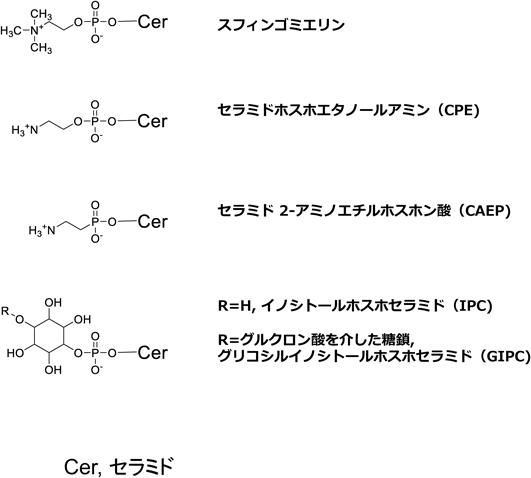
極性基の結合していないセラミドは,自然界での存在形態としては微量であり,通常はセラミドのC-1位の水酸基に極性基が結合した複合スフィンゴ脂質が主要である.複合スフィンゴ脂質は,極性基にリン酸コリンが含まれるスフィンゴミエリンなどのスフィンゴリン脂質と,糖鎖が結合したスフィンゴ糖脂質(グルコシルセラミド,ガラクトシルセラミド,ガングリオシドなど)に大別できる.また,単糖(グルコースまたはガラクトース)が結合したセラミドは,古くからセレブロシド(グルコセレブロシドまたはガラクトセレブロシド)とも呼ばれている.ガングリオシドは,シアル酸(N-アセチルノイラミン酸)を含む構成糖を持つスフィンゴ糖脂質の総称であり,脳や神経組織に多く存在し,複雑な糖鎖を有する分子が存在する(稲森らの稿を参照).また,イカ,タコ,貝類など軟体動物には,リン酸基に類似しているが,炭素とリン原子が共有結合している点で異なるスフィンゴホスホノ脂質も相当量含まれており,セラミドアミノエチルホスホン酸(ceramide 2-aminoethylphosphonate:CAEP)が主要なものとして知られている7)(図2).したがって,水産物には特徴的にCAEPが含まれていることになる.加えて,一部の無脊椎動物や微生物には,リン酸エタノールアミンが結合したセラミドホスホエタノールアミン(CPE)を持つものもあり,哺乳動物にも極微量含まれていることが知られている8).
さらに,これまで食品成分としてほとんど注目されてこなかったが,真菌類や高等植物には,ホスホイノシトール含有スフィンゴ脂質の存在も知られている.これらは,イノシトールホスホセラミド(inositolphosphoceramide:IPC)を基本骨格とするスフィンゴリン脂質であり,さらに糖鎖が結合した場合には,グリコシルイノシトールホスホセラミド(glycosylinositolphosphoceramide:GIPC)と呼ばれる9).真菌類にはIPCに加えて,マンノースが付加したマンノシルイノシトールホスホセラミド(mannosylinositolphosphoceramide:MIPC)やMIPCにさらにリン酸イノシトールが付加したM(IP)2Cなども存在する10)(谷の稿を参照).また,高等植物のGIPCは,通常イノシトールにグルクロン酸が結合するが,さらにグルコサミンあるいはN-アセチルグルコサミンの結合したヘキソサミン型糖鎖を持つものと,マンノースを主成分とするヘキソース型糖鎖を持つものに大別される.その化学構造から,スフィンゴリン糖脂質ともいえるが,その組成や分布は種や組織によって異なることも知られている11).
動物性食品中の複合スフィンゴ脂質としては,牛乳,卵,畜肉などの畜産物に含まれるスフィンゴミエリンが主要であり,グルコシルセラミドやガラクトシルセラミドなどのスフィンゴ糖脂質も含まれる.たとえば,牛乳100 mL中にはスフィンゴミエリン4–12 mgとセレブロシド0.6–1.1 mg(グルコシルセラミドとガラクトシルセラミドを含む)に加えて,ラクトシルセラミド0.7–1.5 mg,さらにはガングリオシド数百μg–1 mgが含まれており,畜肉では25–40 mg/100 g,卵では80–170 mg/100 g程度のスフィンゴミエリンがそれぞれ含まれている12).
水産物については,サケ,ニシン,タラ,カレイなどの海産魚類に含まれるスフィンゴミエリンが6–14 mg/100 g程度であり,畜産物よりも低い値が示されている13).魚類以外の無脊椎動物では,ロブスターのスフィンゴミエリン含有量が約50 mg/100 gであり14),イカの場合には,CAEP含有量がおよそ50–280 mg/100 gであるが,スフィンゴミエリン含有量もそれに匹敵する15).貝類のCAEP含有量は40–70 mg/100 g程度であり14),スフィンゴミエリンを含むものと含まないものがある16).
植物性食品では,グルコシルセラミドが主要なものであり,気候や栽培地域,品種による影響を受ける.穀類や豆類のグルコシルセラミド含有量は,他の農産物に比べて比較的多く,10–40 mg/100 gであるものの,全般的に植物の脂質含量は低いこともあり,スフィンゴ脂質含有量も1–10 mg/100 g程度である17).
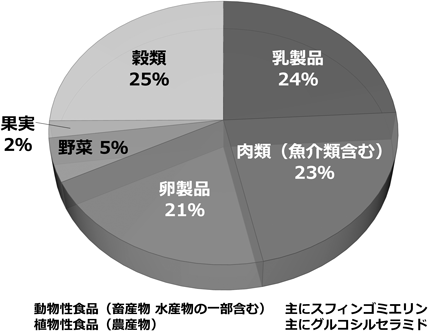
総スフィンゴ脂質の摂取量については,アメリカ人の場合,一日あたり300–400 mgと算出されており,食品全体の摂取量に対して0.01–0.02%程度に相当する(図3)12).このとき,畜産物由来スフィンゴミエリンが総スフィンゴ脂質のほぼ2/3を占めており,そのなかでは,乳製品,肉類(魚介類を含む),卵製品がほぼ同程度の寄与率となる.日本人の場合では,そもそも食事の摂取量が少ないため,アメリカ人より低い値が見積もられている.たとえば,食事を直接分析した値から(高齢者施設と自衛隊の食事),一日あたりスフィンゴミエリン50–220 mg,グルコシルセラミド60–80 mg程度であることが報告されており,摂取カロリーや食事メニューの違いに強く依存する18).また,筆者らの測定値に基づき,植物性食品からのグルコシルセラミド摂取量を算出すると,一日あたり約50 mgと見積もられる17).なかでも小麦は,比較的消費量が多いことから,我々の食生活の中における植物スフィンゴ脂質の供給源としての寄与率が高いものと推定される.加えて,特に日本人の場合には,水産物からの寄与も無視できないと予想される.
スフィンゴミエリンやグルコシルセラミドのような有機溶媒を使った常法で抽出できる脂溶性スフィンゴ脂質については,前述のように食品素材ごとの含有量や,それらの消費量に基づいた摂取量の算出が試みられている.その一方で,水溶性スフィンゴ脂質ともいえる糖鎖の長いスフィンゴ糖脂質は,定量的な抽出や精製物を得ることが困難であり,食品成分としての評価があまり進んでいない.たとえば,動物性食品に含まれるガングリオシドについては,カナダ人の場合で,シアル酸量として一日あたり平均100 µg以下(概算でガングリオシド340 µg程度)と報告されているものの19),農産物のGIPCについては,ほとんど情報がない.しかしながら,植物研究のモデルとしてよく用いられるシロイヌナズナの葉部では,GIPCは総スフィンゴ脂質の64%に相当し,むしろ主要な複合スフィンゴ脂質と考えられる20).最近の報告では,スフィンゴイド塩基をターゲットとした間接的な定量法を用いて,農産物の場合には,有機溶媒で抽出できない水溶性スフィンゴ脂質の存在割合が,総スフィンゴ脂質の半分以上を占めることも示されている21).一方で,IPCは酵母などの真菌類に含まれていることから,発酵食品などにも含まれることが予想されるが,食品における定量的な解析例は見当たらない.
4. 食品として摂取されたスフィンゴ脂質の消化と吸収,代謝変換
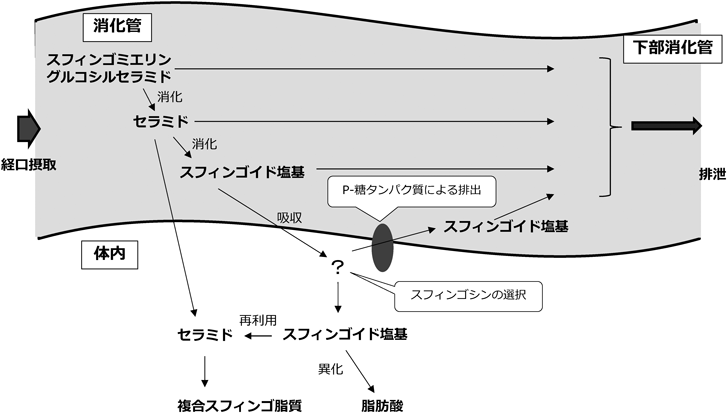
経口摂取された複合スフィンゴ脂質は,消化管管腔で極性基(リン酸コリンや糖),脂肪酸,スフィンゴイド塩基といった構成単位に加水分解(消化)され,小腸上皮細胞から体内へと吸収されることが示されている(図4)1).しかしながら,いわゆる油脂であるトリアシルグリセロールなどのグリセロ脂質と比較すると,スフィンゴ脂質は消化を受けにくく,ゆえに吸収されにくいものと考えられる.
スフィンゴミエリンは,小腸上皮に発現しているアルカリ性スフィンゴミエリナーゼによって,セラミドとリン酸コリンに加水分解される22, 23).アルカリ性スフィンゴミエリナーゼは空腸部の微絨毛に強く発現しており,一次胆汁酸によって活性化することや,トリプシンによって活性型として消化管腔内に切り出されることなどから,スフィンゴミエリンの消化は管腔内で起こると考えられている24).リン脂質と類似したホスホノ脂質であるCAEPについても,スフィンゴミエリンと同様に,消化管腔内で極性基部分が加水分解されることが動物実験で確認されている25).このとき,スフィンゴミエリンとは異なり,中性pH下でも速やかに分解されてセラミドを生じることから,アルカリ性スフィンゴミエリナーゼ以外の消化酵素の関与にも興味が持たれるが,現時点でその詳細は不明である.
経口摂取されたグルコシルセラミドもまた,セラミドとグルコースに分解される.小腸粘膜にはグルコシルセラミダーゼ活性が存在し,小腸上皮細胞の微絨毛膜上に存在する二糖類加水分解酵素複合体の一つであるラクターゼ・フロリジン加水分解酵素のフロリジン加水分解活性部位が関わることが示されており,ガラクトシルセラミドもほぼ同様に分解できる26, 27).また,哺乳動物とはスフィンゴイド塩基構造が異なる高等植物由来グルコシルセラミドや海産無脊椎動物由来セラミドモノヘキソシド(糖の同定ができていないため)についても,スフィンゴイド塩基の構造には依存せず,ほぼ同様に消化されることが動物実験で確認されている28, 29).
このように複合スフィンゴ脂質の消化で生じた,あるいは直接摂取されたセラミドは,中性セラミダーゼによって,さらにスフィンゴイド塩基と遊離脂肪酸に分解される.中性セラミダーゼは,Ash2遺伝子産物であることが遺伝子欠損モデルマウスの解析から同定されており,十二指腸,空腸,回腸といった小腸の広範囲で発現している30).胆汁酸の共存による活性の増強や,小腸粘膜上皮細胞で発現していること,生理的な胆汁酸濃度で粘膜から抽出できること,トリプシンやキモトリプシンなどのタンパク質分解酵素に対して耐性を示すことなどから,セラミドの消化も消化管腔内で起こることものと予想される31, 32).
経口摂取されたスフィンゴ脂質は消化を受けて,構成要素として吸収される.動物細胞に主要なスフィンゴシンの場合,小腸上皮細胞に取り込まれた後,その一部は再びスフィンゴ脂質の構成要素として利用されるが,大部分はパルミトイルCoAを介してグリセロ脂質に代謝されて体内に吸収されることが古くから知られている33, 34).このような外因性のスフィンゴシンの異化経路の初発反応は,スフィンゴシンキナーゼによるリン酸化反応である.生じたスフィンゴシン1-リン酸は,スフィンゴシン1-リン酸リアーゼによって,ホスホエタノールアミンとアルデヒド(トランス-2-ヘキサデセナール)に開裂される24)(木原の稿を参照).このとき生じたトランス-2-ヘキサデセナールはトランス-2-ヘキサデセノイルCoAへ変換された後,飽和化(還元)されてパルミトイルCoAとなり,そのままあるいは伸長や不飽和化された後にトリアシルグリセロールやグリセロリン脂質のアシル鎖として組み込まれ,カイロミクロンに取り込まれて体内へと運ばれる.このとき,小腸から吸収されたスフィンゴシンの50–70%,ジヒドロスフィンゴシン(スフィンガニン)の約90%は,脂肪酸に変換されると考えられる33).実際に,これらのスフィンゴシン異化に関わる酵素の発現と活性は,小腸で高いことも確認されている35, 36).なお,フィトスフィンゴシンの場合は,同様の反応を受けるものの,最終的には炭素数の少ないペンタデカン酸(C15:0)へと変換されることが証明されている37).
食品スフィンゴ脂質の吸収率は,グリセロ脂質などと比べてきわめて低く,たとえばスフィンゴミエリンの場合,経口投与24時間の吸収率は,脂肪酸部分60%程度,スフィンゴシン部分では10%に満たないことが動物実験で示されている33).グルコシルセラミドを用いた同様の試験の場合では,脂肪酸部分で20–40%程度,スフィンゴシン部分で3–4%と報告されている34).このように低い吸収率の理由の一つとしては,消化を受けにくいことがあげられる.スフィンゴミエリン経口投与によって,90分後には投与量の12%相当が大腸にまで到達することや,経口投与したスフィンゴミエリンの33–45%が糞中に排泄されることも報告されている38, 39).このとき,50%以上が未分解のスフィンゴミエリンであり,セラミドやスフィンゴシンも検出されている.ヒト腸内細菌やラット盲腸内容物にもグルコシルセラミダーゼ活性が認められていることから,下部消化管に達した未分解のスフィンゴ脂質の一部は,腸内細菌によって分解されることも推測される28, 40).
高等植物に特有のスフィンゴイド塩基は,スフィンゴシンと比べると小腸上皮細胞から吸収されにくいようである.植物に主要な4,8-スフィンガジエニンのラットリンパ液への回収率は,投与量に対して約0.2%程度であり,スフィンゴシンと比べても半分以下である41).海産物由来のd17:1やd19:2などのスフィンゴイド塩基も,ほぼ同程度の吸収率であることが確認されている29).その理由として,P-糖タンパク質の関与が示唆されている.ヒト小腸由来Caco-2細胞を用いた検討から,スフィンゴシン以外のスフィンゴイド塩基は,薬物排出トランスポーターであるP-糖タンパク質によって,細胞外へ排出されやすいことが見いだされており42),阻害剤を用いたin vivo試験でもP-糖タンパク質の関与が確認されている43).P-糖タンパク質がスフィンゴイド塩基の不飽和結合の位置や数など微細な構造の違いを認識できる可能性は低いため,他の選択的吸収機構も密接に関わることが推測される.また,哺乳動物に主要なスフィンゴイド塩基(スフィンゴシン,スフィンガニン,フィトスフィンゴシン)は,小腸から吸収された後,大部分が脂肪酸に変換されるが,それ以外のスフィンゴイド塩基の代謝変換についてはよくわかっておらず,スフィンゴイド塩基構造の違いによる代謝の受けやすさや生じる代謝物の違いなどにも興味が持たれる.
近年の質量分析法の発展により,セラミド分子種の定量解析が可能となり,スフィンゴ脂質の吸収機構にも新しい知見が見いだされてきている.たとえば,投与したスフィンゴミエリンのセラミド部分の組成に類似したセラミド分子種がリンパ液から検出され,スフィンゴミエリンの消化によって生じたセラミド分子がそのまま小腸から吸収される可能性が示されている44).また,トリヒドロキシ型スフィンゴイド塩基が主要な構成要素である醤油粕由来セラミドを経口投与したマウスの血中では,投与したセラミド組成に酷似した分子種の増加が認められ,セラミドの一部は,消化されずに直接吸収されることが示唆されている45).
5. スフィンゴ脂質の摂取による皮膚バリア機能向上作用
角層に多く含まれているセラミドが皮膚バリア機能に深く関わっていることから,スフィンゴ脂質の経口摂取による皮膚機能への影響が注目され,さまざまな検討がなされてきている1).これまでの動物実験やヒト試験から,スフィンゴ脂質の経口摂取が皮膚バリア機能の向上に寄与することが数多く報告されている.ドライスキン様モデルマウス(HR-ADマウス)を用いた検討によれば,植物由来グルコシルセラミド(こんにゃく,トウモロコシ,パイナップル,ビートなど)46–49)や牛乳由来スフィンゴミエリン50, 51),海産物由来スフィンゴ脂質29, 52)の摂取による皮膚バリア改善作用が示されているが,これらの報告のほとんどが0.1%程度の飼料へのスフィンゴ脂質添加である.ヒト試験でも植物由来グルコシルセラミドの継続摂取により,経皮水分蒸散量の抑制と角層水分量の増加が確認されており,機能性表示食品や特定保健用食品の関与成分として用いられている.その一方で,日常的なスフィンゴ脂質の摂取量に対して,極端に少ない投与量(一日あたり0.6–1.8 mg)で効果が認められている53, 54).
皮膚への効果は,摂取させたスフィンゴ脂質の化学構造にはほとんど依存しないことから,体内で生じる共通の代謝物が効果を発揮する可能性も推定され,その解明は今後の課題といえる.前述のように食品由来スフィンゴ脂質は,その消化管吸収率がきわめて低く,表皮セラミドの化学構造とも厳密には異なるため,皮膚のセラミド供給源となる可能性は考えにくい.モデル動物を用いた実験から,スフィンゴ脂質摂取による表皮のセラミド合成酵素の発現上昇が確認されている47).さらに牛乳由来スフィンゴミエリン摂取によって,表皮ω-ヒドロキシセラミド量が増加することも見いだされており51),植物由来グルコシルセラミドやイカ由来CAEPの摂取でも,表皮ω-ヒドロキシセラミド量の増加とその合成に関わる酵素の発現上昇が確認されている52).このような内因性スフィンゴ脂質の合成促進が皮膚バリア機能向上作用の機構の一つとも推測されるが,そのトリガーとなる分子や作用機構などの詳細は不明であり,今後の解明が望まれる.
スフィンゴ脂質の食品機能については,皮膚に対する効果以外にも,大腸がん(または大腸腺腫)抑制作用55, 56)や脂質吸収抑制作用57–63),さらには運動機能改善効果64)などが報告されている.また,消化や吸収を受けにくく,下部消化管に効率的に到達することから,腸内細菌叢に影響を与える可能性も示されており,新たな機能性が明らかになることも期待される65).一方で,これまで注目されてきたスフィンゴミエリンやグルコシルセラミド以外の複合スフィンゴ脂質であるCPE, CAEP, IPC, GIPCなどについては,食品中における含有量や分子構造とその組成,ヒトにおける摂取量,消化管吸収機構と代謝,食品機能性などほとんど知られていない.さらには,農畜水産物などの素材のみならず,発酵食品や加工食品におけるスフィンゴ脂質の含有量や分子構造の変化,それに伴う機能性の変化にも大いに興味が持たれる.これらを含めた食品スフィンゴ脂質の包括的な研究の進展は,「スフィンゴ脂質栄養学(食品機能学)」と呼べる研究分野の創生へとつながることが期待される.
引用文献References
1) Sugawara, T. (2022) Sphingolipids as functional food components: benefits in skin improvement and disease prevention. J. Agric. Food Chem., 70, 9597–9609.
2) Sperling, P. & Heinz, E. (2003) Plant sphingolipids: structural diversity, biosynthesis, first genes and functions. Biochim. Biophys. Acta Mol. Cell Biol. Lipids, 1632, 1–15.
3) Takakuwa, N., Kinoshita, M., Oda, Y., & Ohnishi, M. (2002) Existence of cerebroside in Saccharomyces kluyveri and its related species. FEMS Yeast Res., 2, 533–538.
4) Ohashi, Y., Tanaka, T., Akashi, S., Morimoto, S., Kishimoto, Y., & Nagai, Y. (2000) Squid nerve sphingomyelin containing an unusual sphingoid base. J. Lipid Res., 41, 1118–1124.
5) Sugawara, T., Zaima, N., Yamamoto, A., Sakai, S., Noguchi, R., & Hirata, T. (2006) Isolation of sphingoid bases of sea cucumber cerebrosides and their cytotoxicity against human colon cancer cells. Biosci. Biotechnol. Biochem., 70, 2906–2912.
6) Sugawara, T., Duan, J., Aida, K., Tsuduki, T., & Hirata, T. (2010) Identification of glucosylceramides containing sphingatrienine in maize and rice using ion trap mass spectrometry. Lipids, 45, 451–455.
7) Mukhamedova, K.S. & Glushenkova, A.I. (2000). Chem. Nat. Compd., 36, 329–341.
8) Panevska, A., Skočaj, M., Križaj, I., Maček, P., & Sepčić, K. (2019) Ceramide phosphoethanolamine, an enigmatic cellular membrane sphingolipid. Biochim. Biophys. Acta Biomembr., 1861, 1284–1292.
9) Haslam, T.M. & Feussner, I. (2022) Diversity in sphingolipid metabolism across land plants. J. Exp. Bot., 73, 2785–2798.
10) Dickson, R.C. (2008) Thematic review series: sphingolipids. New insights into sphingolipid metabolism and function in budding yeast. J. Lipid Res., 49, 909–921.
11) 石川寿樹(2020)植物固有なスフィンゴ脂質糖鎖の多様な構造と機能.化学と生物,58, 659–666.
12) Vesper, H., Schmelz, E.M., Nikolova-Karakashian, M.N., Dillehay, D.L., Lynch, D.V., & Merrill, A.H. Jr. (1999) Sphingolipids in food and the emerging importance of sphingolipids to nutrition. J. Nutr., 129, 1239–1250.
13) Hellgren, L.I. (2001) Occurrence of bioactive sphingolipids in meat and fish products. Eur. J. Lipid Sci. Technol., 103, 661–667.
14) Simon, G. & Rouser, G. (1969) Species variations in phospholipid class distribution of organs. II. Heart and skeletal muscle. Lipids, 4, 607–614.
15) Saito, H. & Ishikawa, S. (2012) Characteristic of lipids and fatty acid compositions of the neon flying squid, Ommastrephes bartramii. J. Oleo Sci., 61, 547–564.
16) 糸乗前,北村朋典,田中理恵子,宮垣紀子,齋藤洋昭,杉田陸海(2004)アコヤガイ,Pinctada martensiiスフィンゴミエリンの長鎖塩基.滋賀大学教育学部紀要 自然科学,54, 41–48.
17) Sugawara, T. & Miyazawa, T. (1999) Separation and determination of glycolipids from edible plant sources by high-performance liquid chromatography and evaporative light-scattering detection. Lipids, 34, 1231–1237.
18) Yunoki, K., Ogawa, T., Ono, J., Miyashita, R., Aida, K., Oda, Y., & Ohnishi, M. (2008) Analysis of sphingolipid classes and their contents in meals. Biosci. Biotechnol. Biochem., 72, 222–225.
19) Pham, P.H., Duffy, T.L., Dmytrash, A.L., Lien, V.W., Thomson, A.B., & Clandinin, M.T. (2011) Estimate of dietary ganglioside intake in a group of healthy Edmontonians based on selected foods. J. Food Compos. Anal., 24, 1032–1037.
20) Markham, J.E., Li, J., Cahoon, E.B., & Jaworski, J.G. (2006) Separation and identification of major plant Sphingolipid classes from leaves. J. Biol. Chem., 281, 26684–26694.
21) Lynch, D.V. (2022) The contribution of polar sphingolipids to total sphingolipid content in food sources determined using a facile method for quantitation of long-chain bases. Food Chem., 397, 133803.
22) Duan, R.D., Bergman, T., Xu, N., Wu, J., Cheng, Y., Duan, J., Nelander, S., Palmberg, C., & Nilsson, Å. (2003) Identification of human intestinal alkaline sphingomyelinase as a novel ecto-enzyme related to the nucleotide phosphodiesterase family. J. Biol. Chem., 278, 38528–38536.
23) Wu, J., Cheng, Y., Palmberg, C., Bergman, T., Nilsson, Å., & Duan, R.D. (2005) Cloning of alkaline sphingomyelinase from rat intestinal mucosa and adjusting of the hypothetical protein XP_221184 in GenBank. Biochim. Biophys. Acta Mol. Cell Biol. Lipids, 1687, 94–102.
24) Wu, J., Liu, F., Nilsson, Å., & Duan, R.D. (2004). Am. J. Physiol., 287, G967–G973.
25) Tomonaga, N., Manabe, Y., & Sugawara, T. (2017) Digestion of Ceramide 2-aminoethylphosphonate, a Sphingolipid from the jumbo flying squid dosidicus gigas, in Mice. Lipids, 52, 353–362.
26) Leese, H.J. & Semenza, G. (1973) On the identity between the small intestinal enzymes phlorizin hydrolase and glycosylceramidase. J. Biol. Chem., 248, 8170–8173.
27) Kobayashi, T. & Suzuki, K. (1981) The glycosylceramidase in the murine intestine. Purification and substrate specificity. J. Biol. Chem., 256, 7768–7773.
28) Sugawara, T., Kinoshita, M., Ohnishi, M., Nagata, J., & Saito, M. (2003) Digestion of maize sphingolipids in rats and uptake of sphingadienine by Caco-2 cells. J. Nutr., 133, 2777–2782.
29) Duan, J., Ishida, M., Aida, K., Tsuduki, T., Zhang, J., Manabe, Y., Hirata, T., & Sugawara, T. (2016) Dietary cerebroside from Sea Cucumber (Stichopus japonicus): Absorption and effects on skin barrier and cecal short-chain fatty acids. J. Agric. Food Chem., 64, 7014–7021.
30) Kono, M., Dreier, J.L., Ellis, J.M., Allende, M.L., Kalkofen, D.N., Sanders, K.M., Bielawski, J., Bielawska, A., Hannun, Y.A., & Proia, R.L. (2006) Neutral ceramidase encoded by the Asah2 gene is essential for the intestinal degradation of sphingolipids. J. Biol. Chem., 281, 7324–7331.
31) Olsson, M., Duan, R.D., Ohlsson, L., & Nilsson, Å. (2004). Rat intestinal ceramidase: purification, properties, and physiological relevance. Am. J. Physiol., 287, G929–G937.
32) Duan, R.D., Cheng, Y., Yang, L., Ohlsson, L., & Nilsson, Å. (2001) Evidence for specific ceramidase present in the intestinal contents of rats and humans. Lipids, 36, 807–812.
33) Nilsson, Å. (1968) Metabolism of sphingomyelin in the intestinal tract of the rat. Biochim. Biophys. Acta Lipids Lipid Metab., 164, 575–584.
34) Nilsson, Å. (1969) The presence of spingomyelin- and ceramide-cleaving enzymes in the small intestinal tract. Biochim. Biophys. Acta Lipids Lipid Metab., 176, 339–347.
35) Buehrer, B.M. & Bell, R.M. (1993) Sphingosine kinase: Properties and cellular functions. Adv. Lipid Res., 26, 59–67.
36) van Veldhoven, P.P. & Mannaerts, G.P. (1993) Sphingosine-phosphate lyase. Adv. Lipid Res., 26, 69–98.
37) Kondo, N., Ohno, Y., Yamagata, M., Obara, T., Seki, N., Kitamura, T., Naganuma, T., & Kihara, A. (2014) Identification of the phytosphingosine metabolic pathway leading to odd-numbered fatty acids. Nat. Commun., 5, 5338.
38) Schmelz, E.M., Crall, K.J., Larocque, R., Dillehay, D.L., & Merrill, A.H. Jr. (1994) Uptake and metabolism of sphingolipids in isolated intestinal loops of mice. J. Nutr., 124, 702–712.
39) Nyberg, L., Nilsson, Å., Lundgren, P., & Duan, R.D. (1997) Localization and capacity of sphingomyelin digestion in the rat intestinal tract. J. Nutr. Biochem., 8, 112–118.
40) Larson, G., Falk, P., & Hoskins, L.C. (1988) Degradation of human intestinal glycosphingolipids by extracellular glycosidases from mucin-degrading bacteria of the human fecal flora. J. Biol. Chem., 263, 10790–10798.
41) Sugawara, T., Tsuduki, T., Yano, S., Hirose, M., Duan, J., Aida, K., Ikeda, I., & Hirata, T. (2010) Intestinal absorption of dietary maize glucosylceramide in lymphatic duct cannulated rats. J. Lipid Res., 51, 1761–1769.
42) Sugawara, T., Kinoshita, M., Ohnishi, M., Tsuzuki, T., Miyazawa, T., Nagata, J., Hirata, T., & Saito, M. (2004) Efflux of sphingoid bases by P-glycoprotein in human intestinal Caco-2 cells. Biosci. Biotechnol. Biochem., 68, 2541–2546.
43) Fujii, A., Manabe, Y., Aida, K., Tsuduki, T., Hirata, T., & Sugawara, T. (2017) Selective absorption of dietary sphingoid bases from the intestine via efflux by P-glycoprotein in rats. J. Nutr. Sci. Vitaminol. (Tokyo), 63, 44–50.
44) Morifuji, M., Higashi, S., Oba, C., Ichikawa, S., Kawahata, K., Yamaji, T., Itoh, H., Manabe, Y., & Sugawara, T. (2015) Milk phospholipids enhance lymphatic absorption of dietary sphingomyelin in lymph-cannulated rats. Lipids, 50, 987–996.
45) Ohta, K., Hiraki, S., Miyanabe, M., Ueki, T., Aida, K., Manabe, Y., & Sugawara, T. (2021) Appearance of intact molecules of dietary ceramides prepared from soy sauce lees and rice glucosylceramides in mouse plasma. J. Agric. Food Chem., 69, 9188–9198.
46) Tsuji, K., Mitsutake, S., Ishikawa, J., Takagi, Y., Akiyama, M., Shimizu, H., Tomiyama, T., & Igarashi, Y. (2006) Dietary glucosylceramide improves skin barrier function in hairless mice. J. Dermatol. Sci., 44, 101–107.
47) Duan, J., Sugawara, T., Aida, K., Hirose, M., Sakai, S., Fujii, A., & Hirata, T. (2012) Dietary sphingolipids improve skin barrier functions via the upregulation of ceramide synthases in the epidermis. Exp. Dermatol., 21, 448–452.
48) Kuwata, T., Hashimoto, T., Ohto, N., Kuwahara, H., Lee, J.W., Bamba, T., & Mizuno, M. (2017) A metabolite of dietary glucosylceramide from pineapples improves the skin barrier function in hairless mice. J. Funct. Foods, 30, 228–236.
49) Kawano, K. & Umemura, K. (2013) Oral intake of beet extract provides protection against skin barrier impairment in hairless mice. Phytother. Res., 27, 775–783.
50) Haruta-Ono, Y., Setoguchi, S., Ueno, H.M., Higurashi, S., Ueda, N., Kato, K., Saito, T., Matsunaga, K., & Takata, J. (2012) Orally administered sphingomyelin in bovine milk is incorporated into skin sphingolipids and is involved in the water-holding capacity of hairless mice. J. Dermatol. Sci., 68, 56–62.
51) Morifuji, M., Oba, C., Ichikawa, S., Ito, K., Kawahata, K., Asami, Y., Ikegami, S., Itoh, H., & Sugawara, T. (2015) A novel mechanism for improvement of dry skin by dietary milk phospholipids: Effect on epidermal covalently bound ceramides and skin inflammation in hairless mice. J. Dermatol. Sci., 78, 224–231.
52) Tomonaga, N., Manabe, Y., Aida, K., & Sugawara, T. (2020) Dietary ceramide 2-aminoethylphosphonate, a marine sphingophosphonolipid, improves skin barrier function in hairless mice. Sci. Rep., 10, 13891.
53) 平河聡,佐藤綾,服部祐子,松本剛,横山浩治,金井周(2013)米胚芽エキス配合粉末顆粒の摂取による全身の皮膚バリア機能に対する改善効果.薬理と治療,41, 1051-1059.
54) 野嶋潤,村上敏之,桑原浩誠,竹田竜嗣,渡邉泰雄(2014)パイナップル由来セラミド経口摂取による日本人女性の皮膚機能改善効果.応用薬理,87, 81-85.
55) Dillehay, D.L., Webb, S.K., Schmelz, E.M., & Merrill, A.H. Jr. (1994) Dietary sphingomyelin inhibits 1,2-dimethylhydrazine-induced colon cancer in CF1 mice. J. Nutr., 124, 615–620.
56) Schmelz, E.M., Sullards, M.C., Dillehay, D.L., & Merrill, A.H. Jr. (2000) Colonic cell proliferation and aberrant crypt foci formation are inhibited by dairy glycosphingolipids in 1, 2-dimethylhydrazine-treated CF1 mice. J. Nutr., 130, 522–527.
57) Nyberg, L., Duan, R.D., & Nilsson, A. (2000) A mutual inhibitory effect on absorption of sphingomyelin and cholesterol. J. Nutr. Biochem., 11, 244–249.
58) Eckhardt, E.R., Wang, D.Q., Donovan, J.M., & Carey, M.C. (2002) Dietary sphingomyelin suppresses intestinal cholesterol absorption by decreasing thermodynamic activity of cholesterol monomers. Gastroenterology, 122, 948–956.
59) Noh, S.K. & Koo, S.I. (2003) Egg sphingomyelin lowers the lymphatic absorption of cholesterol and alpha-tocopherol in rats. J. Nutr., 133, 3571–3576.
60) Noh, S.K. & Koo, S.I. (2004) Milk sphingomyelin is more effective than egg sphingomyelin in inhibiting intestinal absorption of cholesterol and fat in rats. J. Nutr., 134, 2611–2616.
61) Duivenvoorden, I., Voshol, P.J., Rensen, P.C., van Duyvenvoorde, W., Romijn, J.A., Emeis, J.J., Havekes, L.M., & Nieuwenhuizen, W.F. (2006) Dietary sphingolipids lower plasma cholesterol and triacylglycerol and prevent liver steatosis in APOE*3Leiden mice. Am. J. Clin. Nutr., 84, 312–321.
62) Garmy, N., Taieb, N., Yahi, N., & Fantini, J. (2005) Interaction of cholesterol with sphingosine: Physicochemical characterization and impact on intestinal absorption. J. Lipid Res., 46, 36–45.
63) Feng, D., Ohlsson, L., Ling, W., Nilsson, A., & Duan, R.D. (2010) Generating ceramide from sphingomyelin by alkaline sphingomyelinase in the gut enhances sphingomyelin-induced inhibition of cholesterol uptake in Caco-2 cells. Dig. Dis. Sci., 55, 3377–3383.
64) Haramizu, S., Mori, T., Yano, M., Ota, N., Hashizume, K., Otsuka, A., Hase, T., & Shimotoyodome, A. (2014) Habitual exercise plus dietary supplementation with milk fat globule membrane improves muscle function deficits via neuromuscular development in senescence-accelerated mice. Springerplus, 3, 339.
65) Norris, G.H., Jiang, C., Ryan, J., Porter, C.M., & Blesso, C.N. (2016) Milk sphingomyelin improves lipid metabolism and alters gut microbiota in high fat diet-fed mice. J. Nutr. Biochem., 30, 93–101.