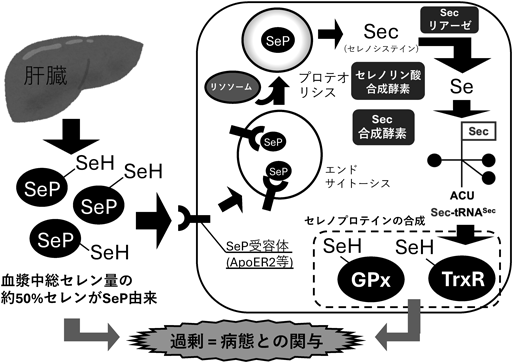
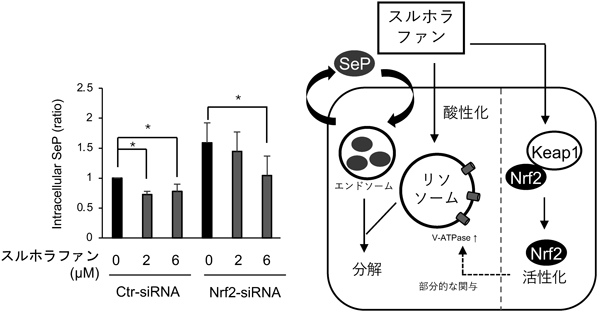
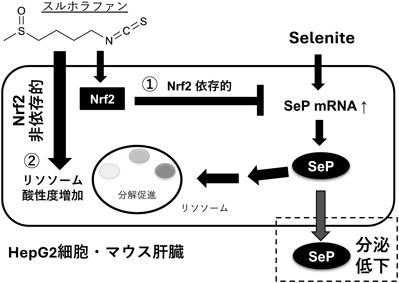
親電子性植物成分スルホラファンによるNrf2非依存的なセレノプロテインP発現低下機構Nrf2 independent downregulation of selenoprotein P by sulforaphane, an electrophilic phytochemical
東北大学大学院薬学研究科Graduate School of Pharmaceutical Sciences, Tohoku University ◇ 〒980–8578 宮城県仙台市青葉区荒巻字青葉6–3 ◇ 6–3 Aoba, Aramaki, Aoba-ku, Sendai, Miyagi 980–8578 Japan