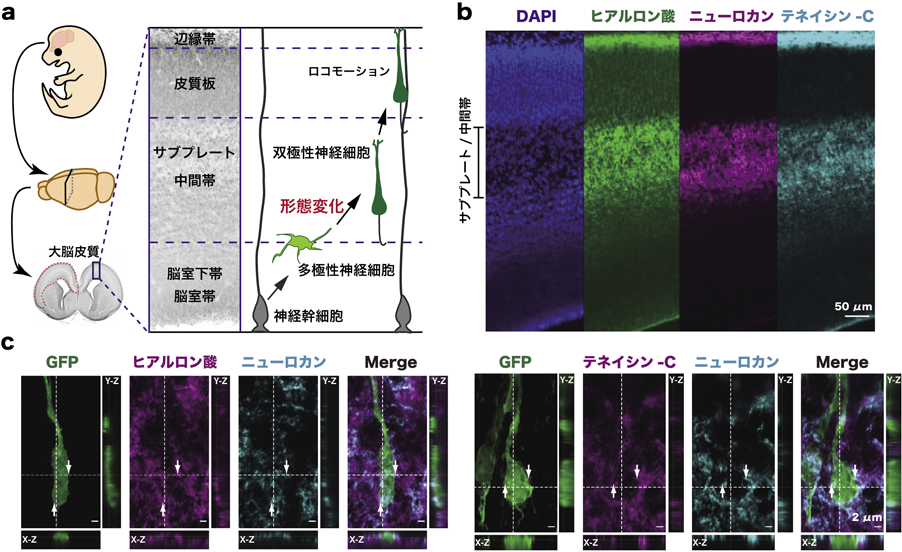
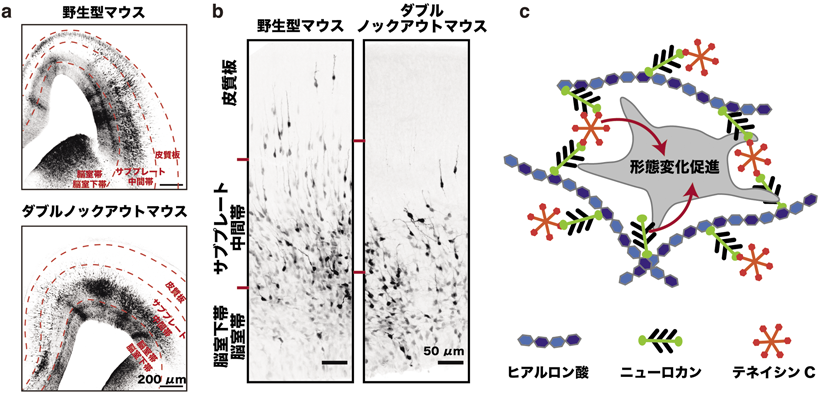
大脳皮質発達期の神経細胞移動における細胞外マトリクスの機能Function of the extracellular matrix in neuronal migration during cortical development
東京農工大学農学部硬蛋白質利用研究施設Scleroprotein and Leather Research Institute, Faculty of Agriculture, Tokyo University of Agriculture and Technology ◇ 〒183–8509 東京都府中市幸町3–5–8 ◇ 3–5–8 Saiwaicho, Fuchu, Tokyo 183–8509, Japan