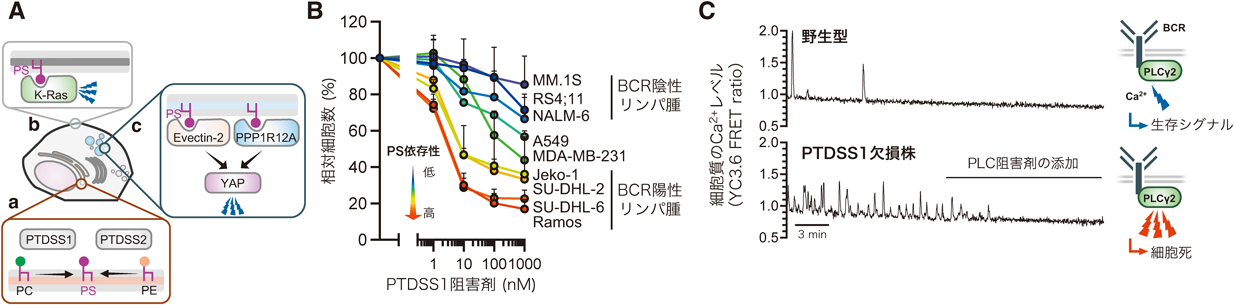
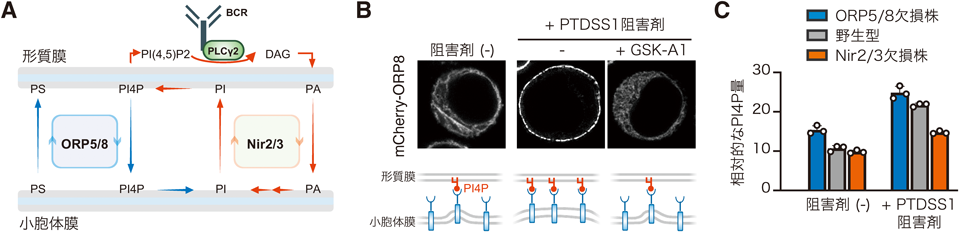
B細胞リンパ腫のリン脂質代謝制御による生存戦略Critical role of phospholipid metabolism in survival of B cell lymphoma
東京大学大学院薬学系研究科衛生化学教室Department of Health Chemistry, Graduate School of Pharmaceutical Sciences, The University of Tokyo ◇ 〒113–0033 東京都文京区本郷7–3–1 ◇ 7–3–1 Hongo, Bunkyo-ku, Tokyo 113–0033, Japan