ピリドキサール5′-リン酸(PLP)依存性酵素は,多くの細胞内代謝経路で働く最も汎用性の高い触媒の一つである.PLP依存性酵素は,アミノ基転移,脱炭酸,ラセミ化,エピメリ化,脱離または付加,アルドール反応,クライゼン縮合,脱水素,O2依存性酸化,脱水,環化など,幅広い化学反応を触媒する1).PLP依存性酵素の触媒多様性は,主にPLPが電子のポンプとして働く能力に起因しており,酵素によってさまざまなタイプの反応中間体が生成する.これらのPLP依存性酵素は優れた位置選択性と立体選択性を示し,有機合成では容易でない化学反応を達成するのに用いられている.実際に,この酵素ファミリーは,非タンパク質性アミノ酸化合物やキラルアミン化合物の合成に利用されている2, 3).また,このファミリーの生体触媒の反応制御や多様性については不明な点が多く,新規生体触媒の存在が数多く考えられていた.
2. NAD, SAMを受け入れるPLP依存性酵素SbzPの同定
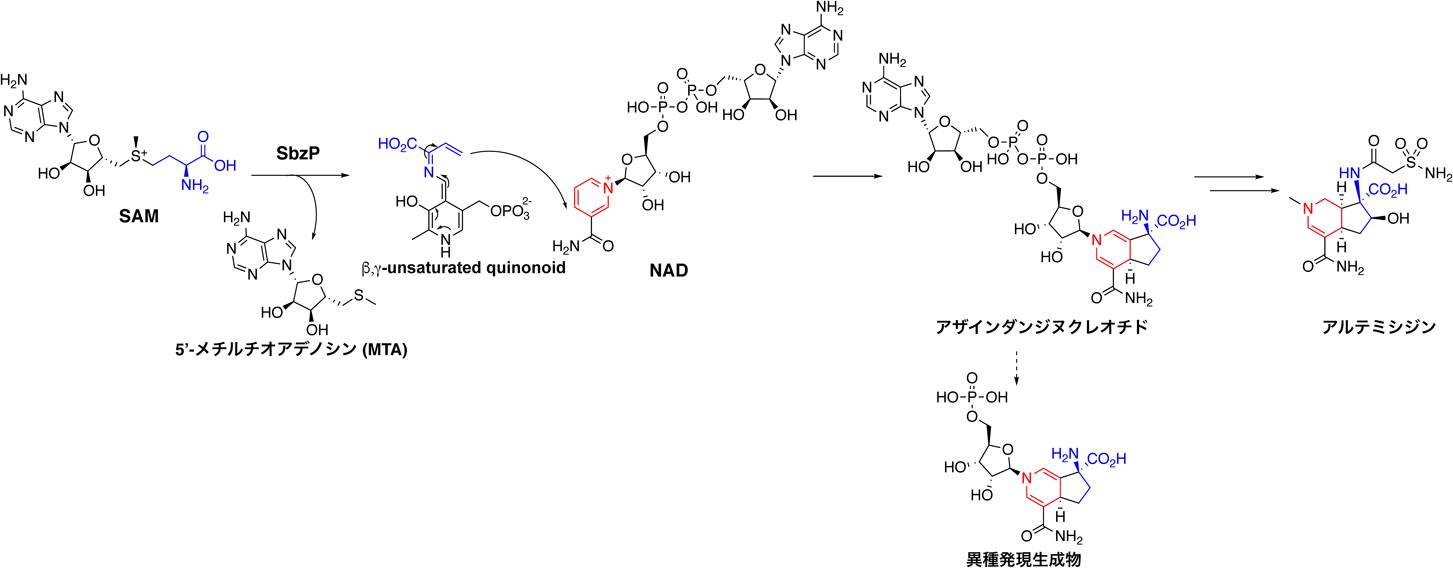
近年,著者らは,放線菌由来の抗腫瘍活性アルカロイド化合物(窒素原子を含む天然由来の有機化合物の総称)であるアルテミシジン(図1)の生合成研究に取り組み,特異なPLP依存性酵素SbzPを同定した.本化合物は類似生合成経路においてコア骨格を合成する酵素の情報がない,新規骨格であったため,既存の酵素のホモロジー検索では酵素遺伝子を発見することができなかった.そこで,抗菌活性代謝物の自己耐性遺伝子に注目する手法を用いて遺伝子を発見し,異種発現によってその遺伝子クラスターを同定した4).また,同位体ラベル一次代謝産物の投与実験により,その前駆体に関する情報を取得した.続いて,酵素の発現スクリーニングにより,生合成の最初のステップを触媒するSbzPを同定し,その異種発現中の水溶性生成物を単離構造決定した5)(図1).本化合物の構造より,SbzPは,酸化還元反応の補酵素として働くニコチンアミドモノヌクレオチド(NMN)と,PLP中間体の一つであるβ,γ-unsaturated quinonoid間の反応の触媒を担うことが予想できた.そこで,NMNとその類縁化合物ニコチンアミドアデニンジヌクレオチド(NAD),ニコチンアミドアデニンジヌクレオチドリン酸(NADP)とC-γ位に脱離基を持つアミノ酸を基質として,in vitro反応を行った.その結果,驚くべきことに,SbzPはNAD, S-アデノシルメチオニン(SAM)を基質として受け入れ,新規骨格であるアザインダンジヌクレオチドを合成した(図1).著者らは,このアザインダンジヌクレオチドが生合成の中間体となり,アルテミシジンへと導かれる一連の生合成経路を明らかにした.SbzPは,NADを基質として天然物の骨格を合成する初めての例であり,生合成,生化学を含む広範な学術分野に大きなインパクトを与えた.SbzP生成物は,これまでの,どの二次代謝産物グループにも属さない化合物群であり,新たな天然物群の発見となった5).アザインダンジヌクレオチドはニコチンアミド部が高度に修飾されたNAD化合物であり,その生理・生物活性も興味深い.
SbzP反応のキネティクス解析について,それぞれ異なるNAD濃度,SAM濃度で固定して,他方の基質濃度を変化させた場合,基質消費速度のLineweaver-Burkプロット直線はy軸平行に移動した.このデータより,アミノ基転移活性を持つ一般的なPLP酵素と同様に,SbzPはPing-Pong Bi-Biメカニズムにて反応が進行することが示された5).この機構によると,SAMをγ-脱離し,5′-メチルチオアデノシン(MTA)を放出し,そこに,NADを受け入れ,反応を触媒することが示唆された(図1).実際に,SbzP反応において,MTAが酵素産物として検出され,この仮説は確からしいことが示された.さらに,反応中PLPのスペクトルのstopped-flow解析により,本反応中のPLP中間体は反応後5秒間,520 nmの吸収を示すことがわかり,これが,SAMのγ-脱離後の生成物であるβ,γ-unsaturated quinonoidに対応することが示唆された(図1).
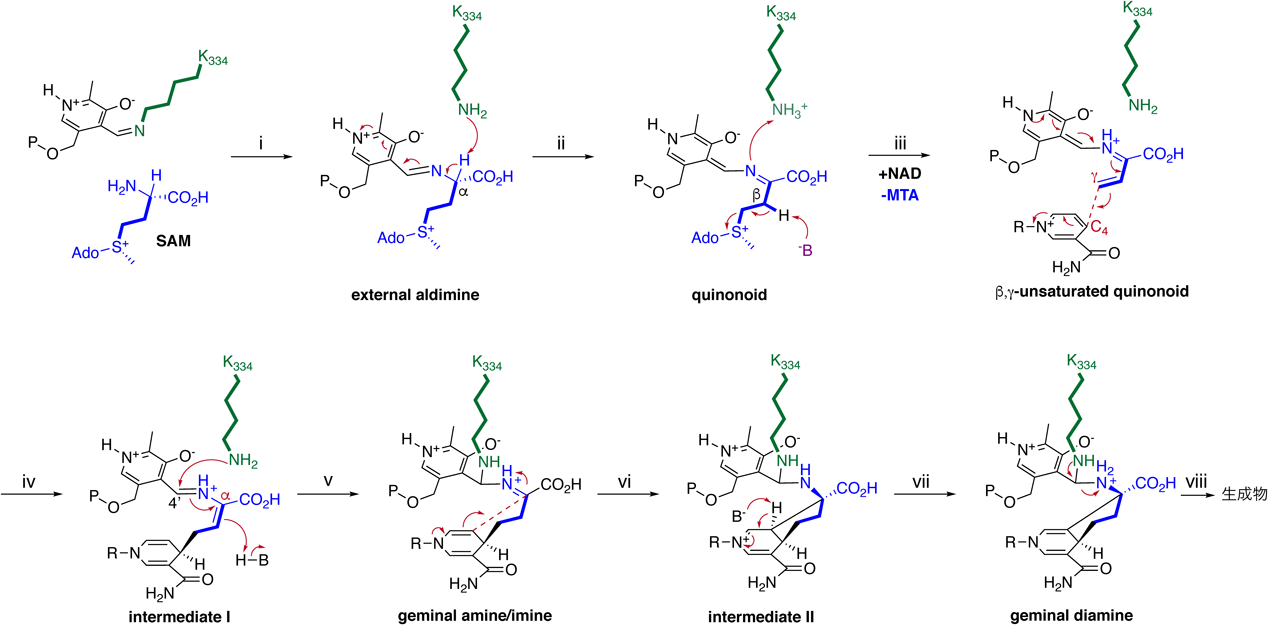
以上の解析データより,本酵素反応の反応機構を図2のように提唱した.i)まず,SAMが受け入れられ,活性リシンK334に共有結合したPLPと反応しexternal aldimineが形成される.ii)external aldimineのC-α位が脱プロトン化され,quinonoid骨格が生成される.iii)quinonoid骨格のC-β位が脱プロトン化され,MTAが脱離し,β,γ-unsaturated quinonoidが生成される.iv)β,γ-unsaturated quinonoidはNADのC-4位と反応し,最初のC–C結合が形成される.v)K334がPLPのC-4′に攻撃し,C-β位がプロトン化されることで,C-αがイミン炭素となり,求電子性を取り戻す.vi)NAD C-5位からC-α炭素への攻撃により2回目のC–C結合が形成される.vii)脱プロトンにより1,4-ジヒドロピリジンが形成し,viii)生成物がトランスアルジミン反応によりPLPから放出される.本酵素は,補酵素を受け入れる新規性の高い酵素であるだけでなく,C–C結合を2回形成する,PLP依存性酵素反応として非常に新規性が高い酵素であった.
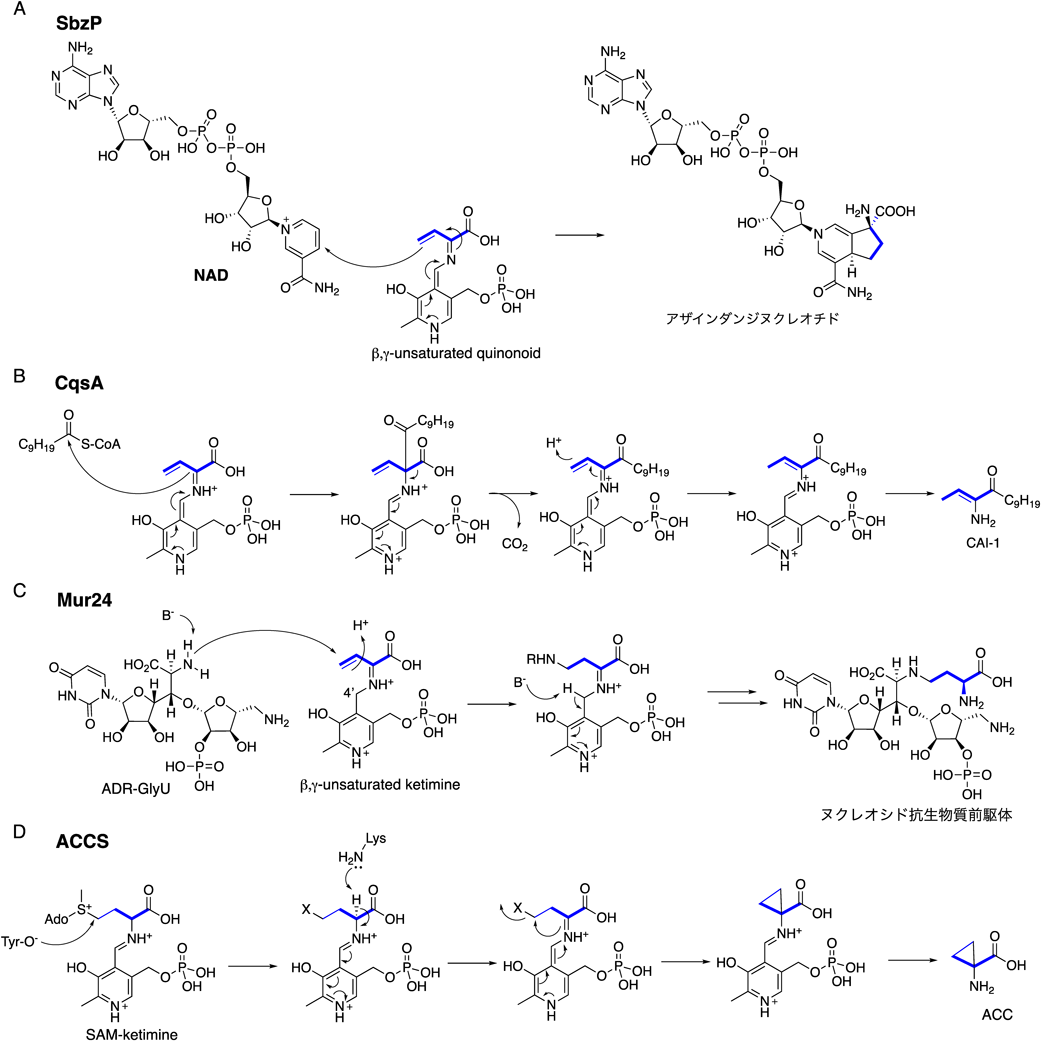
これまでに,NADを基質として受け入れる生合成酵素に関して,SbzP以外の報告はなかった一方で,SAMを受け入れるPLP酵素はいくつか知られている.そのうちの一つとして,重要な植物ホルモンであり,果実成熟など数多くの生物現象に関わるエチレンの前駆体合成に関わる,1-aminocyclopropane-1-carboxylic acid synthase(ACCS)があげられる6).ACCSは幅広い植物に存在し,SAMを受け入れ,アミノシクロプロパンカルボン酸を合成する(図4D参照).アミノシクロプロパンカルボン酸は,α-ケトグルタル酸(αKG)依存性酸化酵素ファミリーでありながら,αKGを用いない特殊な酸化酵素であるACC oxidaseによってエチレンへと変換される7).ACCSの全体構造は結晶構造解析により明らかにされており,阻害剤であるアミノエトキシビニルグリシンの複合体構造より,ACCSの基質認識サイトが明らかにされている8).
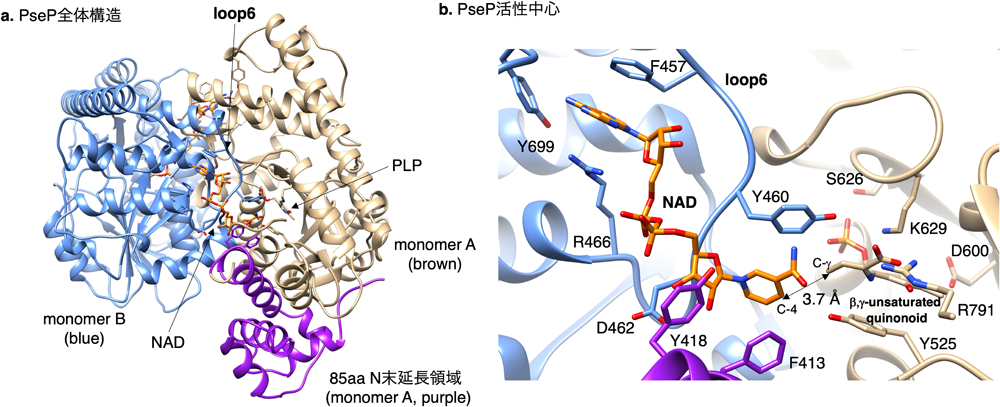
ACCSとSbzPの全体構造を比較すると,SbzPはN末端に85アミノ酸のACCSにはみられない長い延長領域があることがわかる.この領域を10アミノ酸以上欠損するとSbzPは失活するため,この部位が活性に重要であることが示唆された.この構造基盤,またNADやSAMの結合様式に関する知見を得るために,SbzPのPseudomonas由来ホモログPsePのクライオ電子顕微鏡解析を行った.その結果,NAD存在下,解像度2.6 Åでその立体構造を取得することに成功した9)(図3a).SbzP/PsePは二量体構造をとり,その二量体の境界領域のloop6とその周辺領域にNADが結合していることがわかった(図3b).これはアスパラギン酸アミノトランスフェラーゼに代表されるClass I PLP酵素の基質認識の特徴である10).さらに基質結合部位の精査の結果,アデニンがmonomer BのF457, Y699によって,二リン酸がR466によって,ニコチンアミドリボシドがmonomer AのF413, Y418とmonomer BのD462とloop 6によって保持されることを明らかにした(図3b).それぞれのアミノ酸残基に変異導入を行い,反応生成物の解析,サーマルシフトアッセイ,表面プラズモン共鳴解析を行ったところ,F413, Y418, F457, R466, Y699がNADの結合に重要であることが示された.また,F457A, R466A, Y699A変異酵素ではMTA生成量が大きく減少した一方,F413A, Y418AではMTAの生成量が野生型酵素と比較して105%,67%とそれぞれわずかな活性上昇,中程度の減少にとどまった.このデータより,F457, R466, Y699はSAM結合に重要である一方,F413, Y418は必須ではないことが示された.SAMはPLPの近傍に結合することが反応機構とドッキングシミュレーションより予想されたことから,本結果は意外な結果であった.
クライオ電子顕微鏡解析では,SAMの非存在下でNADが酵素に結合しており,この構造が触媒反応中の酵素構造を表すのか,それともアーティファクトなのか,議論の余地があった.SbzPのPing-Pong Bi-Biメカニズムによる反応機構を考えると,SAMがPLP/酵素と反応し,β,γ-unsaturated quinonoidが生成した後に,NADは酵素と結合すると考えられた.不安定なβ,γ-unsaturated quinonoidの結合時,NADがどのように酵素と結合するか解析しなくてはならないが,不安定構造のため,その解析は困難であった.そこで,東京大学大学院農学生命科学研究科寺田透先生との共同研究により,β,γ-unsaturated quinonoidの構造モデルをPseP/NADクライオ電子顕微鏡構造にドッキングし,NAD C-4位とβ,γ -unsaturated quinonoidのC-γ位の距離のMDシミュレーションを行った.その結果,計算時間中62%で5.0 Å以下の距離となり,クライオ電子顕微鏡構造は実際の反応中の酵素構造を反映している可能性が高いことが示された(図3b).
これまでに,SbzPと同様にSAMを受け入れて反応するPLP酵素は,ACCSの他に,Vibrio細菌の生息密度感知システムであるクオラムセンシングのオートインデューサーであるCAI-1の生合成中,β,γ−unsaturated quinonoidを形成後Cα位からacyl-CoAへの求核攻撃を触媒するCqsA11)(図4B),ヌクレオシド抗生物質muramycinの生合成中,β,γ-unsaturated ketimineを形成後ADR-GlyUのアミノ基からC-β位への求核攻撃を触媒するMur24が報告されている(図4C)12).SbzPとそれぞれの酵素の反応性の違いは非常に興味深いが,アミノ酸相同性は,SbzPに対してACCSは15%,CqsAは10%,Mur24は11%であり,三次元構造モデルでも類似しておらず,その構造比較は容易ではない.すべての酵素が,Class I PLP酵素10)に属するものの,それぞれ別の進化を遂げたものと予想される.SbzP, CqsA, Mur24はC–C結合形成に関わるため,活性化合物の骨格合成のためのツールとしても興味深い.
NADとSAMを受け入れる生合成酵素SbzPの発見は新たな補酵素天然物ファミリーの発見につながる生合成研究として新規性の高い発見であった.加えて,本発見によりSAMを受け入れるPLP酵素の反応多様性やSAM結合の構造基盤に関して新たな知見が得られ,既存の概念を広げることになった.さらに,本酵素のNAD結合部位はPfamデータベースなどでは検出されない新規性の高い領域であるため,今後は新たな結合モチーフを指標に新規NAD生合成酵素の発見やエンジニアリングによる新規NAD化合物の創出が見込まれる.また,糸状菌の二次代謝経路中では,Enzyme Similarity Tool(EFI)13)を用いて,糸状菌ゲノムよりSAMを受け入れるPLP酵素が見いだされた例が存在し14),近年のゲノムマイニング技術の高度化によるさらなる特異な補酵素代謝酵素発掘の可能性が示されている.今後,NAD, SAMをはじめとする,さらなる新規補酵素代謝酵素の発掘および機能解明が期待される.
謝辞Acknowledgments
本研究の遂行において,東京大学大学院薬学系研究科,阿部郁朗教授,森貴裕准教授,牛丸理一郎助教,レナバラ研究員,高エネルギー加速器研究機構,千田俊雄先生,安達成彦先生,加藤龍一先生,藤田雅也研究員,理化学研究所,吉田稔先生,松岡聖二研究員,東京大学大学院農学生命科学研究科,寺田透教授,東京大学大学院医学系研究科,吉川雅英教授,筑波大学生命環境系,小林達彦教授,微生物化学研究所,五十嵐雅之先生をはじめとして,数多くの皆様に大変お世話になりました.厚く御礼申し上げます.
引用文献References
1) Du, Y.L. & Ryan, K.S. (2019) Pyridoxal phosphate-dependent reactions in the biosynthesis of natural products. Nat. Prod. Rep., 36, 430–457.
2) Kimura, T., Vassilev, V.P., Shen, G.J., & Wong, C.H. (1997) Enzymatic Synthesis of β-hydroxy-α-amino acids based on recombinant D-and L-threonine aldolases. J. Am. Chem. Soc., 119, 11734–11742.
3) Ellis, J.M., Campbell, M.E., Kumar, P., Geunes, E.P., Bingman, C.A., & Buller, A.R. (2022) Biocatalytic synthesis of non-standard amino acids by a decarboxylative aldol reaction. Nat. Catal., 5, 136–143.
4) Hu, Z., Awakawa, T., Ma, Z., & Abe, I. (2019) Aminoacyl sulfonamide assembly in SB-203208 biosynthesis. Nat. Commun., 10, 184.
5) Barra, L., Awakawa, T., Shirai, K., Hu, Z., Bashiri, G., & Abe, I. (2021) β-NAD as a building block in natural product biosynthesis. Nature, 600, 754–758.
6) Yang, S.F. & Hoffman, N.E. (1984) Ethylene biosynthesis and its regulation in higher plants. Annu. Rev. Plant Physiol., 35, 155–189.
7) Kawai, Y., Ono, E., & Mizutani, M. (2014) Evolution and diversity of the 2-oxoglutarate-dependent dioxygenase superfamily in plants. Plant J., 78, 328–343.
8) Huai, Q., Xia, Y., Chen, Y., Callahan, B., Li, N., & Ke, H. (2001) Crystal structures of 1-aminocyclopropane-1-carboxylate (ACC) synthase in complex with aminoethoxyvinylglycine and pyridoxal-5′-phosphate provide new insight into catalytic mechanisms. J. Biol. Chem., 276, 38210–38216.
9) Awakawa, T., Mori, T., Barra, L., Ahmed, Y., Ushimaru, R., Gao, Y., Adachi, N., Senda, T., Terada, T., Tantillo, D.J., Abe, I. Nat. Catal. (2024) in press
10) Eliot, A.C. & Kirsch, J.F. (2004) Pyridoxal phosphate enzymes: Mechanistic, structural, and evolutionary considerations. Annu. Rev. Biochem., 73, 383–415.
11) Kelly, R.C., Bolitho, M.E., Higgins, D.A., Ng, W.-L., Jeffrey, P.D., Rabinowitz, J.D., Semmelhack, M.F., Hughson, F.M., & Bassler, B.L. (2009) The Vibrio cholerae quorum-sensing autoinducer CAI-1: Analysis of the biosynthetic enzyme CqsA. Nat. Chem. Biol., 5, 891–895.
12) Cui, Z., Overbay, J., Wang, X., Liu, X., Zhang, Y., Bhardwaj, M., Lemke, A., Wiegmann, D., Niro, G., Thorson, J.S., et al. (2020) Pyridoxal-5′-phosphate-dependent alkyl transfer in nucleoside antibiotic biosynthesis. Nat. Chem. Biol., 16, 904–911.
13) Zallot, R., Oberg, N., & Gerlt, J.A. (2019) The EFI web resource for genomic enzymology tools: Leveraging protein, genome, and metagenome databases to discover novel enzymes and metabolic pathways. Biochemistry, 58, 4169–4182.
14) Abad, A.N.D., Seshadri, K., Ohashi, M., Delgadillo, D.A., de Moraes, L.S., Nagasawa, K.K., Liu, M., Johnson, S., Nelson, H.M., & Tang, Y. (2024) Discovery and characterization of pyridoxal 5′-phosphate-dependent cycloleucine synthases. J. Am. Chem. Soc., 146, 14672–14684.
著者紹介Author Profile
 淡川 孝義(あわかわ たかよし)
淡川 孝義(あわかわ たかよし)国立研究開発法人理化学研究所環境資源科学研究センターチームリーダー.博士(農学).
略歴1983年宮城県生まれ.2006年東京大学農学部卒業.11年同大学院農学生命科学研究科博士課程修了.11年東京大学大学院薬学系研究科助教.18年講師.19年准教授.14年カリフォルニア大学サンディエゴ校スクリプス海洋研究所客員研究員.22年より現職.
研究テーマと抱負PLP酵素反応の多様性の開拓と制御,補酵素由来天然物の生合成機構の開拓,生合成機構改変による新規活性化合物生産,化合物活性,ターゲット評価,抗生物質の自己耐性機構.
ウェブサイトhttps://www.csrs.riken.jp/jp/labs/cbbrt/index.html
趣味ランニング,テニス.