アミノ酸は生体内のタンパク質の構成要素であり,栄養素やエネルギー源,呈味成分としてだけでなく,細胞内や血漿中に遊離の状態で存在し,多彩な生理機能を担っている.近年,その生理機能が注目され,アミノ酸を添加することで機能性を高めた食品や飲料,サプリメント,医薬品,化粧品などが数多く市場に登場している.
酵母Saccharomyces cerevisiaeは高等生物のモデル生物として,また発酵化学産業においてきわめて重要な微生物である.酵母におけるアミノ酸の代謝とその調節機構は多種多様であり,基礎科学の分野では,それらの分子機構の解明によって,生命現象や細胞機能に対する理解を深めることができる.一方,応用研究においては,細胞内外のアミノ酸含量を人為的に制御することで,アミノ酸そのものや代謝関連物質の生産,味・風味,健康・栄養機能などを強化した発酵・醸造食品の製造などが期待できる.
酵母は炭素源と窒素源があれば,細胞内ですべてのアミノ酸を合成する1).アミノ酸はその合成経路の前駆体により,グルタミン酸,芳香族,セリン,アスパラギン酸,ピルビン酸の各ファミリーに分類される(ヒスチジンはヌクレオチド合成に関連する).特に,グルタミン酸とグルタミンは窒素代謝やアミノ基転移反応に関与している重要なアミノ酸である.最近の研究では,TOR(target of rapamycin)経路やGCN(general control non-derepressible)経路がアミノ酸合成の制御に重要であることがわかってきた2).
また,酵母は窒素源(アミノ酸,アンモニア,尿素など)を利用しやすいもの(preferred, good)と利用しにくいもの(non-preferred, poor)に分け,窒素異化産物抑制(nitrogen catabolite repression:NCR)によって代謝関連遺伝子の転写を制御している3).利用しやすい窒素源が不足すると,NCRが解除され,利用しにくい窒素源が利用可能になる.この調節は酵母の遺伝的背景に依存し,菌株によって異なる.アミノ酸合成遺伝子は,一般アミノ酸制御(general amino acid control:GAAC)によって調節され,アミノ酸欠乏時に複数の合成酵素が誘導される4).GAACは,転写因子Gcn4がプロモーターに結合し,Gcn2キナーゼが翻訳開始因子eIF2をリン酸化してGcn4の翻訳を促進することで機能する.Gcn4の発現調節はNCRの解除とプロテアソーム分解の低下にも関与する.
酵母は細胞膜センサーによって細胞外の栄養状態を感知する.特に,SPS(Ssy1-Ptr3-Ssy5)センサーは外部のアミノ酸に応答し,遺伝子発現を調節する5).Ssy1はアミノ酸を取り込まず,局所構造の変化を通じて濃度差を感知する.Ssy5はプロテアーゼ活性を有し,Stp1とStp2のプロセシングに関与する.また,アミノ酸の代謝には細胞内の局在や輸送が重要であるため,トランスポーターの研究が盛んに行われている6).酵母は多様な輸送系を有し,環境変化に応じてアミノ酸を適時適量取り込む.細胞膜ではPma1がH+との共輸送を行い,ミトコンドリア内膜ではMCPファミリーが濃度差に基づく輸送を担っている.液胞はアミノ酸の主要な貯蔵場所であり,液胞膜のトランスポーターはV0V1型H+-ATPaseによりアミノ酸を適正レベルに維持する.
筆者らは,モデル酵母(実験室酵母)に見いだしたアミノ酸の代謝調節機構や生理機能を解析するとともに,産業酵母(パン酵母,酒類酵母など)のアミノ酸代謝を人為的に改変することで,特定のアミノ酸含量が増加した菌株を開発してきた.個々のアミノ酸に関して,筆者らの研究によって得られた知見を以下の節で概説する.
1)プロリン(Pro)
Proは環状構造の二級アミンとして特徴的な性質を有している.たとえば,ペプチド鎖におけるProは水素結合を形成できないため,タンパク質の立体構造に大きく影響する.このため,タンパク質中のPro残基はさまざまな生命現象に関わり,各種酵素,サイトカイン,成長因子の活性部位を構成するほか,タンパク質間や低分子化合物との相互作用も担っている7).遊離のProにも多彩な生理機能があり,角質層の保湿成分,エネルギー源,抗酸化剤として利用される.
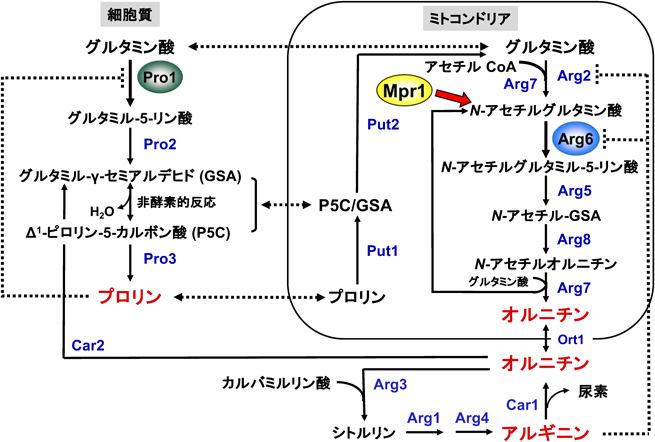
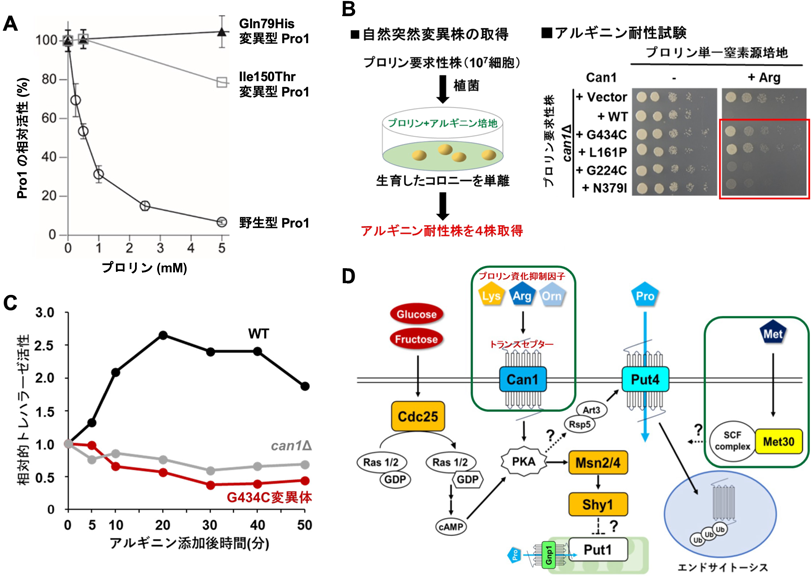
酵母において,Proは細胞質で主にグルタミン酸(Glu)からγ-グルタミルキナーゼPro1,γ-グルタミルリン酸レダクターゼPro2,Δ1-ピロリン-5-カルボン酸レダクターゼPro3によって還元的に合成される.また,一部はアルギニン(Arg)からアルギナーゼCar1,オルニチンアミノトランスフェラーゼCar2により合成される(図1).一方,Proはミトコンドリア内でProオキシダーゼPut1,Δ1-ピロリン-5-カルボン酸デヒドロゲナーゼPut2によって酸化的に分解され,Gluに変換される.Proの代謝は多くのアミノ酸と同様に,転写・翻訳後レベルで厳密に制御されているため,野生株の細胞内ではProはほとんど検出されない8).筆者らは,Proの毒性アナログ(アゼチジン-2-カルボン酸:AZC)に耐性を示す実験室酵母の変異株から,Pro含量が増加した株を取得し,解析を行った.その結果,酵母においても多くの細菌や植物と同じように,γ-グルタミルキナーゼPro1の活性がProによるフィードバック阻害を受けることがわかった.また,PRO1遺伝子にAsp154AsnやIle150Thrなどのアミノ酸置換を伴う変異が導入されると,フィードバック阻害に対する感受性が著しく低下し(図2A),Proが過剰合成されることが明らかになった9–11).また,AZC耐性変異株から得られた清酒酵母のPro高含有株においても,PRO1遺伝子に新規なアミノ酸置換(Gln79His)を有するヘテロ変異があり,フィードバック阻害非感受性とPro高生産の原因であることが判明した(図2A)12).Pro1のGln79を塩基性アミノ酸(Lys, Arg)に置換すると,His置換と同様にフィードバック阻害感受性が低下し,Pro含量が顕著に増加した13).この菌株を用いて醸造した清酒では,Pro含量が顕著に増加する一方で,コハク酸含量が減少した12).コハク酸は旨味のある酸味成分であり,コハク酸含量の減少は「淡麗辛口」清酒の醸造につながる.Proの高生産がコハク酸含量の減少に寄与する原因は不明であるが,Put1とコハク酸デヒドロゲナーゼのミトコンドリア電子伝達系との共役が関与している可能性がある.
Proは甘味(低濃度)・苦味(高濃度)を呈しており,その含量はアルコール飲料の味に影響を及ぼしている.Proはワイン,ビールの原料(ブドウ,麦芽)に最も多く含まれているアミノ酸であるが,発酵中の酵母はProを窒素源としてほとんど資化(取り込み,分解)できないため,発酵後も多量に残存する14).残存したProは苦味の増加や酸味の減少を引き起こし,酒質を低下させるだけでなく,発酵中に窒素源が枯渇するため,人工窒素源の添加が必要となる.筆者らは最近,アルギニン(Arg)をはじめとする塩基性アミノ酸がPro資化を抑制することを見いだした15, 16).また,Arg存在下では,ProトランスポーターPut4がユビキチンリガーゼRsp5とアダプタータンパク質Art3を介してエンドサイトーシスされることを報告した17).さらに,ArgによるPro資化の抑制が解除された変異株を単離し,ArgトランスポーターのCan1タンパク質がPro資化の抑制に関わることを見いだした(図2B).Can1のArg取り込み活性はPro資化抑制の制御と無関係であることもわかった16).近年,トランスポーターの中で輸送活性以外に外部環境因子の受容体(レセプター)活性も有するタンパク質が「トランスセプター」として注目され,c-AMP非依存的にprotein kinase A(PKA)シグナルを活性化することが知られている18).そこで,Can1のトランスセプターとしての機能を解析した結果,Arg(塩基性アミノ酸)がCan1依存的にPKAシグナルを活性化させ,Pro資化抑制を制御していることが示された(図2C)16).また,これらに関係する遺伝子(CDC25,MSN2/4,SHY1)に変異を導入した酵母は少量のPro消費が可能となった19, 20).さらに,別の変異株の解析から,Met30(Skp1/Cullin/F-boxユビキチンリガーゼ)がCan1と独立してPro資化を制御していることもわかった(図2D).一方,自然界にはアミノ酸資化能の異なる野生酵母が存在しており,大規模な酵母コレクションからワインやビールの発酵モデル培地上でProを資化する菌株を多数取得した21, 22).現在,これらの菌株のPro資化メカニズムを解析するとともに,Pro含量の低下したワインやビールの醸造を試みている.
植物や細菌において,Proは高塩や乾燥などのストレスに応答して細胞内に蓄積され,浸透圧調節物質(適合溶質)として機能する.また,スーパーオキシドアニオンや過酸化水素のような活性酸素種(reactive oxygen species:ROS)を除去し,酸化ストレスから細胞を保護する活性もある.さらに,凍結や乾燥,高温環境下でのタンパク質や細胞膜の保護,タンパク質のフォールディング促進,氷結晶の形成抑制,塩ストレス下での核酸のTm値低下など多彩な機能が報告されている8, 23).筆者らも,酵母を高濃度のエタノールにさらすと細胞内のROSレベルが増加するが,Pro高含有株ではほとんど増加しないことを見いだした24).また,Pro溶液中に酵母を懸濁すると,冷凍後の細胞生存率の低下が抑えられた9).これは,Proが水分子と強固に結合し,冷凍状態での細胞内氷結晶の形成や成長,さらには細胞外への脱水を防ぐためであると考えられる.さらに,細胞内Pro含量が多い実験室酵母は,冷凍,乾燥,酸化,高温,エタノールなどのストレスに対する耐性が向上した9, 25–28).一方で,Pro高含有株の液胞機能を欠損させると,エタノールや高温に感受性を示すことから,Proによる細胞保護には液胞が重要である29).
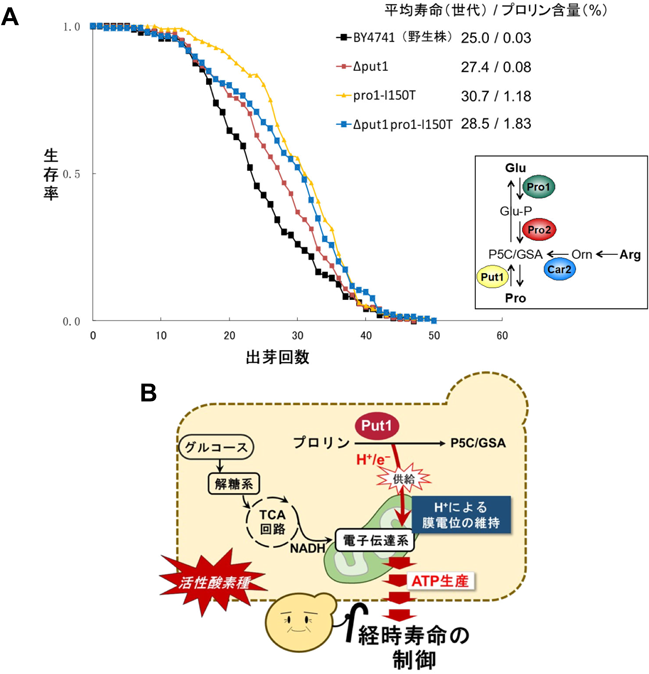
酵母の寿命には,分裂寿命(replicative lifespan;母細胞が娘細胞に分裂できる回数)と経時寿命(chronological lifespan;分裂停止細胞が生存できる期間)がある.細胞内のPro含量が増減する菌株を作製したところ,Pro高含有株では野生株に比べて分裂寿命が延長していた(図3A)30).細胞分裂の過程で酵母の細胞膜は薄くなり,浸透圧ストレスや機械ストレスにさらされるため,Proがこれらを軽減していると考えられる.一方,経時寿命はPro含量と無関係であり,PUT1遺伝子の欠損によって短縮した(図3B)31).Put1はProを酸化し,電子とプロトンをミトコンドリアの電子伝達系に送ることで膜電位の維持に関与している.経時寿命は糖源が枯渇した条件で細胞の恒常性に関連するため,Pro-Put1経路によるエネルギー産生が経時寿命を制御している可能性がある.Put1のホモログは多くの生物で保存されており,Put1とエネルギー代謝,寿命の関係を解明することで,老化防止や健康長寿,エネルギー代謝不全の予防などが期待される.
応用研究としては,Proが産業酵母の発酵・醸造特性に及ぼす影響について検討した.パン酵母は,製パンプロセスにおいて冷凍,乾燥,高糖などのストレスにさらされ,発酵能(炭酸ガス発生能)が制限される32).そこで,変異型Pro1(Ile150Thr, Asp154Asn)を発現するパン酵母のPro高生産株をセルフクローニング法により作製したところ,冷凍・高糖生地での発酵能が親株に比べて有意に向上した33–35).また,パン酵母のAZC耐性変異株からPro高生産株を分離したところ,PRO1遺伝子に新規なアミノ酸置換(Pro247Ser, Glu415Lys)を伴うヘテロ変異が見いだされ36),冷凍・高糖生地での発酵能が親株に比べて顕著に増加した.一方,清酒酵母は清酒醸造において高濃度エタノールや高浸透圧などのストレスにさらされている.そこで,セルフクローニング法により変異型Pro1(Ile150Thr, Asp154Asn)を発現するPro高生産株を作製した.醸造試験を行った結果,Pro高生産株は親株よりも早く発酵が終了し,そのときのエタノール濃度はわずかであるが高い傾向にあった37).さらに筆者らは,エールビール酵母の親株からPro含量が約2倍に増加した株を取得した.この株にはPRO1遺伝子に新規なアミノ酸置換(Cys179Tyr)を伴う変異があり,フィードバック阻害が一部解除されることで,Proの合成量が増加したものと考えられた.実際にこの株を用いることでクラフトビールの醸造期間の短縮と商品化が実現した(2021年).ビールの原料である麦汁は酵母にとって高浸透圧ストレスであるため,Proの増加により発酵が速く進行した可能性がある.
2)アルギニン(Arg)合成に関与するN-アセチルトランスフェラーゼMpr1
筆者らは,酵母S. cerevisiae Σ1278b株のゲノム上に,細胞のAZC耐性に関与する遺伝子MPR1を見いだした38).MPR1は新規なN-アセチルトランスフェラーゼMpr1をコードし,AZC,cis-4-ヒドロキシプロリン(CHOP)などの環状二級アミンを基質とする39–44).AZCはスズランなどの植物には存在するが,酵母では検出されないことから,Mpr1の細胞内基質や生理機能の解析を行った.その結果,Mpr1を発現する酵母では,細胞内ROSレベルが上昇する酸化ストレス(高温,冷凍,エタノールなど)に対する耐性が向上した45–47).また,酵母を高温にさらすと,Mpr1依存的なArg合成が細胞保護に寄与することが示唆された48).Mpr1はArg合成の中間代謝産物であるN-アセチルグルタミン酸を供給することで,Arg合成に寄与していると考えられる(図1)49, 50).細胞内外のArgは酵母の冷凍耐性を向上させるが9, 26, 51),酵母においてArg合成を介した抗酸化機構は知られておらず,Mpr1は新たな抗酸化機構の鍵となる可能性がある.
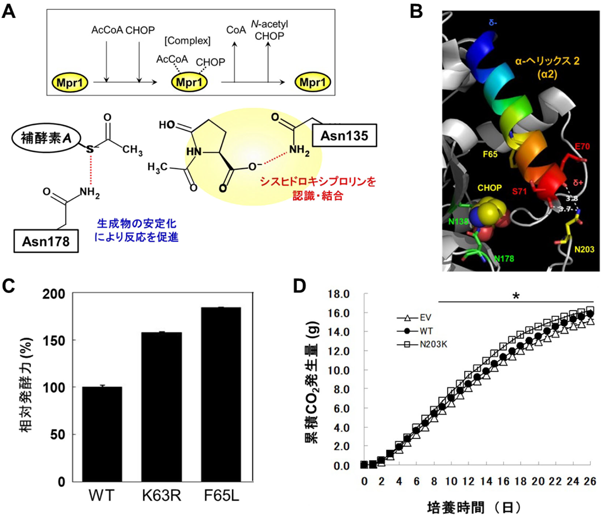
筆者らは,X線結晶構造解析によってMpr1のユニークな基質認識構造と反応触媒機構を明らかにし,Asn135, Phe138, Asn178などが重要な残基であることを見いだした(図4A)52).さらに,MPR1遺伝子へのランダム変異導入により,野生型酵素よりも過酸化水素やエタノール処理後のROSレベルを低下させ,細胞生存率を向上させる変異型Mpr1を取得した53).特に,Phe65Leu変異型Mpr1では温度安定性が著しく向上したが,疎水性領域に埋まっているPhe65のLeuへの置換によりパッキングが強固になったことがその理由であると考えられた50).また,構造情報から分子設計を試み(図4B),Mpr1の安定性に重要だと思われるαヘリックスの安定化に関わるAsn203に着目し,熱安定性が向上した変異型Mpr1(Asn203Lys, Asn203Arg)を創製した50).
次に,Mpr1が産業酵母の特性に及ぼす影響を解析した.まず,パン酵母のMPR1遺伝子を破壊すると,乾燥処理後のROSレベルが上昇し,細胞生存率が低下したことから,Mpr1はパン酵母の発酵力に関与することが判明した54).また,変異型Mpr1をパン酵母で発現させると,乾燥処理後の生存率と発酵力が増加した(図4C)54).清酒酵母については,小仕込み試験での発酵力が向上し(図4D),清酒の香気成分や有機酸の含量が変化した55).これらの結果から,Mpr1は産業酵母のストレス耐性を向上させ,発酵・醸造食品の高付加価値化に寄与することがわかった.Mpr1はその高い基質特異性から,他の酵母や微生物,植物などでも機能すると考えられる.筆者らは,MPR1遺伝子とAZCの組合わせが新しい選択マーカーシステムとして利用できることを報告した56–58).また,土壌細菌由来のプロリンcis-4-ヒドロキシラーゼとMpr1を大腸菌で共過剰発現させると,抗腫瘍剤として期待されるCHOPのN-アセチル化体が生産できた59).
3)オルニチン(Orn)
Ornはタンパク質の構成アミノ酸ではないが,シジミやキノコ類に多く含まれ,遊離した形で肝臓の解毒作用の促進,アルコール性疲労の抑制,成長ホルモンの分泌促進などの機能が知られている.Ornは主にCorynebacterium属細菌を用いた発酵法で製造されているが60),酵母によるOrnの高生産は報告されていない.そのため,Orn高生産酵母を用いることで,健康イメージを付与し,付加価値を高めた清酒の醸造や酒粕の開発が可能となる.
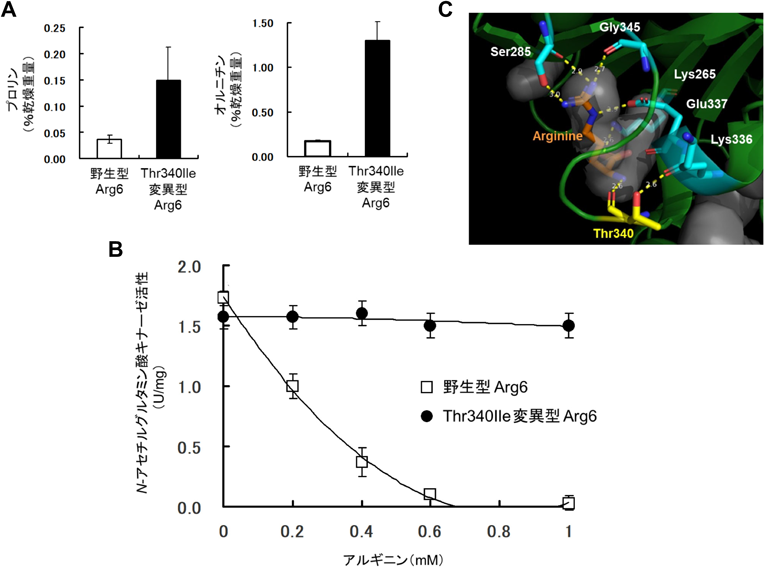
酵母のOrnはミトコンドリア内でGluから数段階の酵素反応により合成される.その後,細胞質に移行し,シトルリン,アルギノコハク酸,Argを経て,再びOrnに変換される.Ornの合成経路では,2番目の反応を触媒するN-アセチルグルタミン酸キナーゼArg6の活性がArgによって制御されることで,OrnやArgの合成量が調節される(図1).筆者らは,ProアナログのAZCに耐性を示す清酒酵母の変異株の中から,ProだけでなくOrnの含量も顕著に増加した株を単離した61).この株を用いて清酒を醸造すると,清酒中および酒粕中には親株に比べて3倍以上のOrnが含まれていたことから,Orn含量の多い清酒が2017年,2019年,2020年に商品化された.次に,この変異株の全ゲノム解析を行い,ARG6遺伝子にThr340Ileのアミノ酸置換を伴うホモ変異を同定した61).この変異型Arg6を実験室酵母で発現させたところ,Pro含量が顕著に増加するとともに,Orn含量も約7倍に増加した(図5A).さらに,組換え酵素を解析した結果,1 mMのArg存在下で野生型Arg6はほぼ活性が消失したが,変異型Arg6ではほとんど活性が変化しなかった(図5B).以上の結果から,Thr340Ileの置換に伴ってArgによるフィードバック阻害感受性が低下し,Ornが高生産されることが判明した61).Arg6においては,分子内のLys265, Ser285, Glu337, Thr340, Gly345が基質のArgと相互作用し,特にThr340は主鎖のカルボニル酸素がArgのα-アミノ基と水素結合するとともに,水酸基を介してLys336とも相互作用している(図5C).そこで,Thr340をIle以外のアミノ酸に置換した変異型Arg6を作製した62).その結果,Thrと同様に側鎖に水酸基を有するセリンに置換した場合のみ,Argによるフィードバック阻害に感受性を示した.340番目残基の側鎖の水酸基がArg結合ポケットの形成に重要であり,ThrからIleや他のアミノ酸への置換に伴う局所構造の破壊がフィードバック阻害解除の原因であると考えられた.さらに,新たにOrnを高生産する変異株を単離したところ,ARG6遺伝子にCys119TyrまたはVal267Alaのアミノ酸置換を伴う変異が導入されていた.これらの変異型Arg6においても,フィードバック阻害感受性が低下し,Ornが高生産された62).Orn高生産酵母では,Ornから合成されるArgの含量は増加せず,Proが増加していた.これは過剰合成されたOrnがCar2によってΔ1-ピロリン-5-カルボン酸に変換され,それ以降の酵素反応によりPro合成量が増加したためと考えられる(図1)62).
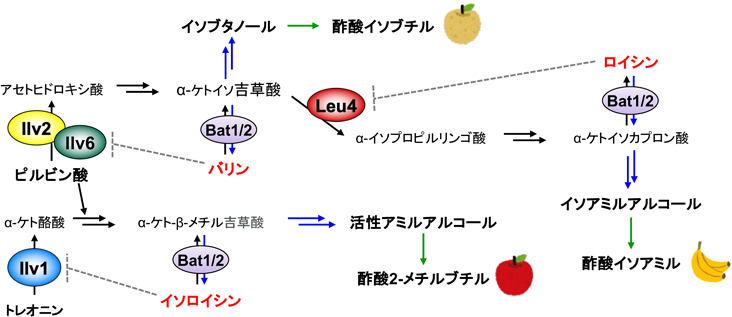
BCAAのロイシン(Leu),バリン(Val),イソロイシン(Ile)は,筋肉増強,疲労軽減などの機能を有する必須アミノ酸である.酵母のLeuとValはピルビン酸から合成され,α-ケトイソ吉草酸から経路が分岐する.一方,Ileはトレオニンの脱アミノ化で生成するα-ケト酪酸とピルビン酸から,Val合成に関与する酵素によって合成される(図6).醸造過程では,BCAAが脱アミノ化,脱炭酸,還元反応からなるエーリッヒ経路を経て,実や花の香りを示す高級アルコール(イソアミルアルコール,イソブタノール,活性アミルアルコール)とその酢酸エステル(酢酸イソアミル,酢酸イソブチル,酢酸2-メチルブチル)にそれぞれ代謝される(図6).これらの揮発性化合物の種類や濃度は,アルコール飲料の酒質に大きな影響を与える.したがって,前駆体のアミノ酸を蓄積する酵母によって,アミノ酸由来の香気成分が増加し,アルコール飲料の高付加価値化が可能になる.また,高級アルコールは,次世代バイオ燃料としても注目されている.
1)ロイシン(Leu)
酵母のLeu合成は,α-イソプロピルリンゴ酸シンターゼLeu4の活性がLeuによるフィードバック阻害を受けることで調節されている63).また,他のBCAAと同様に,Leuはエーリッヒ経路を介してα-ケトイソカプロン酸からα-ケト酸脱炭酸酵素,アルコール脱水素酵素によってイソアミルアルコールと酢酸イソアミルへ変換される(図6)64).酢酸イソアミルは清酒(吟醸香)やパン(バナナ香)の主要な香気成分であるため,清酒酵母やパン酵母では酢酸イソアミルの増加を目的としたLeu高生産株が育種されてきた.一方で,沖縄の伝統的蒸留酒である泡盛の醸造に用いる酵母は,主に泡なし酵母(泡盛酵母)が使用されており,育種に関する研究はほとんど行われていなかった.
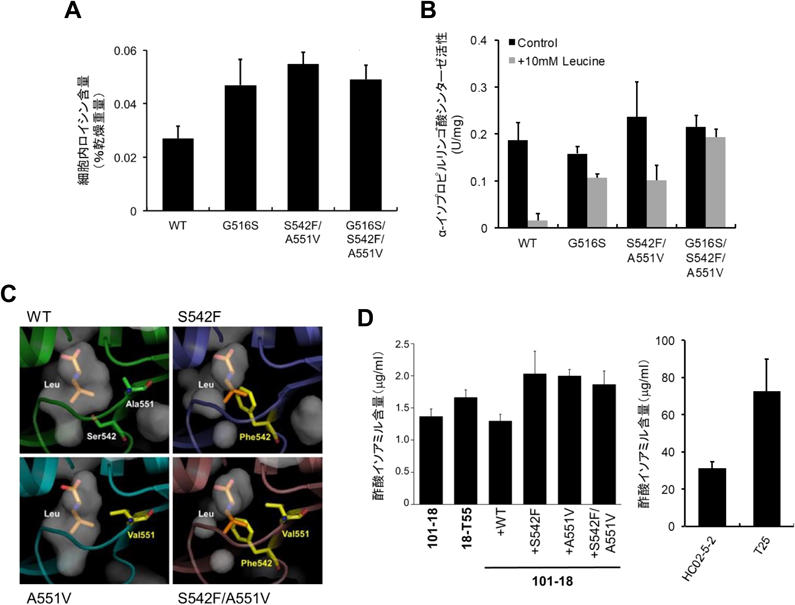
筆者らは,泡盛に高香味性を付与すべく,泡盛酵母を親株としてLeuの毒性アナログ(5,5,5-トリフルオロLeu)に耐性を示す変異株から,Leu高含有株(18-T55株)を取得した65).18-T55株のゲノム解析から,LEU4遺伝子に二つのアミノ酸置換(Ser542Phe, Ala551Val)を伴うヘテロ変異を同定し,これらの置換がLeuの高生産およびLeu4のフィードバック阻害解除を引き起こすことがわかった(図7A, B).Leu4の構造を予測したところ,Ser542, Ala551はLeu結合部位の近傍にあり,アミノ酸置換に伴う立体障害がフィードバック阻害解除の原因であると考えられた(図7C).Leu高生産株で醸造した泡盛は,親株よりもイソアミルアルコール,酢酸イソアミルの含量が増加し(図7D),香味性が強いことから,2016年と2023年に商品化された.本研究は泡盛酵母を育種した初めての例であり,アミノ酸アナログ耐性変異株の取得が育種に有効であることを実証した65).
また,沖縄のハイビスカスの花や島バナナの茎から新たな野生酵母を採取し(HC02-5-2株66),35a14株67)),各株のDNA配列を系統解析により比較した.その結果,HC02-5-2株は清酒酵母や泡盛酵母とは異なり,ワイン酵母に近いことが示唆された.そこで,Leu代謝に着目し,HC02-5-2株の突然変異処理により分離した5,5,5-トリフルオロLeu耐性株から,Leuと酢酸イソアミルを多く生産する株(T25株)を取得した(図7D)66).T25株のLEU4遺伝子にはアミノ酸置換(Gly516Ser)を伴うヘテロ変異が存在し,変異型Leu4の発現株では細胞内Leu(図7A)と酢酸イソアミルが増加するとともに,Leu4活性のフィードバック阻害感受性が著しく低下していた(図7B).Gly516はLeu4のアロステリック調節を受ける制御ドメイン内に存在し,セリンへの置換によりLeu結合ポケットに立体障害が生じることが示唆された.T25株で醸造した泡盛は,華やかな香りが特徴で,2019年に商品化された.また,野生株領域に位置する35a14株からは,酢酸イソアミルを高生産する変異株(BNNL80株)を取得した.BNNL80株はLeu4のアミノ酸置換(Asp578Asn)に起因するフィードバック阻害感受性の低下によりLeuと酢酸イソアミルを高生産することが示唆された67).BNNL80株で醸造した泡盛も酢酸イソアミル含量が高いことから2024年に商品化された.以上の結果から,比較ゲノム解析によって酵母の醸造特性の背景となるゲノムの特徴づけができることがわかった68).
2)バリン(Val)
酵母のVal合成は,アセトヒドロキシ酸シンターゼ(AHAS)がValによるフィードバック阻害を受けることで調節されている69).AHASは触媒サブユニットIlv2と制御サブユニットIlv6で構成され,ValがIlv6に結合することで活性が阻害される(図6)70).筆者らは,大腸菌のAHASにおいてフィードバック阻害を解除するアミノ酸置換71)をもとに,Ilv6において同様のアミノ酸置換が活性に与える影響を解析した72).その結果,Valとの結合領域であるACTドメイン上のAsn86Ala, Gly89Asp, Asn104His各変異型Ilv6を発現させた株では,Valの毒性アナログ(ノルバリン)に対する耐性が野生株よりも高まり,細胞内のVal含量が約4倍に増加した.一方,LeuとIleの含量は変わらず,BCAAの合成経路は共通であるが,その制御機構は独立していることが示唆された.また,Ilv2とIlv6の組換えタンパク質を用いてAHAS活性を測定したところ,Asn86Ala, Gly89Asp, Asn104His置換によりValのフィードバック阻害が解除された72).
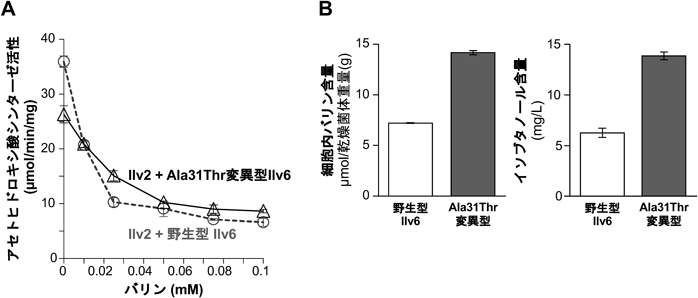
Valからは,次世代バイオ燃料として期待されるイソブタノールや果実(梨)の香りを有する酢酸イソブチルが生成する(図6)73).したがって,Val高生産酵母を用いて清酒を醸造し,Val由来の香気成分を増加させることで,清酒の付加価値を高めることが期待できる.筆者らは,ノルバリンに耐性を示し,細胞内Val含量が有意に増加した変異株を取得した74).変異株には,ILV6遺伝子にアミノ酸置換(Ala31Thr)を伴うヘテロ変異が入っていた.野生型Ilv6は0.025 mMのVal存在下でAHAS活性が約30%に低下したが,変異型Ilv6では活性が約60%残っていた(図8A).また,変異型Ilv6を発現する実験室酵母は,野生型Ilv6と比較して細胞内のValおよび細胞外のイソブタノールがそれぞれ約2倍に増加した(図8B).これらの結果から,Ilv6のアミノ酸置換(Ala31Thr)によりValのフィードバック阻害が部分的に解除され,Valおよび関連する香気成分の合成量が増加したと考えられた.また,AHASの制御サブユニットIlv6に保存されたN末端領域がValによる活性制御に関わることがわかった.酵母のAHASは,8分子のIlv6が中心となるコアを形成し,その周りにIlv2が1分子ずつ結合することで,脱炭酸反応を効率的に触媒する.また,ValがIlv6に結合すると複合体が不安定化し,Ilv2が解離すると脱炭酸活性が低下すると予想されている.Ilv6のN末端領域は離れた位置のサブユニットと相互作用することで,Ilv2-Ilv6複合体の安定化に寄与している.そのため,Ala31Thrの置換によってサブユニット間の相互作用が変化し,活性に影響が生じたと考えられる.さらに,清酒の小仕込み試験を行ったところ,変異株では親株と比較して清酒中のイソブタノールや酢酸イソブチルの含量が約1.5倍に増加し,この株を用いて独特な香味を有する清酒が醸造できる可能性が示された74).
3)イソロイシン(Ile)
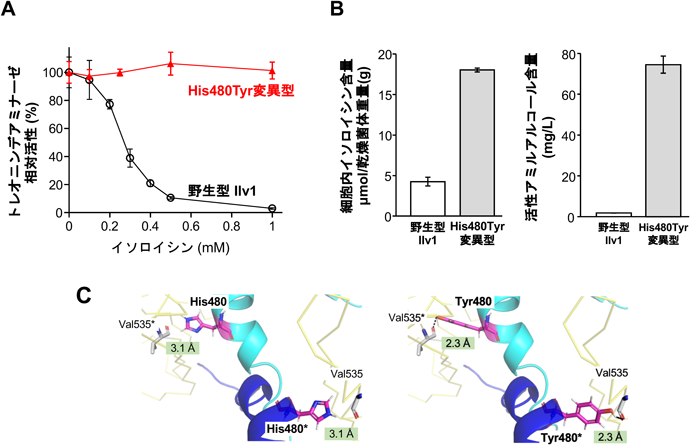
酵母のIleはトレオニンデアミナーゼ(TD)Ilv1によってトレオニンが脱アミノ化され,α-ケト酪酸が生成された後,他のBCAAと同じ経路で合成される(図6).また,Ileはエーリッヒ経路で代謝され,フーゼルアルコール(高級アルコール)の一種である活性アミルアルコールとなり,リンゴ様の香気成分である酢酸2-メチルブチルを生成する75).多くの生物では,TDの活性がIleによるフィードバック阻害を受けることで,Ile合成量が調節されているが,酵母におけるIlv1の活性調節機構はほとんど不明である75).
筆者らは,Ileの毒性アナログ(o-メチルトレオニン)に耐性を示す清酒酵母の変異株から,細胞内にIleを蓄積する株を取得した76).また,この株のILV1遺伝子に,新規のアミノ酸置換(His480Tyr)を伴うヘテロ変異を見いだした.His480Tyr変異型Ilv1ではIleによるフィードバック阻害感受性が大幅に低下し,野生型酵素の活性を完全に阻害するIle濃度においても活性が維持されていた(図9A).さらに,変異型Ilv1を発現する実験室酵母では,細胞内のIle含量と細胞外の活性アミルアルコール含量が野生型酵素の発現株に比べて有意に増加した(図9B).これらの結果は,Ilv1のアミノ酸置換(His480Tyr)がフィードバック阻害を解除し,Ileおよび関連する香気成分の高生産に寄与することを示している.His480は二つのACT様ドメイン間のリンカー領域に位置し,エフェクター結合部位から離れているが,さまざまなTDで高度に保存されている.Arg482も同じ領域にあり,塩基性アミノ酸として保存されているため,シロイヌナズナTDのArg499をCysに置換すると,フィードバック阻害が減少し,Ile含量が増加した.また,大腸菌TDの結晶構造から,リンカー領域は単量体間の水素結合ネットワークを形成し,アロステリック制御に関与することが示唆された.His480はオリゴマー構造内の相互作用を通じてアロステリック制御に関与し,変異型Ilv1では単量体間水素結合が形成され,TDのホモ二量体の安定化に寄与する可能性がある(図9C).Arg482の置換が局所的な構造変化やIleとの結合親和性の変化を引き起こすことも示唆された.さらに,Ile高産生株を用いた清酒の小仕込み試験では,親株に比べて清酒中のIle含量は変化しなかった.一方,活性アミルアルコールと酢酸2-メチルブチルの含量は親株に比べて大幅に増加しており,清酒の香味性が向上する可能性が示された76).
4)分岐鎖アミノ酸アミノトランスアミナーゼ(BCAT)
イソブタノール,イソアミルアルコール,活性アミルアルコールなどの分岐鎖高級アルコール(BCHA)は,香気成分や次世代バイオ燃料として有用である.酵母はBCAA代謝(エーリッヒ経路)を介してBCHAを合成し,BCAAアミノトランスアミナーゼ(BCAT)がBCHA合成の鍵となる酵素である.BCATはBCAAと分岐鎖α-ケト酸(BCKA)との双方向のアミノ転移反応を触媒しており,酵母には一次構造の相同性が高いミトコンドリア型Bat1とサイトゾル型Bat2が存在している(図6)77).
筆者らは,BCHAの生産性向上を目的に,変異型Bat1およびBat2をin silicoで設計した78).ヒト由来BCATの構造を鋳型にBat2のモデルを構築し,Bat2に結合するリガンドの5 Å以内の残基を抽出後,活性に関与しないと考えられる12残基を選抜した.12残基について,Bat2の安定性および基質結合親和性を高めると予想されるアミノ酸置換を設計した(Bat2:Gly316Ser, Gly316Trp)(Bat1:Gly333Ser, Gly333Trp).次に,各変異型酵素を酵母で発現させると,野生型酵素に比べて最少培地での生育が悪化したが,BCHA生産量が大幅に向上し,特にGly333Trp変異型Bat1, Gly316Ser変異型Bat2ではイソブタノールが約20倍に増加した.一方,各変異型酵素では,野生型酵素と比較してBCAA含量が有意に減少するとともに,基質(BCAA, BCKA)に対する活性が著しく低下しており,Glyから側鎖を有するSerやTrpへの置換により分子内相互作用が増えたためだと考えられた.以上の結果は,各変異型酵素の発現株ではBCAT活性の低下に伴って,BCAA合成経路が弱化し,BCHA合成が強化されたことを示唆しており,BCATの機能改変によってBCHA生産性が大幅な増加にした初めての例である78).
1)リシン(Lys)
筆者らは,Lysが酵母の冷凍後の生存率低下を抑制すること,大腸菌へのLysの添加やLys高生産株で高温耐性が向上することを見いだした9, 79).Lysによる高温耐性機構は不明であるが,Lys合成の促進は酵母の発酵力を向上させると予想される.酵母のLysはα-ケトグルタル酸から7段階の反応を経て合成され,初発酵素のホモクエン酸シンターゼ(HCS)Lys20の活性がLysによってフィードバック阻害を受けている.これまでに,Lys20にArg276Lys, Ser385Pheなどのアミノ酸置換を導入すると,フィードバック阻害感受性が低下し,Lysを過剰合成することが報告されている80).
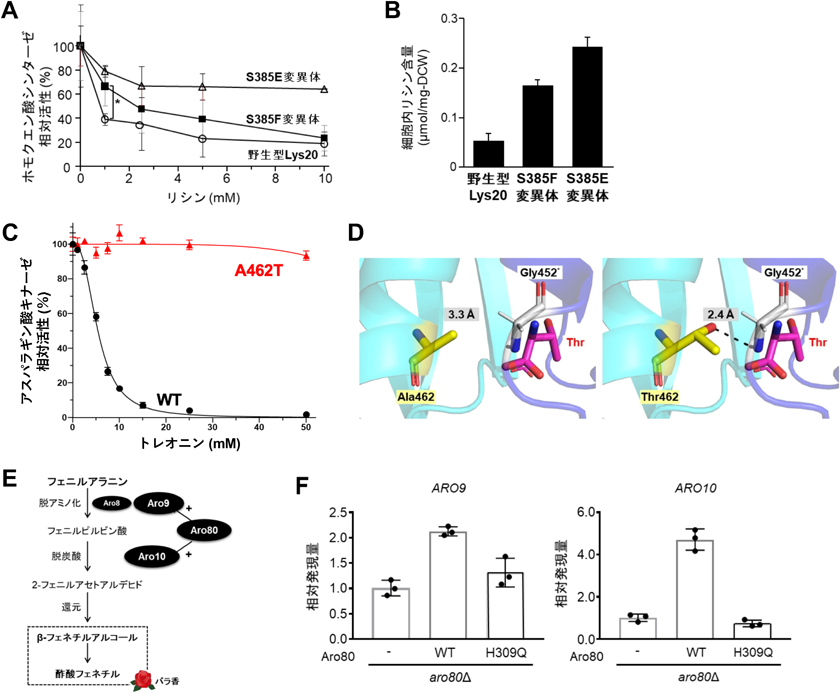
焼酎や泡盛などの蒸留酒の醸造では,アルコール発酵後の蒸留過程で大量の粕(蒸留粕)が副生する.蒸留粕の活用として家畜飼料が検討されているが,蒸留粕中のLys含量の不足が懸念される.蒸留粕には大量の酵母が含まれるため,Lys含量が増加した酵母を用いて蒸留酒を醸造すれば,Lysを多く含む蒸留粕も同時に製造できると考えられる.そこで筆者らは,Lysの毒性アナログ(S-アミノエチルシステイン)に耐性を示す泡盛酵母の変異株から,細胞内のLys含量が顕著に増加した株を単離した81).この株を解析した結果,LYS20遺伝子にSer385Pheのアミノ酸置換を伴うヘテロ変異を同定した.Lysは基質であるα-ケトグルタル酸と競合的にLys20に結合することでHCS活性を阻害する.そのため,変異型Lys20では野生型酵素と比較して,相対的にLys結合性が低下したため,フィードバック阻害感受性が低下すると予想した.Lys20の構造モデルを用いてリガンドの結合性を評価したところ,予想どおりSer385Pheの置換によりLysの相対的な結合性が低下した.さらに,Ser385をPhe以外のアミノ酸に置換したところ,Gluへの置換によってLysの相対的な結合性がさらに低下することが示唆された.また,Gluへの置換はPheよりもさらにフィードバック阻害感受性を低下させ(図10A),Ser385Glu変異型Lys20発現株ではLys生産性が約1.5倍に向上した(図10B)81).
2)トレオニン(Thr)
Thrは細菌によって発酵生産されており,食品・飼料・化粧品・医薬品に広く使用されている.酵母では,Thrは5段階の酵素反応によって,ホモセリンを介し,アスパラギン酸から合成される.また,Thrの合成経路はホモセリンからメチオニンに分岐し,さらにIleに変換される.アスパラギン酸キナーゼHom3はThr合成の初発反応を触媒し,ATPを用いてアスパラギン酸4-リン酸を産生する.Hom3の活性はThrによるフィードバック阻害を受けており,この反応がThr合成の律速段階となっている82).
筆者らは,Thrの毒性アナログ(ヒドロキシノルバリン)に耐性を示す実験室酵母の変異株から,細胞内Thr含量が親株の約4倍に増加した株を取得した83).同株にはHOM3遺伝子にAla462Thrのアミノ酸置換を伴うヘテロ変異が見いだされた.Ala462Thr変異型Hom3は,50 mMのThr存在下でも,フィードバック阻害感受性が有意に低下し,触媒能に影響はなかった.さらに,変異型Hom3を発現する酵母は,野生型酵素と比較して細胞内のThr含量が約3倍に増加した(図10C)83).Hom3のホモ二量体構造モデルでは,Ala462はThr結合部位から離れており,他の単量体のThr結合部位の残基と相互作用していない.Ala462がThrに置換されると,Thrの側鎖が別の単量体のGly452と水素結合を形成し,フィードバック阻害感受性が低下する(図10D).野生型Hom3のGly452はThrと相互作用しており,Ala462Thr変異型Hom3での相互作用はThr結合部位の構造を変化させ,Thrへの結合親和性を低下させる可能性がある.
3)フェニルアラニン(Phe)
酵母のPheはエーリッヒ経路を経て,バラ様の香りを示すフェネチルアルコールや酢酸フェネチルに変換される84).この経路において,芳香族アミノ酸アミノトランスフェラーゼAro9とフェニルピルビン酸デカルボキシラーゼAro10をそれぞれコードする遺伝子は,転写制御因子Aro80を介して芳香族アミノ酸によって誘導される(図10E)84).したがって,Aro80を介したAro9とAro10の転写制御によって,清酒中のPheやフェネチルアルコールの含量を調節できると考えられる.
筆者らは,Pheの毒性アナログ(p-フルオロフェニルアラニン)に耐性を示し,細胞内Phe含量が高い清酒酵母の変異株を単離した85).また,同株のARO80遺伝子に新規のアミノ酸置換(His309Gln)を伴うホモ変異を同定した.変異型Aro80を発現する実験室酵母は,清酒酵母の変異株と同様にPhe含量が有意に増加したことから,His309Glnの置換によりAro80の機能が失われ,ARO9とARO10の転写誘導が抑制された可能性がある.実際に,変異型Aro80はARO9とARO10のプロモーター領域に結合するが,両遺伝子の転写は誘導されなかった(図10F).以上の結果から,His309Glnの置換によりAro80の転写誘導活性が失われ,Pheが高生産されたと考えられる.また,清酒酵母のPhe高生産株を用いた小仕込み試験では,親株と比較して清酒中のPhe含量が大幅に増加したが,フェネチルアルコール含量は少し減少したことから,変異型Aro80による酒質の差別化が期待できる85).一方,ビール酵母においてもフェネチルアルコールを高生産する変異株を取得し,この株で醸造したクラフトビールが2022年に商品化された.
引用文献References
1) Ljungdahl, P.O. & Daignan-Fornier, B. (2012) Regulation of amino acid, nucleotide, and phosphate metabolism in Saccharomyces cerevisiae. Genetics, 190, 885–929.
2) Conrad, M., Schothorst, J., Kankipati, H.N., Van Zeebroeck, G., Rubio-Texeira, M., & Thevelein, J.M. (2014) Nutrient sensing and signaling in the yeast Saccharomyces cerevisiae. FEMS Microbiol. Rev., 38, 254–299.
3) Magasanik, B. & Kaiser, C.A. (2002) Nitrogen regulation in Saccharomyces cerevisiae. Gene, 290, 1–18.
4) Hinnebusch, A.G. (2005) Translational regulation of GCN4 and the general amino acid control of yeast. Annu. Rev. Microbiol., 59, 407–450.
5) Zhang, W., Du, G., Zhou, J., & Chen, J. (2018) Regulation of sensing, transportation, and catabolism of nitrogen sources in Saccharomyces cerevisiae. Microbiol. Mol. Biol. Rev., 82, e00040-17.
6) Bianchi, F., van’t Klooster, J.S., Ruiz, S.J., & Poolman, B. (2019) Regulation of amino acid transport in Saccharomyces cerevisiae. Microbiol. Mol. Biol. Rev., 83, e00024-19.
7) Vanhoof, G., Goossens, F., De Meester, I., Hendrike, D., & Schärpé, S. (1995) Proline motifs in peptides and their biological processing. FASEB J., 9, 736–744.
8) Takagi, H. (2008) Proline as a stress protectant in yeast: Physiological functions, metabolic regulations, and biotechnological applications. Appl. Microbiol. Biotechnol., 81, 211–223.
9) Takagi, H., Iwamoto, F., & Nakamori, S. (1997) Isolation of freeze-tolerant laboratory strains of Saccharomyces cerevisiae from proline-analogue-resistant mutants. Appl. Microbiol. Biotechnol., 47, 405–411.
10) Morita, Y., Nakamori, S., & Takagi, H. (2003) L-Proline accumulation and freeze tolerance of Saccharomyces cerevisiae are caused by a mutation in the PRO1 gene encoding γ-glutamyl kinase. Appl. Environ. Microbiol., 69, 212–219.
11) Sekine, T., Kawaguchi, A., Hamano, Y., & Takagi, H. (2007) Desensitization of feedback inhibition of the Saccharomyces cerevisiae γ-glutamyl kinase enhances proline accumulation and freezing tolerance. Appl. Environ. Microbiol., 73, 4011–4019.
12) Murakami, N., Kotaka, A., Isogai, S., Ashida, K., Nishimura, A., Matsumura, K., Hata, Y., Ishida, H., & Takagi, H. (2020) Effects of a novel variant of the yeast γ-glutamyl kinase Pro1 on its enzymatic activity and sake brewing. J. Ind. Microbiol. Biotechnol., 47, 715–723.
13) Nishimura, A., Takasaki, Y., Isogai, S., Toyokawa, Y., Tanahashi, R., & Takagi, H. (2021) Role of Gln79 in feedback inhibition of the yeast γ-glutamyl kinase by proline. Microorganisms, 9, 1902.
14) Valero, E., Millán, C., Ortega, J.M., & Mauricio, J.C. (2003) Concentration of amino acids in wine after the end of fermentation by Saccharomyces cerevisiae strains. J. Sci. Food Agric., 83, 830–835.
15) Nishimura, A., Tanikawa, T., & Takagi, H. (2020) Inhibitory effect of arginine on proline utilization in Saccharomyces cerevisiae. Yeast, 37, 531–540.
16) Tanahashi, R., Nishimura, A., Morita, F., Nakazawa, H., Taniguchi, A., Ichikawa, K., Nakagami, K., Boundy-Mills, K., & Takagi, H. (2023) The arginine transporter Can1 acts as a transceptor for regulation of proline utilization in the yeast Saccharomyces cerevisiae. Yeast, 40, 333–348.
17) Nishimura, A., Tanahashi, R., & Takagi, H. (2020) The yeast α-arrestin Art3 is a key regulator for arginine-induced endocytosis of the high-affinity proline transporter Put4. Biochem. Biophys. Res. Commun., 531, 416–421.
18) Van Zeebroeck, G., Demuyser, L., Zhang, Z., Cottignie, L., & Thevelein, J.M. (2020) Nutrient sensing and cAMP signaling in yeast: G-protein coupled receptor versus transceptor activation of PKA. Microb. Cell, 8, 17–27.
19) Nishimura, A., Ichikawa, K., Nakazawa, H., Tanahashi, R., Morita, F., Sitepu, I., Boundy-Mills, K., Fox, G., & Takagi, H. (2022) The Cdc25/Ras/cAMP-dependent protein kinase A signaling pathway regulates proline utilization in wine yeast Saccharomyces cerevisiae under a wine fermentation model. Biosci. Biotechnol. Biochem., 86, 1318–1326.
20) Nishimura, A., Tanahashi, R., Nakazawa, H., Oi, T., Mima, M., & Takagi, H. (2023) PKA-Msn2/4-Shy1 cascade controls inhibition of proline utilization under wine fermentation model. J. Biosci. Bioeng., 136, 438–442.
21) Tanahashi, R., Nishimura, A., Nguyen, M., Sitepu, I., Fox, G., Boundy-Mills, K., & Takagi, H. (2023) Large-scale screening of yeast strains that can utilize proline. Biosci. Biotechnol. Biochem., 87, 358–362.
22) Tanahashi, R., Nishimura, A., Nguyen, M., Sitepu, I., Fox, G., Boundy-Mills, K., & Takagi, H. (2023) Isolation of yeast strains with higher proline uptake and their applications to beer fermentation. J. Fungi (Basel), 9, 1137.
23) 高木博史(2008)酵母におけるプロリンの生理機能と代謝調節機構—生物のストレス適応戦略の応用をめざして.蛋白質核酸酵素,53, 249–255.
24) Takagi, H., Taguchi, J., & Kaino, T. (2016) Proline accumulation protects Saccharomyces cerevisiae cells in stationary phase from ethanol stress by reducing reactive oxygen species level. Yeast, 33, 355–363.
25) Takagi, H., Sakai, K., Morida, K., & Nakamori, S. (2000) Proline accumulation by mutation or disruption of the proline oxidase gene improves resistance to freezing and desiccation stresses in Saccharomyces cerevisiae. FEMS Microbiol. Lett., 184, 103–108.
26) Morita, Y., Nakamori, S., & Takagi, H. (2002) Effect of proline and arginine metabolism on freezing stress of Saccharomyces cerevisiae. J. Biosci. Bioeng., 94, 390–394.
27) Terao, Y., Nakamori, S., & Takagi, H. (2003) Gene dosage effect of L-proline biosynthetic enzymes on L-proline accumulation and freeze tolerance in Saccharomyces cerevisiae. Appl. Environ. Microbiol., 69, 6527–6532.
28) Takagi, H., Takaoka, M., Kawaguchi, A., & Kubo, Y. (2005) Effect of L-proline on sake brewing and ethanol stress in Saccharomyces cerevisiae. Appl. Environ. Microbiol., 71, 8656–8662.
29) Matsuura, K. & Takagi, H. (2005) Vacuolar functions are involved in stress-protective effect of intracellular proline in Saccharomyces cerevisiae. J. Biosci. Bioeng., 100, 538–544.
30) Mukai, Y., Kamei, Y., Liu, X., Jiang, S., Sugimoto, Y., Mat Nanyan, N.S.B., Watanabe, D., & Takagi, H. (2019) Proline metabolism regulates replicative lifespan in the yeast Saccharomyces cerevisiae. Microb. Cell, 6, 482–490.
31) Nishimura, A., Yoshikawa, Y., Ichikawa, K., Takemoto, T., Tanahashi, R., & Takagi, H. (2021) Longevity regulation by proline oxidation in yeast. Microorganisms, 9, 1650.
32) Shima, J. & Takagi, H. (2009) Stress-tolerance of baker’s-yeast (Saccharomyces cerevisiae) cells: Stress-protective molecules and genes involved in stress tolerance. Biotechnol. Appl. Biochem., 53, 155–164.
33) Kaino, T., Tateiwa, T., Mizukami-Murata, S., Shima, J., & Takagi, H. (2008) Self-cloning baker’s yeasts that accumulate proline enhance freeze tolerance in doughs. Appl. Environ. Microbiol., 74, 5845–5849.
34) Sasano, Y., Haitani, Y., Ohtsu, I., Shima, J., & Takagi, H. (2012) Proline accumulation in baker’s yeast enhances high-sucrose stress tolerance and fermentation ability in sweet dough. Int. J. Food Microbiol., 152, 40–43.
35) Sasano, Y., Haitani, Y., Hashida, K., Ohtsu, I., Shima, J., & Takagi, H. (2012) Simultaneous accumulation of proline and trehalose in industrial baker’s yeast enhances fermentation ability in frozen dough. J. Biosci. Bioeng., 113, 592–595.
36) Tsolmonbaatar, A., Hashida, K., Sugimoto, Y., Watanabe, D., Furukawa, S., & Takagi, H. (2016) Isolation of baker’s yeast mutants with proline accumulation that showed enhanced tolerance to baking-associated stresses. Int. J. Food Microbiol., 238, 233–240.
37) Takagi, H., Matsui, F., Kawaguchi, A., Wu, H., Shimoi, H., & Kubo, Y. (2007) Construction and analysis of self-cloning sake yeasts that accumulate proline. J. Biosci. Bioeng., 103, 377–380.
38) Takagi, H., Shichiri, M., Takemura, M., Mohri, M., & Nakamori, S. (2000) Saccharomyces cerevisiae Σ1278b has novel genes of the N-acetyltransferase gene superfamily required for L-proline analogue resistance. J. Bacteriol., 182, 4249–4256.
39) Shichiri, M., Hoshikawa, C., Nakamori, S., & Takagi, H. (2001) A novel acetyltransferase found in Saccharomyces cerevisiae Σ1278b that detoxifies a proline analogue, azetidine-2-carboxylic acid. J. Biol. Chem., 276, 41998–42002.
40) Kimura, Y., Nakamori, S., & Takagi, H. (2002) Polymorphism of the MPR1 gene required for toxic proline analogue resistance in the Saccharomyces cerevisiae complex species. Yeast, 19, 1437–1445.
41) Nomura, M., Nakamori, S., & Takagi, H. (2003) Characterization of novel acetyltransferases found in budding and fission yeasts that detoxify a proline analogue, azetidine-2-carboxylic acid. J. Biochem., 133, 67–74.
42) Kotani, T. & Takagi, H. (2008) Identification of amino acid residues essential for the yeast N-acetyltransferase Mpr1 activity by site-directed mutagenesis. FEMS Yeast Res., 8, 607–614.
43) Wada, M., Okabe, K., Kataoka, M., Shimizu, S., Yokota, A., & Takagi, H. (2008) Distribution of L-azetidine-2-carboxylate N-acetyltransferase in yeast. Biosci. Biotechnol. Biochem., 72, 582–586.
44) Hoa, B.T., Hibi, T., Nasuno, R., Matsuo, G., Sasano, Y., & Takagi, H. (2012) Production of N-acetyl cis-4-hydroxy-L-proline by the yeast N-acetyltransferase Mpr1. J. Biosci. Bioeng., 114, 160–165.
45) Nomura, M. & Takagi, H. (2004) Role of the yeast acetyltransferase Mpr1 in oxidative stress: Regulation of oxygen reactive species caused by a toxic proline catabolism intermediate. Proc. Natl. Acad. Sci. USA, 101, 12616–12621.
46) Du, X. & Takagi, H. (2005) N-Acetyltransferase Mpr1 confers freeze tolerance on Saccharomyces cerevisiae by reducing reactive oxygen species. J. Biochem., 138, 391–397.
47) Du, X. & Takagi, H. (2007) N-Acetyltransferase Mpr1 confers ethanol tolerance on Saccharomyces cerevisiae by reducing reactive oxygen species. Appl. Microbiol. Biotechnol., 75, 1343–1351.
48) Nishimura, A., Kotani, T., Sasano, Y., & Takagi, H. (2010) An antioxidative mechanism mediated by the yeast N-acetyltransferase Mpr1: Oxidative stress-induced arginine synthesis and its physiological role. FEMS Yeast Res., 10, 687–698.
49) 那須野亮,高木博史(2019)酵母に見出したN-アセチルトランスフェラーゼMpr1の分子機能.酵素工学ニュース,82, 32–38.
50) Nasuno, R., Hirase, S., Norifune, S., Watanabe, D., & Takagi, H. (2016) Structure-based molecular design for thermostabilization of N-acetyltransferase Mpr1 involved in a novel pathway of L-arginine synthesis in yeast. J. Biochem., 159, 271–277.
51) Shima, J., Sakata-Tsuda, Y., Suzuki, Y., Nakajima, R., Watanabe, H., Kawamoto, S., & Takano, H. (2003) Disruption of the CAR1 gene encoding arginase enhances freeze tolerance of the commercial baker’s yeast Saccharomyces cerevisiae. Appl. Environ. Microbiol., 69, 715–718.
52) Nasuno, R., Hirano, Y., Itoh, T., Hakoshima, T., Hibi, T., & Takagi, H. (2013) Structural and functional analysis of the yeast N-acetyltransferase Mpr1 involved in oxidative stress tolerance via proline metabolism. Proc. Natl. Acad. Sci. USA, 110, 11821–11826.
53) Iinoya, K., Kotani, T., Sasano, Y., & Takagi, H. (2009) Engineering of the yeast antioxidant enzyme Mpr1 for enhanced activity and stability. Biotechnol. Bioeng., 103, 341–352.
54) Sasano, Y., Takahashi, S., Shima, J., & Takagi, H. (2010) Antioxidant N-acetyltransferase Mpr1/2 of industrial baker’s yeast enhances fermentation ability after air-drying stress in bread dough. Int. J. Food Microbiol., 138, 181–185.
55) Ohashi, M., Nasuno, R., Watanabe, D., & Takagi, H. (2019) Stable N-acetyltransferase Mpr1 improves ethanol productivity in the sake yeast Saccharomyces cerevisiae. J. Ind. Microbiol. Biotechnol., 46, 1039–1045.
56) Ogawa-Mitsuhashi, K., Sagane, K., Kuromitsu, J., Takagi, H., & Tsukahara, K. (2009) MPR1 as a novel selection marker in Saccharomyces cerevisiae. Yeast, 26, 587–593.
57) Zhang, X.H., Takagi, H., & Widholm, J.M. (2004) Expression of a novel yeast gene that detoxifies the proline analog azetidine-2-carboxylate confers resistance during tobacco seed germination, callus and shoot formation. Plant Cell Rep., 22, 615–622.
58) Tsai, F.Y., Zhang, X.H., Ulanov, A., & Widholm, J.M. (2010) The application of the yeast N-acetyltransferase MPR1 gene and the proline analogue L-azetidine-2-carboxylic acid as a selectable marker system for plant transformation. J. Exp. Bot., 61, 2561–2573.
59) Bach, T.M., Hara, R., Kino, K., Ohtsu, I., Yoshida, N., & Takagi, H. (2013) Microbial production of N-acetyl cis-4-hydroxy-L-proline by coexpression of the Rhizobium L-proline cis-4-hydroxylase and the yeast N-acetyltransferase Mpr1. Appl. Microbiol. Biotechnol., 97, 247–257.
60) Kokubo, T., Ikeshima, E., Kirisako, T., Miura, Y., Horiuchi, M., & Tsuda, A. (2013) A randomized, double-masked, placebo-controlled crossover trial on the effects of L-ornithine on salivary cortisol and feelings of fatigue of flushers the morning after alcohol consumption. Biopsychosoc. Med., 7, 6.
61) Ohashi, M., Nasuno, R., Isogai, S., & Takagi, H. (2020) High-level production of ornithine by expression of the feedback inhibition-insensitive N-acetyl glutamate kinase in the sake yeast Saccharomyces cerevisiae. Metab. Eng., 62, 1–9.
62) Ohashi, M., Isogai, S., & Takagi, H. (2022) Functional analysis of feedback inhibition-insensitive variants of N-acetyl glutamate kinase Found in sake yeast mutants with ornithine overproduction. Microbiol. Spectr., 10, e00822-22.
63) Oba, T., Nomiyama, S., Hirakawa, H., Tashiro, K., & Kuhara, S. (2005) Asp578 in LEU4p is one of the key residues for leucine feedback inhibition release in sake yeast. Biosci. Biotechnol. Biochem., 69, 1270–1273.
64) Watanabe, M., Fukuda, K., Asano, K., & Ohta, S. (1990) Improvement of fusel alcohol production by engineering of the yeast branched-chain amino acid aminotransaminase. Appl. Microbiol. Biotechnol., 34, 154–159.
65) Takagi, H., Hashida, K., Watanabe, D., Nasuno, R., Ohashi, M., Iha, T., Nezuo, M., & Tsukahara, M. (2015) Isolation and characterization of awamori yeast mutants with L-leucine accumulation that overproduce isoamyl alcohol. J. Biosci. Bioeng., 119, 140–147.
66) Abe, T., Toyokawa, Y., Sugimoto, Y., Azuma, H., Tsukahara, K., Nasuno, R., Watanabe, D., Tsukahara, M., & Takagi, H. (2019) Characterization of a new Saccharomyces cerevisiae isolated from hibiscus flower and its mutant with L-leucine accumulation for awamori brewing. Front. Genet., 10, 490.
67) Tsukahara, M., Isogai, S., Azuma, H., Tsukahara, K., Toyokawa, Y., & Takagi, H. (2023) Characterization of a new Saccharomyces cerevisiae isolated from banana stems and its mutant with L-leucine accumulation for awamori brewing. Biosci. Biotechnol. Biochem., 87, 240–244.
68) 阿部峻之,豊川洋一,塚原正俊,高木博史(2020)ハイビスカス花から単離した酵母の特性と泡盛醸造への応用.バイオサイエンスとインダストリー,78, 18–20.
69) Barak, Z. & Chipman, D.M. (2012) Allosteric regulation in acetohydroxyacid synthases (AHASs)—Different structures and kinetic behavior in isozymes in the same organisms. Arch. Biochem. Biophys., 519, 167–174.
70) Pang, S.S. & Duggleby, R.G. (1999) Expression, purification, characterization, and reconstitution of the large and small subunits of yeast acetohydroxyacid synthase. Biochemistry, 38, 5222–5231.
71) Kaplun, A., Vyazmensky, M., Zherdev, Y., Belenky, I., Slutzker, A., Mendel, S., Barak, Z., Chipman, D.M., & Shaanan, B. (2006) Structure of the regulatory subunit of acetohydroxyacid synthase isozyme III from Escherichia coli. J. Mol. Biol., 357, 951–963.
72) Takpho, N., Watanabe, D., & Takagi, H. (2018) High-level production of valine by expression of the feedback inhibition-insensitive acetohydroxyacid synthase in Saccharomyces cerevisiae. Metab. Eng., 46, 60–67.
73) Hazelwood, L.A., Daran, J.M., Van Maris, A.J.A., Pronk, J.T., & Dickinson, J.R. (2008) The Ehrlich pathway for fusel alcohol production: A century of research on Saccharomyces cerevisiae metabolism. Appl. Environ. Microbiol., 74, 2259–2266.
74) Isogai, S., Nishimura, A., Murakami, N., Hotta, N., Kotaka, A., Toyokawa, Y., Ishida, H., & Takagi, H. (2023) Improvement of valine and isobutanol production in sake yeast by Ala31Thr substitution in the regulatory subunit of acetohydroxy acid synthase. FEMS Yeast Res., 23, foad012.
75) Holmberg, S. & Petersen, J.G. (1988) Regulation of isoleucine-valine biosynthesis in Saccharomyces cerevisiae. Curr. Genet., 13, 207–217.
76) Isogai, S., Nishimura, A., Kotaka, A., Murakami, N., Hotta, N., Ishida, H., & Takagi, H. (2022) High-level production of isoleucine and fusel alcohol by expression of the feedback inhibition-insensitive threonine deaminase in Saccharomyces cerevisiae. Appl. Environ. Microbiol., 88, e02130-21.
77) Toyokawa, Y., Koonthongkaew, J., & Takagi, H. (2021) An overview of branched-chain amino acid aminotransferases: Functional differences between mitochondrial and cytosolic isozymes in yeast and human. Appl. Microbiol. Biotechnol., 105, 8059–8072.
78) Koonthongkaew, J., Ploysongsri, N., Toyokawa, Y., Ruangpornvisuti, V., & Takagi, H. (2022) Improvement of fusel alcohol production by engineering of the yeast branched-chain amino acid aminotransaminase. Appl. Environ. Microbiol., 88, e0055722.
79) Isogai, S. & Takagi, H. (2021) Enhancement of lysine biosynthesis confers high-temperature stress tolerance to Escherichia coli cells. Appl. Microbiol. Biotechnol., 105, 6899–6908.
80) Quezada, H., Marín-Hernández, A., Aguilar, D., López, G., Gallardo-Pérez, J.C., Jasso-Chávez, R., González, A., Saavedra, E., & Moreno-Sánchez, R. (2011) The Lys20 homocitrate synthase isoform exerts most of the flux control over the lysine synthesis pathway in Saccharomyces cerevisiae. Mol. Microbiol., 82, 578–590.
81) Isogai, S., Matsushita, T., Imanishi, H., Koonthongkaew, J., Toyokawa, Y., Nishimura, A., Yi, X., Kazlauskas, R., & Takagi, H. (2021) High-level production of lysine in the yeast Saccharomyces cerevisiae by rational design of homocitrate synthase. Appl. Environ. Microbiol., 87, e00600-21.
82) Marina, P., Martínez-Costa, O.H., Calderón, I.L., & Aragón, J.J. (2004) Characterization of the aspartate kinase from Saccharomyces cerevisiae and of its interaction with threonine. Biochem. Biophys. Res. Commun., 321, 584–591.
83) Isogai, S., Nishimura, A., Inoue, A., Sonohara, S., Tsugukuni, T., Okada, T., & Takagi, H. (2024) Functional analysis of feedback inhibition-insensitive aspartate kinase identified in a threonine-accumulating mutant of Saccharomyces cerevisiae. Appl. Environ. Microbiol., 90, e00155-24.
84) Stark, D., Münch, T., Sonnleitner, B., Marison, I.W., & von Stockar, U. (2002) Extractive bioconversion of 2-phenylethanol from L-phenylalanine by Saccharomyces cerevisiae. Biotechnol. Prog., 18, 514–523.
85) Nishimura, A., Isogai, S., Murakami, N., Hotta, N., Kotaka, A., Matsumura, K., Hata, Y., Ishida, H., & Takagi, H. (2022) Isolation and analysis of a sake yeast mutant with phenylalanine accumulation. J. Ind. Microbiol. Biotechnol., 49, kuab085.
86) Takagi, H. & Ohtsu, I. (2017) L-Cysteine metabolism and fermentation in microorganisms. In Amino Acid Fermentation (Yokota, A. & Ikeda, M. eds.), pp. 129–152, Springer.
87) 西村明(2021)寿命・老化における超硫黄分子の役割.生化学,93, 717–722.
88) Takagi, H. (2019) Metabolic regulatory mechanisms and physiological roles of functional amino acids and their applications in yeast. Biosci. Biotechnol. Biochem., 83, 1449–1462.
89) Takagi, H. (2021) Adventures in brewing exotic Japanese alcoholic beverages with amino acid-rich yeast. SIMB News, 71, 8–17.
90) 高木博史(2024)微生物の代謝調節・細胞機能に関する基盤的研究と発酵・醸造への応用.生物工学会誌,102, 2–17.