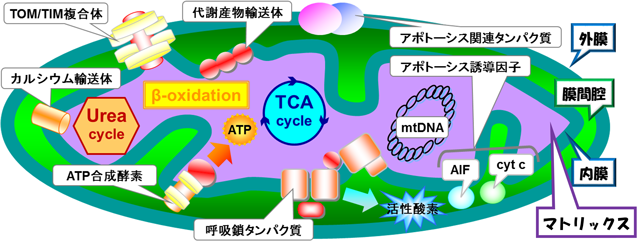
ミトコンドリアは,外膜・内膜からなる2層の膜構造を有しており,電子伝達系の存在する膜間腔領域とmtDNAの存在するマトリックス領域から構成されている.ミトコンドリアの外膜は分子量5000までの低分子を非特異的に透過させるが,内膜において膜透過性に対する抵抗性がきわめて高く薬物の送達は非常に困難である.ミトコンドリアへの薬物送達を達成するためには,細胞質まで送達された薬物をこの鉄壁のバリアを乗り越えて,ミトコンドリア内部まで送達しなければならない.ここでは,現在までに報告されているミトコンドリアを標的としたDDSをいくつか紹介する(図2).
1)低分子薬物の送達
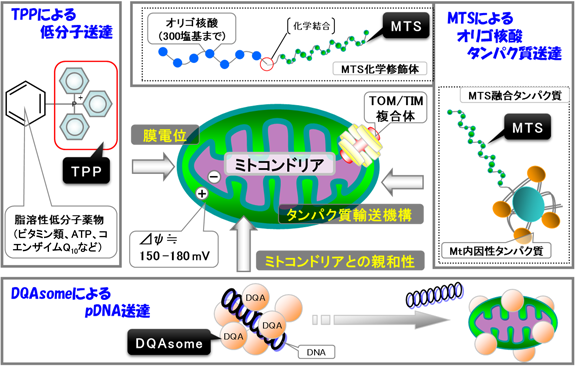
ミトコンドリアを標的とした治療薬として,活性酸素を除去するビタミンEやATP産生を増強するCoenzyme Q10が製剤化されているが,治療効果が低くDDSに課題が残っているのが現状である.これらの製剤は薬物キャリアを使用していないため,薬物の組織移行,細胞導入,細胞内動態の過程が能動的には制御されておらず,十分な治療効果を得ることができない.Smithらは,脂溶性カチオン物質(lipophilic triphenylphosphonium cation:TPP)をビタミンEに化学結合させることで,ミトコンドリアに効率的に送達することに成功している6).彼らは,ミトコンドリアが非常に大きな負の電位を有することに着目し,正電荷を有するTPPとの静電的相互作用によってミトコンドリア膜を介して脂溶性低分子薬物を取り込ませる戦略をとった6).また,彼らはCoenzyme Q10にTPPを結合させた薬剤MitoQの研究も行っている7).MitoQはミトコンドリアの電子伝達系で還元されて,活性型のユビキノール型に変化する.ユビキノールは,ミトコンドリアを活性酸素のダメージから保護する作用がある.彼らは,MitoQの経口投与が,ミトコンドリア由来の活性酸素の産生を減少させることを報告している7).本戦略はビタミンEのような脂溶性低分子薬物の送達に有用であるが,ミトコンドリア膜を通過する戦略のため,薬物の「分子量,物性」を考慮する必要がある.
2)ミトコンドリア移行性ペプチドMTSを用いた薬物送達
a.MTSを介したミトコンドリアタンパク質輸送機構
ミトコンドリアには,約1000種のタンパク質が存在しており,そのタンパク質の99%以上は核DNA由来のタンパク質である8).核DNA由来のミトコンドリアタンパク質には,ミトコンドリア移行能を有するアミノ酸配列であるmitochondrial targeting sequence(MTS)が備わっており,これらのタンパク質をミトコンドリアまで誘導する.MTSには,タンパク質のN末端側に配置されたタイプのamino-terminal MTS(N-MTS)とタンパク質の内部に配置されたタイプのinternal MTS(INT-MTS)がある9, 10).N-MTSは,20~30残基のアミノ酸から構成されており,特定の配列は存在しておらず個々のタンパク質によって異なる.種々のミトコンドリアタンパク質が有するN-MTSの共通点は,塩基性,水溶性,疎水性アミノ酸から構成された両親媒性のαへリックス構造を有する点くらいしかなく,アミノ酸配列の明確な意義づけはできていない.N-MTSは,主に膜間腔,内膜,マトリックスへのタンパク質輸送を担っている.一方,INT-MTSは,主に外膜,内膜へのタンパク質輸送を行うことが報告されているが,その配列の特徴づけはできていない.ここではミトコンドリア分子送達ツールとして利用され,タンパク質および核酸の送達例が報告されているN-MTSの輸送機構を説明する.
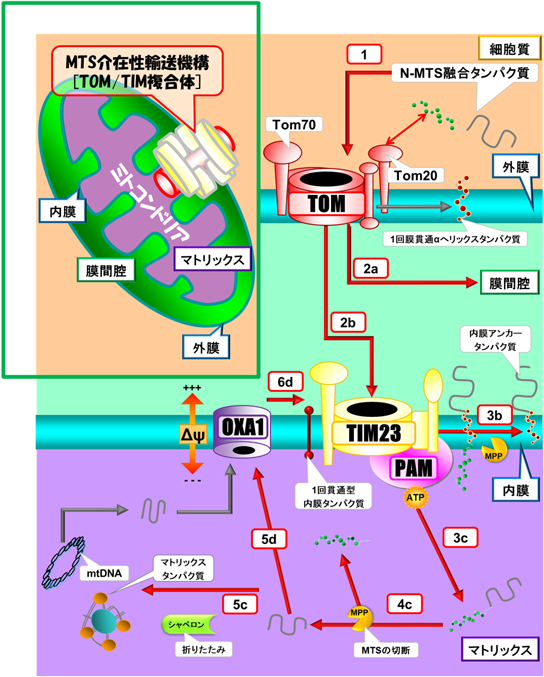
ミトコンドリアタンパク質のミトコンドリア内への輸送は,ミトコンドリア外膜上に存在するtranslocator of mitochondrial outer membrane(TOM)に,MTSが認識されることから始まる(図3)9).TOMは,複数種のタンパク質から構成されたミトコンドリア外膜上のチャネルであり,その透過孔の直径はわずか2~2.5 nmといわれている.したがって,タンパク質がミトコンドリア内に輸送されるためには,TOMが形成する非常に小さな透過孔を通過する必要があり,高次構造からアンフォールディング構造となる必要がある.また,ミトコンドリアタンパク質は,TOMを通過する際にミトコンドリアのどの領域に輸送されるのかが決定される.つまり,TOMはミトコンドリアタンパク質の共通の入場ゲートであり,タンパク質に外膜,内膜,膜間腔,マトリックスのいずれかの行き先が記されたチケットを配布する役割を担っている.N-MTSを有するタンパク質は,TOM複合体のTom20タンパク質から膜間腔,内膜,マトリックス行きのいずれかのチケットを受け取る(図3).
N-MTS融合タンパク質は,TOMを通過した後に膜間腔領域に輸送されるか(経路2a,図3),またはミトコンドリア内膜上に存在するtranslocator of mitochondrial inner membrane(TIM)の一つであるTIM23に輸送される(経路2b,図3).TIM23は,複数種のタンパク質から形成されたミトコンドリア内膜上のチャネルであり,その直径は1.3~1.4 nmと非常に小さい.TIM23は,輸送されてきたN-MTS融合タンパク質を,N-MTSの特性に合わせてミトコンドリア内膜またはミトコンドリアマトリックスへと振り分ける.マトリックスタンパク質は,presequence translocase-associated motor(PAM)のATP依存的な駆動力により,TIM23を通過してマトリックス内まで輸送される.マトリックスに輸送されたタンパク質は,速やかにN-MTSがmitochondrial processing peptidase(MPP)によって切断され,シャペロンを介し高次構造を再構築する(経路3c–4c–5c,図3)9).
内膜への輸送経路は2通り報告されており,“stop-transfer”配列による輸送(経路3b,図3),またはOxa1を介した輸送経路が存在する(経路3c–4c–5d–6d,図3).stop-transfer配列は,N-MTSとタンパク質の間に存在する疎水性の高いアミノ酸から構成された配列である.この配列を有するタンパク質は,TIM23を通過する際に輸送が中断され,そのままミトコンドリア内膜上に移動する11).別経路のOxa1を介した輸送は,一度マトリックスまで送達されたタンパク質をミトコンドリア内膜上に送達する輸送経路である.Oxa1はmtDNA由来のタンパク質を内膜に送達する輸送機構としても機能している12).
b.MTSによる薬物送達の有用性とその限界
MTSを用いたタンパク質送達は選択的かつ効率的なため,ミトコンドリアを標的とした薬物送達戦略として非常に有望である.MTSによるタンパク質送達研究の大部分は,MTSと送達タンパク質を融合させた遺伝子をコードするプラスミドDNA(pDNA)を作製し,標的細胞内でMTS融合タンパク質を発現させ,ミトコンドリアへ送達させる手法で達成されている.この手法により,本来はミトコンドリアに存在しない細胞質タンパク質や,蛍光タンパク質green fluorescent protein(GFP)などの送達が可能であることが報告されており,さまざまな外来タンパク質のミトコンドリア送達においてMTSが有用なツールであると期待されている.Zhangらは,本手法を利用して培養細胞のミトコンドリアへGFP変異体を送達することに成功し,ミトコンドリアに送達されたタンパク質の光刺激特性の解析を実施している13).
また,Tanakaらは,MTSを利用した制限酵素SmaIのミトコンドリア送達および遺伝子治療戦略の検証を実施している.SmaIはミトコンドリア病のneurogenic muscle weakness, ataxia and retinitis pigmentosa disease(NARP)やLeigh病の遺伝子診断に使用される制限酵素である.NARPおよびLeigh病患者はエネルギー産生にかかわるミトコンドリアタンパク質をコードするmtDNA領域に点変異を有しており,変異mtDNAはSmaIで切断され,正常mtDNA配列は切断されない.そのため,ミトコンドリア内部にSmaIを送達することで変異型mtDNAのみを切断し,正常mtDNAの比率を増加させる疾患治療が可能となる.彼らは,MTS融合SmaIを患者由来細胞で発現させ,変異型mtDNAの分解およびエネルギー産生を回復させることに成功している.
MTSによる送達は非常に魅力的であるが,いくつかの制限があるため万能の送達ツールとはいえない.MTSによる送達は非常に狭い透過孔を通過するため,送達分子の大きさを制限し高次構造を有するmtDNAなどの送達は不可能である14).また,mtDNA由来のタンパク質(呼吸鎖関連タンパク質)は疎水性が非常に高いためアンフォールディング構造を形成できず,TOM/TIM複合体を介したミトコンドリア内への送達は不可能である15).したがって,MTSを用いた送達戦略では,ミトコンドリア病の大半を占める呼吸鎖異常の治療は困難である.また,ミトコンドリアタンパク質輸送機構が機能異常を示すX-linked human deafness-dystonia syndromeも報告されており16),MTSによる送達戦略が適応不可能な疾患も多数存在する.
3)ミトコンドリアへの核酸送達
ヒトmtDNAは16,569 bpの環状DNAであり,呼吸鎖関連タンパク質とこれらのタンパク質を翻訳する際に必要なrRNAとtRNAのみをコードしている8).mtDNA由来のタンパク質はわずか13個しか存在せず,mtDNAはこの極少数のタンパク質を産生するためにのみ存在していることになる.しかしながら,これらのミトコンドリアタンパク質はエネルギー産生に必須であり,これらの変異・欠損がミトコンドリア病の原因となることが非常に多い.そのため,ミトコンドリアを標的とした遺伝子治療は,ミトコンドリアの重要な機能であるエネルギー産生に関連したさまざまな疾患を治療する可能性を秘めている.遺伝子治療で先行している核を標的とした研究では,オリゴ核酸を用いた遺伝子修復治療やアンチセンス治療,または目的遺伝子を導入する遺伝子送達療法などが行われている.これらのコンセプトは,ミトコンドリアへの適応も可能であり,オリゴ核酸やmtDNAの送達はミトコンドリアを標的とした遺伝子治療を実現するために必須の課題である.
オリゴ核酸の送達においては,MTSを化学結合することで単離ミトコンドリア内への送達が可能であるということをSeibelらが報告している17, 18).彼らは,さらにMTS結合型のpeptide nucleic acid(PNA)も調製し,生細胞ミトコンドリアへの選択的な送達が可能であることを細胞内動態観察より確認している.今後は,オリゴ核酸送達の検証だけではなく,薬理作用としての遺伝子修復効果,アンチセンス効果などの報告が期待される.
環状DNA送達研究においては,Weissigらが開発したミトコンドリア膜と親和性の高いカチオニックリポソーム,DQAsomeを用いた戦略が報告されている19, 20).DQAsomeとDNAのリポプレックス(DQAplexes)は,ミトコンドリア膜と接触したときにDNAを放出するように設計されている.彼らは,生細胞内においてもDQAsomeが機能し,ミトコンドリア近傍までDNAを送達することを確認している.本送達戦略はミトコンドリアを標的とした遺伝子送達キャリアとして非常に画期的な戦略であるが,ミトコンドリア近傍のDNAがミトコンドリア内に送達される可能性はきわめて低く,今後,さらなるキャリアの改善が期待されている.
3. ミトコンドリアDDS(MITO-Porter)の創製
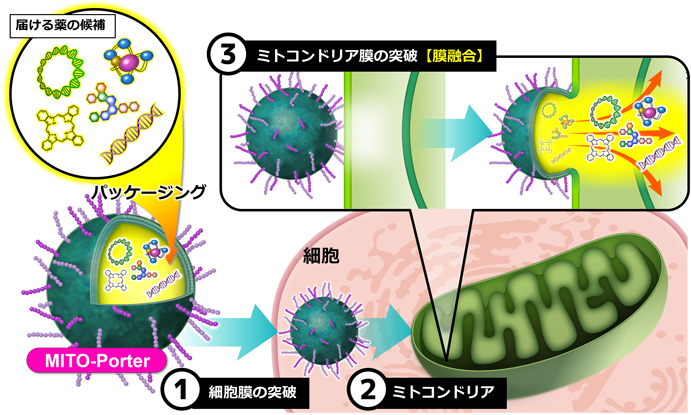
本稿で紹介してきたMTSのようなミトコンドリア標的化素子は,ミトコンドリアへの薬物送達を成功に導く有用なツールである.しかし,これらの送達は送達分子の「大きさ」,「種類」を制限し,さらに「機能素子修飾」による操作の煩雑さや失活の恐れなどが懸念される.我々は,これらの問題を解決するDDSとして,「膜融合を介して内封分子をミトコンドリアへ送達するリポソーム」,MITO-Porterを用いた薬物送達戦略を考案した(図4)19–21).
MITO-Porterは膜融合を介してミトコンドリア内部へ分子を送達するため,送達分子の大きさ・種類を制限しない特徴を有している.本戦略を実現するために,単離ミトコンドリアと蛍光共鳴エネルギー転移(fluorescence resonance energy transfer:FRET)を利用した膜融合組成の探索を行った.その結果,膜透過性ペプチドであるアルギニン八重合体(R8)が表面修飾されたdioleoylphosphatidylethanolamine(DOPE)とスフィンゴミエリン(SM)またはホスファチジン酸(PA)から構成される2種のミトコンドリア高融合性リポソーム(DOPE/SM/STR-R8[9 : 2 : 1] or DOPE/PA/STR-R8[9 : 2 : 1]=MITO-Porter)を同定することに成功し21),特許を取得している(特許 第5067733号).これまでに,MITO-Porterを用いて多種多様な分子(タンパク質,酵素,オリゴ核酸,RNA, pDNA,超分子,難水溶性分子など)を細胞ミトコンドリア内部まで送達可能であることを報告している22).現在は,MITO-Porterの開発研究で培ったミトコンドリア分子送達技術を基盤とし,異分野研究者・臨床家とともにがん治療23),細胞治療24),虚血性疾患治療25),遺伝子治療26),などのミトコンドリアDDSを用いた治療戦略のProof of Concept取得に関する自主臨床研究を推進している.本稿では,ミトコンドリアDDSを活用した細胞治療に関連する研究を中心に紹介する.
4. ミトコンドリアDDSを活用した心筋症に対する細胞治療戦略
本邦では,心不全(虚血性心疾患,先天性心疾患などより誘発)はがんに次ぐ死因でありアンジオテンシン変換酵素(ACE)阻害薬やβ遮断薬は限定的な有効性を示すが,心臓移植を除いて根本的な治療法は存在しない.心筋組織は人体の中で最もミトコンドリアを多く含有しており,ミトコンドリア機能障害により発症した心筋症の有効な治療法は存在せず,ミトコンドリアを治療する新たな治療法の確立が期待されている.このような背景のもとDDSを専門とする著者らは,心疾患の診断・治療の経験が豊富な北海道大学病院小児循環器班と連携して「ミトコンドリアを標的とする心筋症治療法の開発」に関する研究を進めてきた.次項から紹介する研究成果は北海道大学病院小児循環器班・医師らと10年の歳月をかけ進めた実績である.
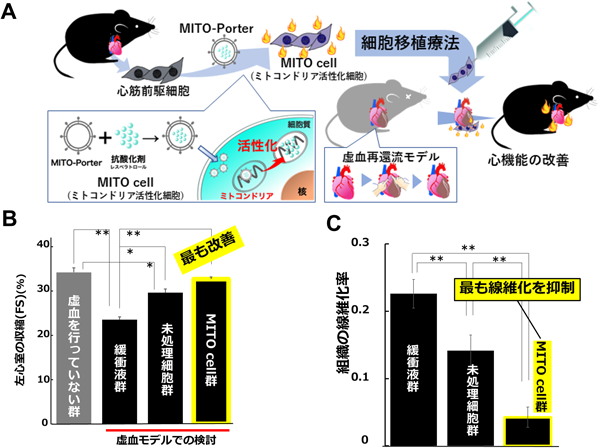
1)細胞治療を加速するミトコンドリア活性化細胞(MITO cell)の創出
ここでは,酸化ストレス発生源であり細胞内ATP産生を担うミトコンドリアを強化した心筋前駆細胞(cardiac progenitor cell:CPC)(MITO cell)を製造し,ドキソルビシン心筋症モデルマウスを用いて細胞移植の治療有効性を検証した実験を紹介する.まず,MITO-Porterを用いてCPCのミトコンドリアに抗酸化能・ミトコンドリア代謝能亢進能を有する機能性分子レスベラトロールを送達し,MITO cellを構築した.このMITO cellを,ミトコンドリア毒性が発症要因の一つとして報告されているドキソルビシン心筋症モデルマウスに移植した.MITO cell移植後に,ドキソルビシンを腹腔投与し継時的に生存率を評価した.ドキソルビシン心筋症モデルは非常に強い毒性モデルであり,未処置群ではドキソルビシン投与7日間で全滅した.従来法であるCPC移植群では治療効果は観察されたが,2週間以内にすべての個体が死亡した.一方で,MITO cell移植群では1か月後において半数以上が生存していることを確認した27).また,ドキソルビシン心筋傷害を誘導した5週間後のマウス心臓の左室短縮率(心機能)を断層心エコー法を用いて評価した結果,MITO cell移植群で左室短縮率が健常群と同程度まで回復していることが確認された27).
2)心筋虚血再灌流障害モデルマウスを用いたMITO cellの治療効果の検証
臨床における心不全モデルとしてより近い,心筋虚血再灌流モデルマウスを作製し,MITO cellを用いた細胞移植の治療効果を評価した24)(図5A).細胞移植の30日後に心臓エコー検査および病理組織切片を作製し評価を行い,細胞移植による治療効果を判定した.心臓超音波検査による心機能評価の結果,MITO cell移植群は,非移植群および未処理のCPC群と比較して有意に左心室の収縮率が改善することを確認した24)(図5B).さらに,心筋繊維化の組織学的評価を行った(図5C).その結果,MITO cell移植群が最も線維化の抑制を認めており,心筋へのダメージを抑制していることが確認された24).これらの結果は,従来のCPC移植と比較し,MITO cellを用いると,移植治療効果が増強することを示している.
MITO cellを用いた細胞治療の臨床応用に向け,①実用化を見据えたヒト細胞を用いた検証,②ミトコンドリア標的型DDS(ナノカプセル)の無菌大量調製を中心に研究を進めてきた.次項ではこれらの研究に関連する成果について紹介したい.
1)ヒト由来の移植用MITO cellの製造
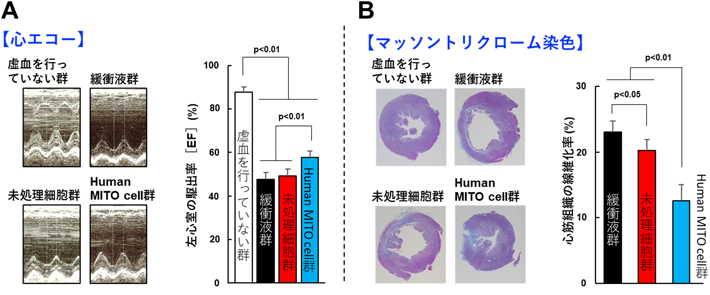
現在,ヒトの心臓から単離した細胞を用いて,ヒト由来のMITO cell(human MITO cell)を作製し,細胞移植治療を行う臨床研究を開始している.本研究では,MITO cellの臨床応用に向けてヒト由来細胞を用いたhuman MITO cellを製造し細胞移植の治療効果を評価した.ヒト心筋前駆細胞(cardiosphere-derived cell:CDC)は先天性心疾患の手術中に切除された余剰心筋から単離し(臨床研究番号016-0507,北海道大学病院),human MITO cellの製造に用いた.製造したhuman MITO cellを虚血再灌流モデルラットに投与し,治療効果を体重変化,心機能,心筋線維化および心筋メタボローム解析を用いて評価した28).
心筋虚血再灌流モデルラットにhuman MITO cellを移植して,細胞移植の4週後に心臓エコー検査および病理組織学的評価を行い,細胞移植による治療効果を判定した.human MITO cell移植は従来の細胞移植と比較して心機能の改善(図6A)と心筋線維化の抑制(図6B)を認めた28).それらの治療効果は,心筋内投与だけでなく静脈内投与でも観察された.さらに細胞移植後4週の心筋をメタボローム解析したところ,human MITO cellの心筋内投与では従来の細胞移植と比較してTCAサイクルに関連するアミノ酸合成が亢進し,解糖系代謝産物の濃度も高いことがわかった.これらの結果は,従来の細胞移植と比較し,human MITO cellを用いると,移植治療効果が増強することを示している.
2)マイクロ流体デバイスを用いたナノカプセルの調製およびミトコンドリアを標的とする抗酸化療法の検証
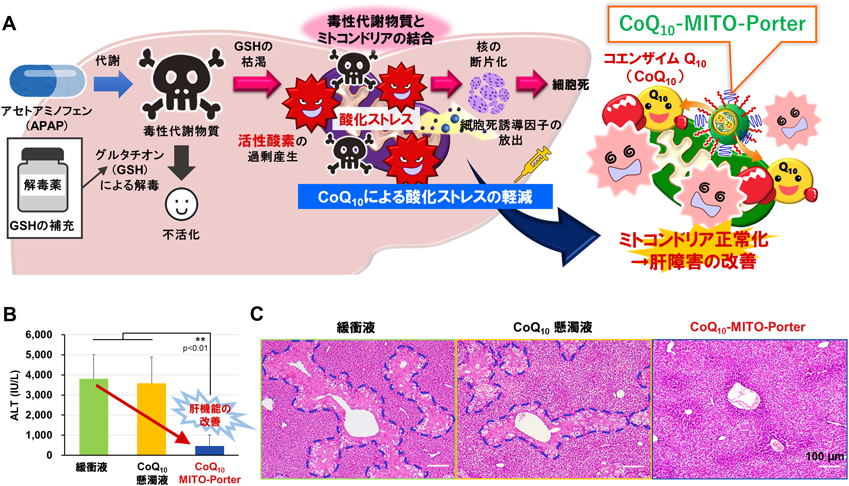
新型コロナウイルスワクチンの副反応に対する薬として推奨された解熱鎮痛剤であるアセトアミノフェン(APAP)の過剰摂取は,重篤な肝障害を引き起こす.APAP肝障害の解毒薬は1種類しかなく,治療開始の遅れが解毒作用の妨げとなり,始動した酸化ストレスを緩和できないことが問題となっている.ミトコンドリアは活性酸素の主要な発生源であり,酸化ストレス応答と密接に関わっているため,APAP肝障害の進行に中心的な存在であると考えられる.酸化ストレスの増大はミトコンドリアの機能を破綻させ,エネルギー産生能の低下や細胞死誘導因子の放出が起こり,細胞死を誘導する.そのため,酸化ストレスの主要な発生源であるミトコンドリアを標的とした新たな抗酸化療法の検証を試みた25)(図7A).
酸化ストレスを緩和する薬はCoQ10を選択した.CoQ10は強力な抗酸化作用を発揮して活性酸素を除去し,ミトコンドリアでのエネルギー産生においても必須の物質であるが,難水溶性であるため,生体に吸収されやすい製剤工夫が必要となる.ナノカプセル製剤は,mRNAワクチンの実用化に貢献した基盤技術であるマイクロ流体デバイス(北海道大学大学院工学研究院の渡慶次学教授,真栄城正寿准教授が開発したiLiNP)を使用して製造方法を構築し,ナノサイズのCoQ10搭載MITO-Porterの構築に成功した(粒子径:約50 nm,ゼータ電位:約10 mV).
APAP肝障害モデルマウスにCoQ10搭載MITO-Porter(0.9 mg/kg CoQ10)を投与し,血液検査と病理組織切片を作成して組織学的評価を行い,治療効果を検証した.肝機能の指標であるalanine aminotransferase(ALT)の検査より,CoQ10搭載MITO-Porter群は緩衝液群およびCoQ10懸濁液群と比較して有意に数値が低下し,肝機能の改善が認められた25)(図7B).緩衝液群およびCoQ10懸濁液群は,血管周辺に肝臓組織の壊死が観察されたが,CoQ10搭載MITO-Porter群は壊死領域が大幅に縮小した25)(図7C).