1. “protein phosphokinase”発見の歴史
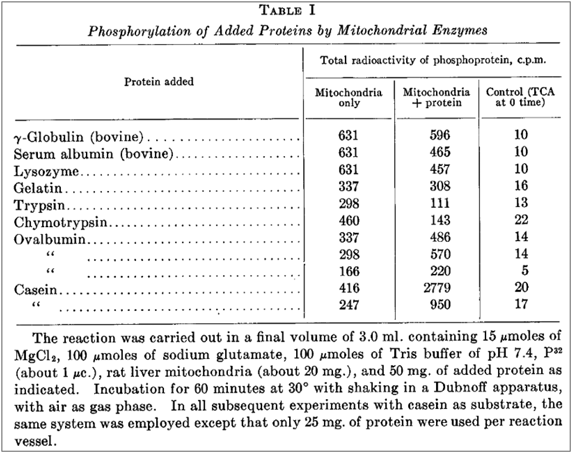
生化学研究の初期において,正常組織だけでなく腫瘍においてもリン酸基を持つタンパク質群の存在が多数あることは見いだされており,さらにリン酸化と脱リン酸化のターンオーバーが速いことが,吉田肉腫,エーリッヒ腹水がんを用いた無機リン(32Pi)取り込み実験から報告されていた1).腹水がんに由来するリン酸化タンパク質からはリン酸化セリンが単離されたが,当初はアミノ酸の一つであるセリン残基へリン酸エステル結合を生じさせるメカニズムとしては,リン酸基転移反応の機序やそれをつかさどる本体は不明なままであった.一方で,カエル卵のタンパク質の間でリン酸基の移行/転移があること,ラット肝臓で酸化的リン酸化反応依存的にタンパク質中のリン酸基が放射性無機リン(32Pi)に置き換わること,また,脱リン酸化反応についてはそれをつかさどる酵素画分の存在することが示唆されていた.このような時代背景の中,米国シカゴ大学Eugene P. Kennedy博士のグループは,1954年に乳清タンパク質カゼインのリン酸化が,ラット肝に由来するタンパク質により,リン酸基供与体としてATPを用いる酵素反応の結果として起こることを初めて明らかにした(図1)2).Kennedy博士らは,放射性無機リン(32Pi),ラット肝ミトコンドリア画分,8種類の精製タンパク質の有無,MgCl2を含む中性溶液中で30°C,60分の反応条件で実験を行った.この条件下で放射性無機リン(32Pi)は肝ミトコンドリア中の酸化的リン酸化反応によって放射ラベル化ATPへと変換され,それぞれの精製タンパク質とミトコンドリア画分との混合または単独での放射性標識差分を定量的に計測した.その結果,ATP γ位の放射性リン酸基が,α-カゼイン中の「酸に安定なセリン水酸基へ移行した」と考察された.一方,フリーのリン酸化セリン共存下でもリン酸化反応は変化しなかったことから,セリンのターンオーバーによる遊離型リン酸化セリン中間体が介在する反応ではないことが示された.セリンが唯一のリン酸化部位ではない可能性がある,と記しながらも,ATPに由来するリン酸化反応をつかさどる“protein phosphokinase”活性を初めて見いだした.論文によると,放射性無機リンは当時シカゴにあったAtomic Energy Commissionから入手したとあり,米国エネルギー省と関係する大型研究機関の拠点の存在もこの発見に貢献したと推察される.
これに遡る1932年,ニューヨーク州ロックフェラー医学研究所(現ロックフェラー大学)P.A. Levene博士の元へ留学していたFritz Lipmann博士は,細胞核内に核酸とは異なる酸性高分子物質としてリン酸化セリンを同定していた.その後1960年に,Lipmannのグループは卵黄中に豊富に存在する高リン酸化タンパク質phosvitinに着目し,それを脱リン酸化処理したものとATP γ位放射性標識体を用いて,酵母とウシ脳からprotein phosphokinase活性がある画分を同定した3).5 mM MgCl2を含む中性溶液中で37°C下15分の反応を行い,塩析,DEAE-セルロースクロマトグラフィー等の手順で回収率2.4%,3000倍まで精製を行った.その結果,phosvitinタンパク質中のリン酸化セリンは膵臓可溶性画分添加による処理時間に対応して,脱リン酸化が起こる可逆的リン酸化反応であること,基質としてphosvitinへの特異性があること等を見いだした.英国のB.E. Lavin博士らもウシ脳灰白質からMg2+濃度依存的“phosvitin kinase”活性を,可溶性画分,核,ミトコンドリアに見いだし,また,ATP/GTPがリン酸基供与体となることを報告した4).Lipmannのもとでは,真野嘉長博士がphosvitinリン酸化酵素に関する論文をJBC誌に報告した5).そのころわが国のJB誌には,リン酸化セリンの存在がわかっていたウシ脳を材料に,Lipmannらの方法に準じてタンパク質へのリン酸化反応を行う酵素を部分精製するなどしてリン酸化酵素反応を検証した論文が,島薗順雄博士(昭和38年度日本生化学会長)によって複数報告された6, 7).また上代淑人博士は島薗順雄博士とともにthiamineへのピロリン酸転移反応についての論文をJB誌で報告した8).西塚泰美博士は同じころLipmannのもとへ留学されており,後年プロテインキナーゼC(PKC)を発見されてからは海外の学会から招聘されるたびに“Father of PKC”と敬意を込めて呼ばれていた9).
生体高分子に作用する酵素の発見としては,Cori夫妻によるグリコーゲン分解酸素glycogen phosphorylaseの結晶化が1943年に成功し1947年のノーベル生理学・医学賞受賞へつながった.活性本体として酵素タンパク質が同定・精製・結晶化された時代背景の中,Kennedyらのタンパク質リン酸化酵素活性の発見を契機に1950年代から60年代にかけては世界的にも各組織からの精製と結晶化が一大潮流となっていたことが推察される.その後さらにリン酸化反応と関連してシグナル伝達の時代が到来することとなり,その筆頭として,グリコーゲン分解酸素glycogen phosphorylaseの活性制御の仕組みがリン酸化反応であることが解明された.1955年Edmond FischerとEdwin G. Krebsにより,glycogen phosphorylase b(不活性型)をa(活性型)に変換する骨格筋由来酵素画分が発見10, 11)され,二価カチオンとATPが必須であることがわかった.さらに,1958年SoutherlandによるセカンドメッセンジャーcAMPの発見,1968年にはプロテインキナーゼA(PKA)の発見を経て,ホルモン支配下のセカンドメッセンジャーを介するリン酸化と脱リン酸化による厳密な制御(「可逆的リン酸化カスケード」)という,新たな生理活性制御の仕組みがようやく明らかにされることとなった.その後,Jacques Monodによるアロステリックモデルの提唱に伴い,酵素の高次構造変化による活性制御の仕組みが次第に検証され,解析機器開発の革新ともいえる先端的高度化技術によって,次々と実証される時代が続くこととなった.ヒトでは現在,518種類のプロテインキナーゼが同定されている.
2. CK2の特性:サブユニット,holo酵素の形成,リン酸化,局在
Kennedy博士らによるタンパク質リン酸化酵素活性の発見の後,カゼインリン酸化酵素の精製は複数の研究室で進められた.カリフォルニア大学Jolinda A. Traugh博士はウサギ網状赤血球可溶性画分からDEAE-セルロースカラムを用いて精製を行い,カゼインを基質としてATP/GTPによりリン酸化する酵素活性画分を見いだした12).それはcAMP-dependent protein kinase(活性測定時の基質はヒストン)活性とは分離される二つのピークとして得られ,最初のピークをCK I,より高濃度のKClで溶出される後ろのピークはCK IIと名づけられた.さらにホスホセルロース,ヒドロキシアパタイトを担体とするカラムクロマトグラフィーを行いCK Iは単一精製標品として,CK IIはヘテロな分子量を有するホロ酵素として精製された.その後,複数組織からの精製とクローニングを経て,1990年に初めてその一次構造が明らかとなった13, 14).一方,乳腺細胞ゴルジ体からはカゼインを基質とする別のリン酸化酵素が見いだされ,これまでin vitro基質に用いられたカゼインはcasein kinase 2の真の生理学的基質ではないことが理解されたことを契機に,カゼインを用いないCK2/CKIIの呼称へと次第に改められた.
各種合成ペプチドを用いた検討から,CK2は主にC末端側に酸性アミノ酸を保持するセリン/トレオニン残基をリン酸化する.がん細胞C2C12でCK2α, CK2α′を同時にノックアウトした解析からも,CK2リン酸化モチーフがpS/pT-x-x-E/D/pS/pTであることが示された15).in vitro活性測定の際は,細胞可溶化物をCK2抗体で免疫沈降した画分に基質配列を有するペプチド(+/−),γ-ATP/Mg2+を加えて反応させP81メンブランへ吸着した基質放射活性として測定する方法が用いられた16).遺伝子クローニングにより酵素サブユニットα(CSNK2A1,391アミノ酸)とα′(CSNK2A2,350アミノ酸)の2種類は異なる遺伝子座に同定され,両者はC末端側の41アミノ酸の有無以外は一次構造上90%の同一性がある.またウシ肺から精製されたβサブユニットは既存タンパク質やドメイン構造等との相同性は低くユニークな一次構造である.CK2タンパク質に対する抗体を用いた組織学的解析とともに遺伝子解析の結果,CK2は真核細胞,組織全般に広く発現がみられることがわかった.また,酵母やマウスの遺伝学的解析によって,CK2α, CK2βは生存,増殖,個体発生に必須の遺伝子であることが明らかになった.ホモCK2αノックアウトマウスは胎性致死(E11.5)で心臓と神経管の発達不全が要因と考えられ,また興味深いことにCK2β発現低下が観察された17).ホモCK2βノックアウトマウスも胎性致死(E7.5)であり18),CK2α′ノックアウトマウスは出生し形態学的異常はないが,雄は精母細胞のアポトーシスによる不稔が報告された19).in vivoでの発現変化については,1980年代にがん細胞株や,初期胚発生の過程における胎性肝でCK2タンパク質レベルの上昇が報告された他,マウス3T3-L1細胞の分化過程における活性上昇とタンパク量の増加も報告された20, 21).CK2は主に細胞質へ局在するが,ミトコンドリアをはじめ,滑面小胞体,ゴルジ体等にも局在が認められる.なお,公共データThe Human Protein Atlas22)等を参照するとCK2は核質に局在すると記載されており,がん組織やがん細胞株から得た知見を掲載していると考えられる.後述のように正常線維芽細胞の同調的静止期においてはCK2の多くは細胞質に局在している.
細胞内ではααββの四量体を形成したホロ酵素が安定かつ最大活性を保持しているが,それより量的には少ないがαα′ββ, α′α′ββの存在も知られており,基質特異性も異なると考えられている.サブユニットの量比は組織によって多様であり,サブユニット独自の機能も予想される.またホロ酵素としての会合によりβはαによってS2, S3がリン酸化される.αサブユニットの飜訳後修飾部位と細胞シグナルの関係は現在までに多数報告されている.細胞増殖と関連して細胞分裂期前期から中期にかけてCDK1がCK2のC末端領域にある四つのアミノ酸T344, T360, S362, S370をリン酸化すること,このうちS347のO-GlcNac修飾はCDK1によるT344リン酸化を競合的に阻害するとともにαは分解されやすくなることが報告された23).その他,PKCがCK2のS194, S277をリン酸化しCK2を活性化すること,ERK2によるT360, TS362リン酸化がCK2によるα-cateninリン酸化を促進すること,Srcファミリー遺伝子であるLyn, FgrによるY255リン酸化,SRMSによるY182, Y188リン酸化の報告がある.さらにチロシンに関してはCK2によるFpr3や,酵母でのヒストンH2A分子内チロシンリン酸化も報告されている24, 25).また,細胞内シグナルと関連して,AKT1によるT13リン酸化がCK2を活性化しTIF-1αリン酸化を介してrRNA発現へ関与することも示された26).筆者は細胞内にはβと会合していないαプールがあること,活性測定の際NaCl至適濃度がmonomeric CK2αとホロ酵素で大きく異なっていること,分子内自己リン酸化が複数あること27)を見いだしている.CK2α自体の翻訳後化学修飾はあまり着目されていないが,筆者は活性制御の観点から今後さらなる緻密な高次構造と活性相関の解明が重要と考えている.
3. pleiotropic kinase CK2によるリン酸化
CK2が他のタンパク質リン酸化酵素と大きく違う点として,リン酸基供与体としてATP以外にGTPも使用できることがあげられる.CK2によるin vitroリン酸化を基質側からみると,ホロ酵素とαサブユニット単独の両方からリン酸化を受けるもの,αサブユニット単独のみでリン酸化されるもの,ホロ酵素のみでリン酸化されるもの,とそれぞれクラスI, II, IIIへと分類される.数百あるいは1000種類近くの基質があるとの報告もあるが,多くはin vitroリン酸化反応によるものであるため,生理的環境を考慮した時間・空間軸等の精密な条件下での検証も求められる.近年,翻訳後修飾部位の検出感度・精度向上等,先端的解析手法を駆使したCK2機能の新知見が報告されてきており,pleiotropic kinaseとも呼ばれる生理機能の分子基盤が少しずつ明らかになってきた.たとえばES細胞,iPS細胞,分化細胞を用いたリン酸化プロテオミクス技術isobaric tagging法によるリン酸化ペプチドの網羅的解析の結果,CMGCファミリーに属するCK2αはpluripotentな性質を持つ細胞では活性化状態にある上流キナーゼの一つと考えられることが示された28).また概日リズムは複数分子の順序立った発現制御による連携が明らかにされているが,CK2はPER2上流のキナーゼとして概日リズム調節に貢献している.CK2発現レベル抑制やCK2阻害剤処理,dominant-negative CK2α発現により,リズム振幅の低下や正常なリズムからの逸脱が示された29, 30).シャペロンタンパク質であるHSP90機能と関連するCDC37リン酸化は宮田愛彦博士により発見され,CK2の生理的基質として活性測定へも用いられている31).核機能との関連では,さまざまなクロマチンリモデリング因子,転写因子等へのリン酸化が重要な役割を果たしているが,たとえばCK2によるheterochromatin protein 1(HP1α)リン酸化は抑制性ヒストンコードであるH3K9meを保持するヌクレオソームへの特異性あるHP1α結合に関与しており,ヘテロクロマチン形成による転写的サイレンシングへ関与する報告がある32).また,CK2によるトポイソメラーゼIIα, NFκB, ATF-1, Fos, Myc, RNAポリメラーゼIIのリン酸化,紫外線照射時のDNA傷害に伴うCK2によるP53リン酸化33),DNA修復への関与34),二重鎖切断に伴うRad51リン酸化35),Condensinリン酸化36)等による正常なゲノム機能の維持管理,その他,遺伝子発現,チェックポイント制御への関与があげられる.アポトーシスシグナルにおいては,CASP9リン酸化により分解を抑制し,本来その分解に起因するアポトーシスシグナルから生存シグナルへの変換に関与するとの報告がある他,マイトファジーへの関与37, 38),ウイルス感染時の活性化も報告された.世界的なCOVID-19感染蔓延が起きた際には,その病態解明と治療を目的とするin vitro感染実験系を用いた研究が多数開始されたが,リン酸化プロテオミクス解析の結果,SARS-COV-2感染はCK2を含む細胞内キナーゼ活性に影響を及ぼし一部の基質リン酸化を増大させること39),また,SARS-COV-2によるVero E6細胞感染実験では感染後48時間以内にCK2阻害薬CX-4945(薬剤名Silmitasertib)を投与するとウイルス力価が激減した,との報告がなされた.それを根拠に,臨床応用の有益性を期待して重症患者に対する安全性評価と介入による前向き探索的な第II相無作為化治験が進められた40).また,プロテオミクス解析による最近の報告からは,疾患病態との関連性が見いだされた.非アルコール性脂肪性肝炎は,メチオニンアデノシルトランスフェラーゼ1a(MAT1A)欠損による病態マウスモデルを作出できる.高エネルギー食摂取によって病状を進行させながらリン酸プロテオミクス解析を実施したところ,発症の前段階から活性化された上流のキナーゼとしてCK2α,次いでAkt1が同定された.高エネルギー食に由来する病態は,MAT1Aによる代謝産物であるSAM投与によって回復することを指標に,病態とリンクするリン酸化基質タンパク質の機能解析を実施した.その結果,ミトコンドリア機能やタンパク質合成経路等の変化が病態増悪と関連することが示唆された41).細胞の置かれた環境に応じて誘導されるリン酸化反応は厳密に制御されているが,生命活動の根幹を担うシグナルの一端へCK2は関与すると考えられる.
CK2遺伝子変異については,2016年にOkur-Chung neurodevelopmental syndrome(OCNDS)という常染色体優性に発現する神経発達障害症候群を対象とするゲノム解析において,遺伝的背景の異なる複数患者に共通するCK2α活性化セグメント領域におけるD175G, K198R変異と,ATP結合領域のR47Q, Y50S変異がCSNK2A1におけるde novoバリアントとして初めて発見された42).その後数年の間に別のコホートからは,D156H, K198R変異などの病態へ寄与するde novo CK2α変異が見いだされた43).その他,ハンチントン病因遺伝子htt発現細胞等の神経変性疾患,糖尿病,心疾患においては,CSNK2発現レベルの変動が見いだされた.生命活動をつかさどるシグナルの適切な管理においてもCK2は重要な役割を担っていると予想される.
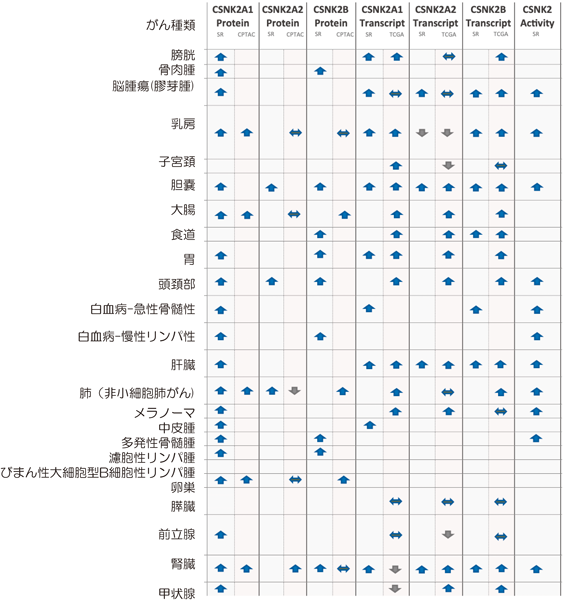
CK2とがんとの関係性については1995年に初めてCK2αトランスジェニックマウス作出による検証がなされた.その37個体のうち9個体がT細胞リンパ腫を発症した44).この研究を端緒として,リンパ腫,頭頚部がん,乳がんなどさまざまながんにおけるCK2 mRNAもしくはタンパク質レベルの発現亢進が報告されてきた.さらに正常細胞ではCK2の多くが細胞質に局在するのに対して,頭頚部がんでは核内発現量が相対的に増える傾向にあること,多種類のヒト固形がん等でCK2 mRNAもしくはタンパク質レベルの増大が予後不良と相関することなどが示された45).その後,がん臨床試料,FFPE(formalin-fixed paraffin-embedded)試料を用いた組織化学染色法や細胞分画による生化学的解析も行われ,核と細胞質における量比について,がんでは隣接する非がん部と比べ核内CK2含量が増大していることが乳がん,その他固形がんでも報告された.既報論文データを集めてデータマイニング手法により,多くの固形がん,血液がんにおける各CK2サブユニットの発現レベルを解析したデータを集積した論文が報告された46).がん予後とも関連づけ,その時点までを網羅するデータ集となった.わが国で見いだされた成人T細胞白血病(ATL)については,426症例を対象とした包括的ゲノム解析によるCK2α, CK2β遺伝子変異が小川誠司博士らにより報告された47).また,組織あるいは細胞全体からの抽出法による解析結果として蓄積されたデータを基に検証を進めた近年の総説48)からもわかるように,患者背景はさまざまではあるががん疾患ではおおむねCK2タンパク質と遺伝子の発現レベルは上昇傾向にあり,活性も上昇していることが示唆された(図2).こうしたがん疾患におけるCK2発限レベル増大と予後不良との関係性が明らかとなった背景のもと,CK2に対するATP競合阻害薬CX-4945を用いて基底細胞がん,髄芽腫,胆管がん,血液がん,腎がん,多発/再発がん等を対象に,単剤または他剤併用による臨床治験が欧米を中心に行われている49), 注2.
5. がん抑制遺伝子産物APC複合体に共存するCK2の発見
再び時代を遡ると,わが国と世界の先駆者たちによる発がんウイルスの研究は,今日知られているがん遺伝子の発見と発がんメカニズムの解明へ多大な貢献をした.ラウス肉腫ウイルスゲノムの一次構造から,ウイルス自体の複製に係る遺伝子に加えて,潜入先の真核細胞をがん化させる原因遺伝子をコードしていることが見いだされた.その本体がチロシンキナーゼ活性を有するという発見50)は世界を驚かせ,霧の中に隠れていた発がんメカニズムとリン酸化酵素活性が初めてリンクし,がん化シグナルの発端を生化学反応として理解し,実験的に再現できる時代が到来した.それとともに,遺伝性がん疾患を罹患する家系を対象とするゲノム解析や,細胞融合の実験から,がん抑制遺伝子機能についての概念が遺伝子単離・同定により実証された.
これ以降はがん抑制遺伝子産物の研究を契機にCK2と関わってきた筆者の研究を交え,現在まで明らかになったことについて概要を記す.当初,家族性大腸腺腫症(familial adenomatous polyposis:FAP)由来細胞を用い,増殖性疾患と関連するイノシトールリン脂質代謝亢進と,キナーゼシグナルの生化学的研究を進めていたが,FAP原因遺伝子APC(adenomatous polyposis coli)51)の分子機能解明へ向けた研究を開始することになり,その遺伝子産物である分子量280,000のAPCタンパク質可溶化条件を検討した.β-オクチルグリコシド,デオキシコール酸等の界面活性剤が適することがわかりウエスタンブロットで解析したところ,正常線維芽細胞で発現する全長APCタンパク質量はわずかであった.一方,FAP疾患に由来する大腸がん細胞や種々の大腸がん細胞株では,ナンセンス変異によりC末端にストップコドンが入った短縮変異型APCタンパク質を,既報の遺伝子変異部位に対応する分子量で検出することができた.興味深いことに,FAP由来がん細胞株をはじめ大腸がんで発現する変異型APCタンパク質はおおむね正常細胞の数倍以上亢進していることも明らかになった.その後,APC親水性領域に対する抗体を作製し免疫沈降法によってさらに感度高くAPCタンパク質を検出する条件を確立した.APC抗体を用いたImmune-Complex Kinase Assayによって,APC複合体には何らかのリン酸化酵素が共存することを見いだし,γ-ATP/GTPリン酸基供与体によるリン酸化反応がヘパリンにより抑制されることを確認し,細胞周期に依存してAPCと相互作用する細胞内キナーゼとしてCK2αを同定した52).細胞周期進行と関連する解析により,両タンパク質は細胞周期後期のG2-M期特異的にAPC N末端領域とCK2αが相互作用し,その結果としてCK2活性はAPCタンパク質によって抑制されることを明らかにした.当時すでに,菊池章博士らによって,変異型APCがWntシグナル分子群と協調してβ-catenin活性化へ関与するメカニズムが検証されていた53)が,筆者らの発見はシグナル非依存的恒常的活性化酵素と考えられていたCK2を抑制する細胞内分子として,APC機能を示す新たな知見となった.
6. CK2による翻訳開始因子eIF5リン酸化が厳密な細胞周期進行に関与
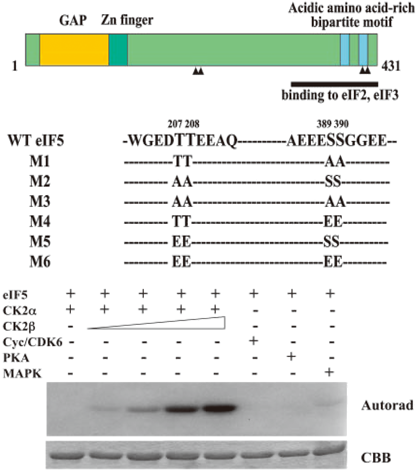
筆者らはさらに正常線維芽細胞の細胞周期を血清飢餓によりG0期へ静止させた後,増殖刺激により同調的に増殖相へ進行させると細胞質に局在するCK2の一部が細胞核へ空間的に移行する現象を捉えた.同時に細胞質においても細胞周期進行に依存して著しくCK2活性が上昇することを見いだした.CK2の細胞周期特異的な標的分子を探索したところ,翻訳開始因子eIF5(真核生物翻訳開始因子の一つ)を同定し,CK2によるeIF5分子内に四つのアミノ酸リン酸化部位を同定した.筆者らはさらに変異体作製による機能解析から,正常な細胞周期進行の厳密なコントロール機序である翻訳開始前複合体(PIC)形成へ向けて,CK2によるeIF5分子のC末端領域(CTD)にあるS389, S390リン酸化が最も寄与することを示し,細胞内でのCK2挙動とリン酸化ターゲットが細胞周期進行と密接に関連することを明らかにした(図3)54).その後eIF5 CTD 2か所のリン酸化については構造解析が進められ,翻訳開始複合体形成へ関与するeIF2βとの相互作用へ資するリン酸化であることが示された55).翻訳は多くのエネルギーを消費する生理機能の一つであり,リボソーム装置が新生mRNAを取り込み開始コドンへスキャニングするまでには,eIF2α, β, γの三量体と,eIF4Fと呼ばれるeIF4A, 4E, 4Gヘテロ三量体が順序立てて形成される必要がある.その上流に位置するmTORC1とCK2が協調して抑制因子PTENを阻害してeIF2βのS2リン酸化を行う一方で,eIF4F形成も促進させることが報告された56).詳細については浅野桂博士によるeIF5の優れた総説があるので参照されたい57).
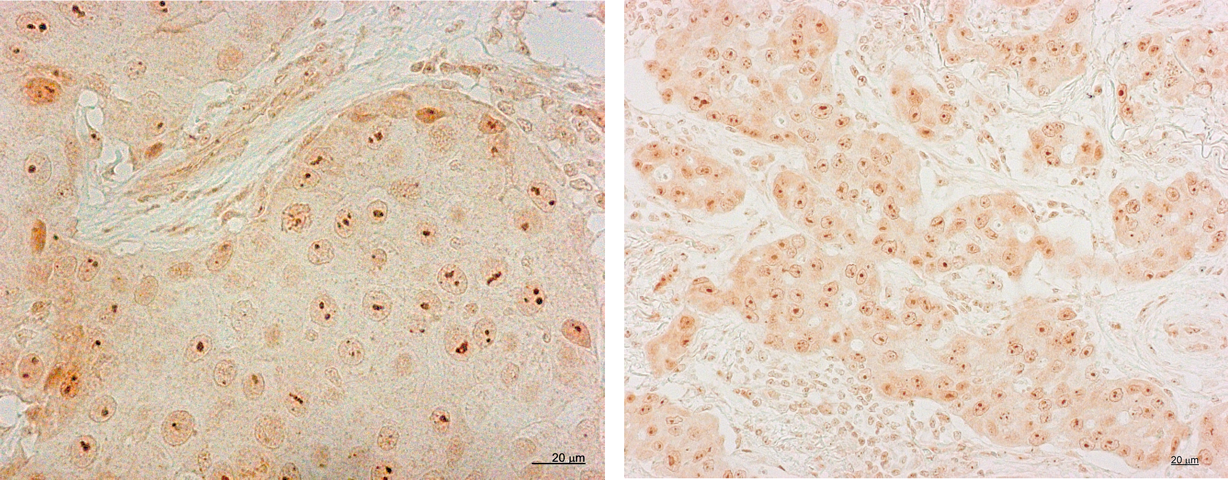
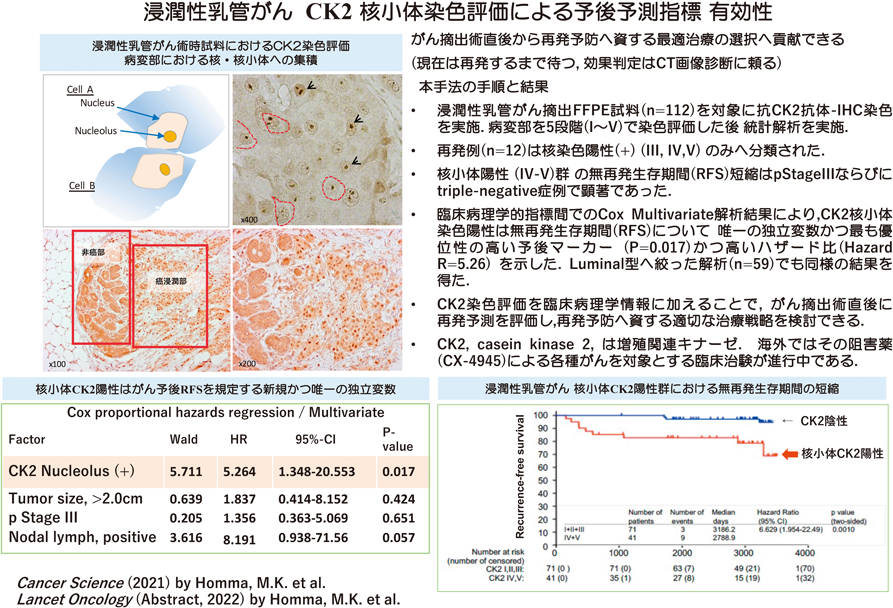
複数のがん種類について細胞質内と比して核内CK2タンパク質量が増加することが報告され,筆者らも正常線維芽細胞の細胞周期を同調的に増殖相へ進行させると,G0期では大部分が細胞質に局在するCK2の一部が細胞核へ空間的に移動する現象を捉えていた.そこでがん等の増殖性疾患におけるCK2細胞内局在と酵素活性の動態を明らかにすべく,星総合病院の野水整博士との共同研究を開始した.特に初発浸潤性乳管がん(IDC)手術時試料に由来するFFPE試料を対象に,抗CK2抗体による組織化学的検討を実施した.染色については,核もしくは核小体での染色について五つのカテゴリーで分類評価した.その結果,IDC112症例の94%で核内CK2染色強度が細胞質に比べ優位に上昇しており,また解析試料全体の37%は核小体でのCK2染色陽性/集積象を示した58)(図4).小さなドット状の陽性像は,乳がんの臨床病理学的指標,すなわち腫瘍径の大きさ,周辺リンパ節への転移数,核悪性度,Ki-67 index等とよく相関しており,特に再発症例のすべてが核小体陽性という点に注目した.そこで,無再発生存期間,無病生存期間とCK2染色評価の関連性についてカプラン・マイヤー解析を行ったところ,CK2核小体陽性症例は術後経年的に再発する例が顕著に多くみられ,術後の予後不良と強く相関した.これら乳がん症例をさらにサブタイプへ細かく分類し比較したところ,トリプルネガティブ型と,臨床ステージ後期に相当するp Stage 3症例では,核小体陽性群の無再発生存期間中央値はおよそ50%まで大きく減少していた.複数の臨床病理学的指標間でのCox多変量解析の結果からは,CK2核小体染色陽性は無再発生存期間について唯一の独立変数(P=0.017)であることと,高いハザード比(hazard ratio=5.26,将来それが起きる指標となる値)が示された.これらの統計解析の結果からCK2核小体陽性は無再発生存期間を規定する唯一の独立変数であり,最も優位性の高い予後マーカーであることが初めて示唆された(図5)58).
乳がん罹患後は,外科的に摘出されたがん部の臨床病理学的な指標(発現するホルモン受容体種類の同定によるサブタイプ分類,病理学的悪性度を判断するための病理組織学的検討,腫瘍径,周辺リンパ節転移の有無,等)を調べた上で,がんとしての病型分類とがん臨床ステージの診断が下される.上記指標以外にゲノム解析によって個々のがん種類に特徴的な遺伝子異常について調べた場合は,臨床学的な指標との総合的判断により治療方針が決定され標準治療が行われる.しかし比較的初期のがんや治療が奏功するがんであっても数年後に主治医も予期せぬ再発が起こる場合がある.長期間のがん細胞休眠(tumor dormancy)を経た晩期再発とも呼ばれ,がん幹細胞がそれに寄与するとも考えられている.現在,将来の再発について確度高い診断法はなく,予測も困難な現状である.手術時試料へ遡った本手法の解析から,“核小体CK2集積は将来の再発と関連する予後マーカー”としての新規性が示されたことは,術直後の早期に再発リスク群を見いだし「より注意深い経過観察対象群」を抽出できる可能性がある.既存の観察手法と病型分類に基づく治療だけでは予想できない「がん再発を待つ」現状から,術後すぐに新たな指標として活用されれば,再発予防の観点から早期かつ新たな治療への一助となると期待される.一方,核小体陰性群は,「念のための治療」を回避できる可能性がある等,染色判定の確度を向上させることで患者側の利益も大きいと考えられる.
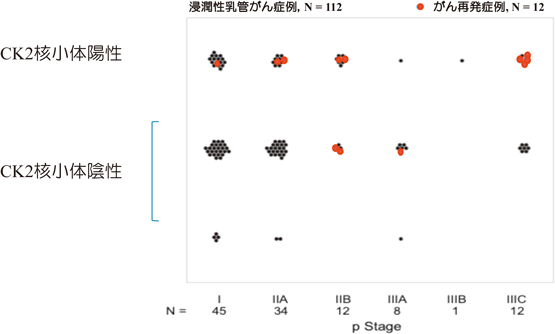
臨床ステージの観点から考察してみると,2009年に診断された乳がんの10年生存率のデータ(国立がんセンター『がんの統計2023』の中の院内がん登録データ閲覧抜粋)にあるように,ステージI期と診断後10年内で亡くなる方は1.1%であるが事前にそれらを抽出できる指標が現時点ではないため再発するまで待たなければならない.本研究の手法では,術時初期ステージ試料からもCK2核小体陽性かつ再発症例を見いだしており,CK2核小体陽性は再発予測指標となることが示された(図6)58).今のところ臨床病期ステージ以外に予後予測因子として強い相関を示すものは知られていないため,この1.1%の将来再発群を見いだすためにCK2はその有力な候補であると考えられる.今後,核小体という限局された空間配置における局在を,客観性ある定量的評価法として開発することが重要と考えられるので,病理組織画像を教師データとして人工知能を活用した画像評価・解析診断支援ツール等の開発を期待したい.また先に述べたトリプルネガティブ型ではCK2核小体陽性と陰性を区別することが治療選択へもつながる可能性があることから,今後さらに検証を重ね,抗がん剤等治療前の患者層別化へ資する科学的基盤を収集したいと考えている.本研究の根拠となった核小体へのCK2集積は正常細胞を対象に研究している限りでは見いだせなかったことから,基礎と臨床の分野を超えた共同研究の重要性を実感している.特に,野水整博士が10年以上フォローする詳細な臨床データとともに分類保管されていた,貴重な臨床試料を活用させていただいた成果と考えている59).
筆者らは本手法の精度化を目指しAMED支援を受けて独自のCK2モノクローナル抗体の樹立を進め,現在,高品質な抗体複数クローンを得ている.それらクローンは独立したCDR配列を有しており,ELISA法,組織化学染色,ウエスタンブロット,免疫沈降法,クロマチン免疫沈降法,ラベリングへ活用可能な汎用性がある.乳がんルミナール型は,発現するホルモン受容体を標的とするホルモン療法のみで寛解する場合が多く,比較的再発リスクの低いサブタイプである.ところが,ルミナール型へ絞った独自抗体による解析を進めたところCK2核小体陽性症例は再発と関連することが示された60).同様に独自抗体を用いた肺腺がん症例の解析についても,CK2核小体陽性症例は無再発生存期間を規定する独立変数であることが統計的に示された(投稿中).以上のように,がん手術時FFPE試料を用いて抗CK2抗体による核小体陽性例を見いだすことが,新たながん予後予測指標として有効である可能性が示された.
今後は各種薬剤治療について,奏功性との関連があるかどうかについて解析を進めるなど,患者個人の反応性をあらかじめ検査する目的で個別化医療の要ともいえるコンパニオン診断への可能性についても検証したい.再発を待たずに予防的治療をできるだけ早期に開始できるよう科学的根拠の解明を進めたいと考える.本手法と抗体の発明については,日本,米国,欧州で特許出願しており,途中の国際段階ではがん再発予測指標としての新規性と進歩性について肯定的評価を受けた.今後は,アカデミア研究者や企業との協力関係に基づいて,本稿で紹介した基本技術の幅広いがん種への展開や,簡便で正確な診断技術としての実用化を推進していきたい.
核内へのCK2集積はがん悪性化と関連する分子機序の一つとも考えられるため,現在その興味深い動態についてメカニズムの解析を進めている.これまでの研究からも,細胞質,核,さらに核小体という,細胞内空間配置の異所性によってCK2を取り巻く環境や,CK2複合体分子群の顔ぶれ,CK2自体の特性,化学修飾等が変化している可能性が考えられた.
TIG-7細胞は(旧)東京都老人医学総合研究所で樹立された正常ヒト由来線維芽細胞で,同調的細胞周期進行の実験に適している.筆者はそれを用いた無機リン(32Pi)パルスラベル実験によって,CK2α自体がリン酸化され活性化されることが核内移行と関連することを見いだしていた.このため,リン酸化プロテオミクス解析によりCK2分子内リン酸化部位を複数か所同定し,変異体を用いた核内移行,酵素活性の検証実験から,S7リン酸化がCK2核移行と活性化へ最も寄与することがわかった.次に核におけるCK2複合体をプロテオミクス技術により解析したところ,細胞核内において細胞周期特異的なCK2と特定機能分子との会合を見いだした.CK2が細胞周期特異的に結合するタンパク質としては,特定の転写因子,RNAポリメラーゼI, II, III,リモデリング因子,RNAヘリカーゼ等が同定され,Gene Ontology解析からは核における新生RNA成熟や遺伝子発現と関連する分子群,タンパク質合成へつながるシグナル分子群(EIF2 signaling)等,遺伝子発現への関与が最も強く示唆された.またCK2複合体分子群には細胞周期特異的な変化があり,つまり時系列ごとにユニークな複合体を形成していることが判明した61).
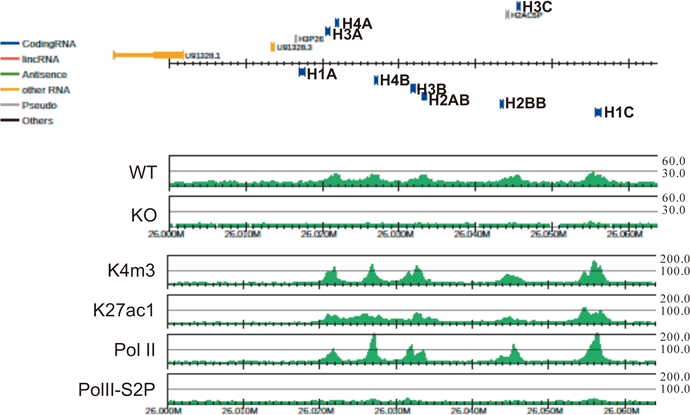
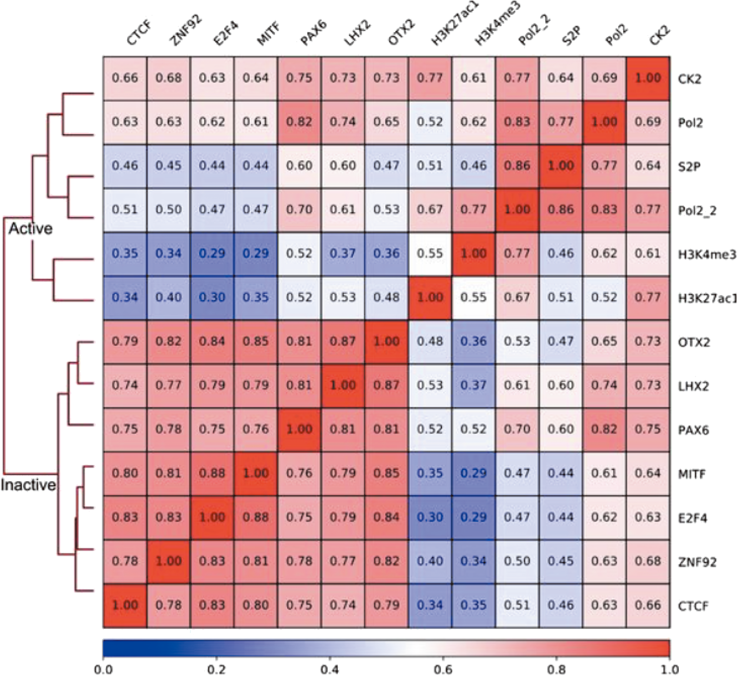
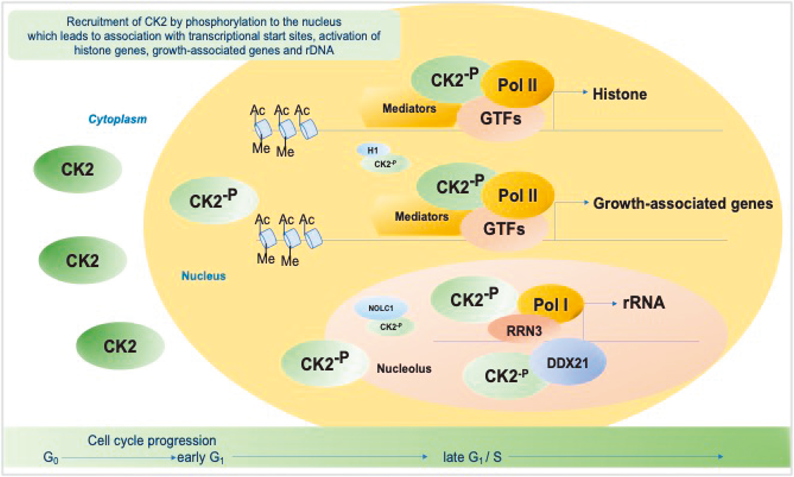
これらの結果について再現性を確認しつつ考察すると,CK2ノックアウト細胞をヒト正常細胞で作製する必然性がでてきたが,これまで解析対象としたTIG-7はL. Hayflick博士が提唱したとおり,正常細胞としての分裂寿命があった.一方,ヒト網膜上皮色素細胞に由来するRPE細胞はhTERTにより不死化されているが正常核型であり,単層培養細胞として接触阻止する正常細胞の表現型を示すため,この目的と細胞周期の研究に適していた.そこでCRISPR/Cas9システムによってCK2αノックアウト細胞(RPE-ko)を作製し,親細胞(RPE-wt)とともに細胞周期進行を同調させた細胞を用いて,抗CK2抗体によるクロマチン免疫沈降実験(CK2-ChIP-Seq)を実施した.その結果,CK2は広範に全染色体上へリクルートされることが観察され,ゲノム上のその分布は,細胞周期がより進行したG1後期の方がG1前期に比べ増大していた.さらに可視化図(図7)でみられるように,転写開始点付近へ結合するヒストンマーカー,RNAポリメラーゼIIの分布とよく一致していた.また,RPE-wtとRPE-ko細胞間で,細胞周期進行に伴い遺伝子発現が変化する遺伝子群と照合すると,増殖期に発現差が増大する上位遺伝子群とCK2-ChIP-Seq解析から得られた遺伝子座がほぼ一致した.その確認のために,細胞周期G1後期におけるゲノム上のCK2分布全体像について,バイオインフォマティクス手法により相関係数を用いた階層的クラスタリング解析を行った.その結果,mRNAへの転写が活発に行われるアクティブな遺伝子領域と,mRNA転写抑制下の不活性な遺伝子領域とを比較すると,CK2は前者グループと似た分布を示すことがわかり,CK2は転写がアクティブな状態にあるゲノム領域の転写開始点(TSS)近傍にリクルートされることを見いだした(図8)61).CK2-ChIP-Seq解析結果から示された遺伝子領域を対象として,CK2-ChIP-qPCRによる発現の検証を進めたところ,細胞周期進行に伴う増殖関連遺伝子,ヒストン遺伝子,リボソーム遺伝子等のアクティブなプロモーター領域近傍でCK2分子がエピジェネティックな転写調節に関与する可能性が示された.CK2がリクルートされるターゲット遺伝子の一つであるヒストンはDNAを格納するヌクレオソームの主構成要素であり,DNA複製前には複数種類のヒストンタンパク質を増産する必要があることが知られている.また,核内プロテオミクス解析と細胞生物学的解析からCK2はリンカーヒストンであるH1各種サブタイプと細胞周期進行に依存して密接に連携していることが観察され,遺伝子発現制御へ協調して関与することも示された(図9).これまでCK2がクロマチンへ結合することは酵母等で見いだされてはいたものの22),ヒト正常細胞を用いた細胞周期進行と関連する詳細な解析は本研究が初めての報告となった.遺伝子発現の場であるゲノムとプロテインキナーゼの連携については,PKC62),EGFR63),ERK64),CDK1165)等が細胞分化のプロセスや増殖因子等の外部刺激下に核内へ移行してゲノム機能を直接コントロールすることが報告されている.また,CK2発現レベルのノックダウンを報告した論文では,ラット心筋由来筋芽細胞株H9c-2へDoxycycline制御下CK2α発現抑制システムを用いたところ,細胞周期G1/S期へ移行する細胞集団比率が若干低下し,発現抑制遺伝子群のトップにMCM6, MCM5, MCM7等のDNA複製開始前複合体(pre-RCs)の形成へ関与する遺伝子群が見いだされた.さらにDNAポリメラーゼε, δ1, α2等の発現低下もみられ,CK2がDNA複製開始へ関与することが示唆されている66).
最後に,CK2と核小体機能との関係について考察する.核小体内フィブラリーセンター(FC)領域にはリボソーム遺伝子(rDNA)数百コピーが格納され,厳密な転写制御によって限定的ゲノム領域での転写が行われている.核小体デンスフィブラリーコンポーネント(DFC)領域ではrRNAのプロセッシングを受け,グラニュラーコンポーネント(GC)領域ではrRNAとリボソームタンパク質とが会合し成熟へのステップが段階的に進められる.さらにその会合体の核質,細胞質への移行とともに,タンパク質合成装置である成熟リボソーム産生へと導かれる.核小体は,いわば生命活動の根幹を担う司令塔としても重要な役割を果たしていることが知られている.核小体を分離精製する手法は1960年代に村松正實博士67),天野實博士68)による多大な貢献により確立された.その後,核小体画分におけるrRNAの成熟プロセスを解明された多くの論文がある69).さらに,2005年にMathias Mann博士は子宮頚がん由来Hela細胞の核小体精製画分の489タンパク質中にCK2を同定しており,actinomycin D処理した場合に核小体と核マトリックス間をflux移動するタンパク質群を定量的に解析するなど,核小体を取り巻く分子群は環境に応じて空間的にもダイナミックな動的再配置を行うことを示した70).Krebs博士らは固相化GST-CK2をbeitに細胞溶解物を解析したところ,核小体タンパク質の一つNopp140がCK2と相互作用することを報告した71).前掲と重複するが,カリフォルニア大学Mitchell博士は,AKT1によるCK2活性化により転写因子TIF-IAがリン酸化され,rRNA発現へ関与すると報告した26).また,nano-secondary ion mass spectrometry(nano SIMS)というケミカルイメージングの手法で細胞内元素分布を調べると[31P]で可視化されたリンは他と比べて核小体に高密度に存在することが示された72).筆者らの解析の結果,CK2はrDNA遺伝子座のプロモーター近傍へもリクルートされることがわかり,その遺伝子発現においてCK2は必須の役割を果たすことが確認された.さらに,がん組織でのCK2核小体集積の知見と関連するメカニズムを解明する目的で,我々のCK2-ChIP-Seqデータと,核小体に局在するとされるRNAヘリカーゼDDX21等についての既報ChIP-Seqデータ73)を基にバイオインフォマティクス解析を行ったところ,rDNA遺伝子座におけるDDX21とCK2αの分布はよく一致していることがわかった.また,ゲノム機能の動的変化へ関与するクロマチンリモデリング因子と呼ばれる複数のタンパク群とCK2が核内で相互作用することを,プロテオミクス解析ならびに抗CK2抗体免疫沈降実験により検証した61).それらの結果は,CK2がrDNAプロモーター近傍にリクルートされると,複数種類の核小体タンパク質と相互作用しrRNA発現とその後のリボソーム産生へと連携する可能性を示していた.従来の知見に加えて,このことはCK2が遺伝子発現へエピジェネティックな関与を行っていることを示唆するとともに,rDNA遺伝子発現の仕組みを,より詳細に理解できたと考えられる.
以上のように,筆者らはCK2タンパク質の細胞核内への移行と蓄積が,個体における乳がん再発が示すがん悪性化と関連することを明らかにしたが,最適かつ早期治療のためには精度高く実用性ある予後予測指標が求められる.私どもが見いだした染色手法については,自動機器染色によるプロトコールの標準化が求められ,染色評価法についても主観的判断を排除できるAI画像判定による評価ツール開発も必要になると考えられる.さらに,治療薬剤奏効性などの経過と関連づけた解析を行うことによって,将来は個別化かつ精密な医療情報へ資する解析手法となることを検証したい.今後,薬剤選択,治療効果予測等,治療方針決定へ本手法が寄与する可能性,コンパニオン診断へ貢献する可能性を検討したいと考えている.
再発群を早期に見いだすことを目的として,がんの遺伝学的解析により,従来は予測不能な再発リスク群抽出への可能性を拓いた研究もある.脳腫瘍の一つである髄膜腫は,完全に切除しても症例の1/5程度が再発し,病理学的再発予測も困難であることが課題である.本症について,テキサス大学のグループは160症例の術即時凍結試料による遺伝子RNA発現解析と,発現コピー数や体細胞変異解析を実施したところ,患者全体が三つのグループへ層別化されることを見いだすとともに,がん予後不良グループに特徴的な一連の機能喪失遺伝子群があることを明らかにした74).gene enrichment analysisから抽出されたそれらはDREAM複合体と呼ばれる分子群LIN52, LIN9, LIN37, LIN54, RBBP4は他の転写因子等と連携して細胞周期へ抑制的に働く.予後不良の髄膜腫グループは細胞増殖指数が最も高いことと合致するという.さらに,肺がんを発症する前から高リスク群を早期予測する血清バイオマーカーを見いだした,との驚くべき論文が英国の産学連携グループにより出版された.解析に使用の抗体種類に限定的な手法ではあるが,抗体で濃縮後にPCRで検出する手法によって特異性と高感度化に優れ,リキッドバイオプシーに求められる定量化解析を成し遂げた成果といえる75).このように新たな科学的手法と緻密なデータ解析によって,個別化かつ精密な医療情報となることを検証して,再発のみならずがん発症自体を確度高く予測し,予防可能とする未来となれば望ましい.発症や再発への不安,過剰な治療を軽減できるメリットも期待される.
一方,CK2の核小体集積の生物学的意義についてはこれからの課題であるが,近年,がん悪性化指標とも呼ばれる核小体肥大化の根拠を示す精密な論文について,最後にご紹介したい.小藤智史博士らは,悪性脳腫瘍では,グルコースからの核酸合成de novo経路に正常細胞とは異なる変化がみられ,イノシン一リン酸デヒドロゲナーゼ2(IMPDH2)作用によるGTP合成が著しく高まっていること,さらにGTP産生を阻害する薬剤を用いた解析から,核小体肥大化の要因がIMPDH2の発現レベルと活性へ依存するGTP合成経路亢進にあること等を解明し報告された76).その阻害薬MPAはT,およびBリンパ球,および前単球細胞への増殖抑制効果により,同種移植片への免疫抑制剤として使用されており,分子機序としては,IMPDH2抑制により,GTPに依存する活性化リンパ球DNA合成期特異的増殖抑制効果を発揮すると考えられている.このため米国では核酸経路を標的とする白血病,リンパ腫等への治療薬候補と考えられた他,脳腫瘍については有効濃度判定等に向けたフェーズ0,I等の臨床治験が行われている.筆者の解析では,IMPDH2は核内CK2複合体要素の一つでもあり,GTPを介するもしくは利用するシグナル軸の接点が見いだせる可能性もあると予想される.
核小体内部から周辺領域を超えて核質へ,さらに細胞質,循環器系にまで至るダイナミックな分子の移動には,結果として疾患要因となるような明確な合目的性を伴うこととなる.真核生物における核の大部分はそれぞれの染色体番号固有のテリトリー(空間配置)が占めるが,核小体はRNAポリメラーゼIによるrRNA合成ならびに翻訳装置リボソームタンパク質生成の場に加え,多様な細胞機能の司令塔として重要な役割を果たしている.すなわちゲノム構造の安定的な維持,DNA修復と再構築,染色体テロメア長の維持,細胞外環境に応答する細胞増殖のon/off,ストレス耐性,不活化分子の隔離と貯蔵等である.これまでの解析から,核内CK2複合体にも核小体機能と関連する分子群が多数見いだされ,特定の遺伝子発現から翻訳へ至る機能連携を効率化させる新たな仕組みもGene Ontology解析から予想された.その機能的集合体要素の定量解析さらに翻訳後化学修飾の解析をさらに詳細に実施し,がん進展と関連するCK2下流の標的分子,あるいは分子会合機序を解明することが望まれる.分子集積や核内分子連携を阻害するなど,今後のCK2を標的とした治療戦略の基盤となることを期待するとともに,キナーゼ研究分野へ興味を持って参画される方々の研究進展を祈りたい.
謝辞Acknowledgments
これらの研究はAMED, JSPS, JST等の科学研究費により実施された.大学院時代は日本生化学会とも深い関係を持たれた永井克孝博士,竹縄忠臣博士に生化学の基本を,医科研では豊島久真男博士,黒木登志夫博士,吉田光昭博士等から分子生物学,がん細胞生物学的観点からご指導をいただくなど,その後の基盤となる学位研究を進めることができた.東京医科歯科大学在職中には,湯浅保仁博士のもとで医学部教育と研究の機会をいただく中でAPC研究を開始するとともに,晩年のEdwin G. Krebs博士の研究室にて3か月の滞在であったがキナーゼ研究の基礎を学ぶ絶好の機会をいただいた.Natalie G. Ahn博士,Kathryn G. Meyer博士,David W. Litchfield博士との長年の知己を得て,研究者として歩む勇気をいただいた.がん試料の解析については星総合病院 野水整博士,福島県立医科大学 橋本優子博士,鈴木弘之博士,等からご指導とご協力をいただいた.科学研究倫理の理解と遵守は研究を進める上で,また研究指導の上でも大変重要であるが,本学で学生とともにdataを共有し真摯に研究を進められる研究環境を堅持し,プロジェクト進行を支援いただいた本間好博士,小林和人博士へ深く感謝する.医学部MDPhDコースを修了された山元想学士(医学)をはじめ,福田みちる,加藤遼,来住野ひなた,松㟢正太郎,各氏が将来,医学研究者として羽ばたきさらに成長されることを心より応援したい.
引用文献References
1) Kennedy, E.P. & Smith, S.W. (1954) The isolation of radioactive phosphoserine from phosphoprotein of the Ehrlich ascites tumor. J. Biol. Chem., 207, 153–163.
2) Burnett, G. & Kennedy, E.P. (1954) The enzymatic phosphorylation of proteins. J. Biol. Chem., 211, 969–980.
3) Ravinowitz, M. & Lipmann, F. (1960) Reversible phosphate transfer between yolk phosphoprotein and adenosine triphosphate. J. Biol. Chem., 235, 1043–1050.
4) Rodnight, R. & Lavin, B.E. (1963) Phosvitin kinase from brain: Activation by ions and subcellular distribution. Biochem. J., 88, 17.
5) Mano, Y. & Lipmann, F. (1966) Enzymatic phosphorylation of fish phosvitin. J. Biol. Chem., 241, 3834–3837.
6) Matsui, H., Orikabe, E., Ishikawa, S., & Shimazono, N. (1965) Studies on phosphoprotein in brain. I. Reactions catalyzed by protein kinase. J. Biochem., 57, 131–141.
7) Orikabe, E., Matsui, H., Ishikawa, S., & Shimazono, N. (1965) Studies on phosphoprotein in brain. II. Phosphorylation of bound phosphopeptide and its isolation. J. Biochem., 57, 346–354.
8) Kajiro, Y., Tanaka, R., Mano, Y., & Shimazono, N. (1961) On the mechanism of transpyrohposphorylation in the biosynthesis of thiamine diphosphate. J. Biochem., 49, 472–476.
9) Takai, Y., Kishimoto, A., Inoue, M., & Nishizuka, Y. (1977) Studies on a cyclic nucleotide-independent protein kinase and its proenzyme in mammalian tissues. I. Purification and characterization of an active enzyme from bovine cerebellum. J. Biol. Chem., 252, 7603–7609.
10) Krebs, E.G. & Fischer, E.H. (1955) Phosphorylase activity of skeletal muscle extracts. J. Biol. Chem., 216, 113–120.
11) Fischer, E.H. & Krebs, E.G. (1955) Conversion of phosphorylase b to phosphorylase a in muscle extract. J. Biol. Chem., 216, 121–132.
12) Hathaway, G.M. & Trough, J.A. (1979) Cyclic nucleotide-independent protein kinases from rabbit reticulocytes. Purification of casein kinases. J. Biol. Chem., 254, 762–768.
13) Litchfield, D.W., Lozeman, F.J., Piening, C., Sommercorn, J., Takio, K., Walsh, K.A., & Krebs, E.G. (1990) Subunit structure of casein kinase II from bovine testis. Demonstration that the alpha and alpha′ are distinct polypeptides. J. Biol. Chem., 265, 7638–7644.
14) Lozeman, F.J., Litchfield, D.W., Piening, C., Takio, K., Walsh, K.A., & Krebs, E.G. (1990) Isolation and characterization of human cDNA clones encoding the alpha and the alpha′ subunits of casein kinase II. Biochemistry, 29, 8436–8447.
15) Borgo, C., Franchin, C., Scalo, S., Besello-Travain, V., Donella-Deana, A., Arrigoni, G., Salvi, M., & Pinna, L.A. (2017) Generation and quantitative proteomics analysis of CK2 alpha/alpha′. Sci. Rep., 7, 42409.
16) Kuenzel, E.A. & Krebs, E.G. (1985) A synthetic peptide substrate specific for casein kinase II. Proc. Natl. Acad. Sci. USA, 82, 737–741.
17) Lou, D.Y., Dominguez, I., Toselli, P., Landesman-Bollag, E., O’Brien, C., & Seldin, D.C. (2008) The alpha catalytic subunit of protein kinase CK2 is required for mouse embryonic development. Mol. Cell. Biol., 28, 131–139.
18) Buchou, T., Vernet, M., Blond, O., Jensen, H.H., Pointu, H., Olsen, B.B., Cochet, C., Issinger, O.G., & Boldyreff, B. (2003) Disruption of the regulatory beta subunit of protein kinase CK2 in mice leads to a cell-autonomous defect and early embryonic lethality. Mol. Cell. Biol., 23, 908–915.
19) Xu, X., Toselli, P.A., Russell, L.D., & Seldin, D.C. (1999) Globozoospermia in mice lacking the casein kinase II alpha′ catalytic subunit. Nat. Genet., 23, 118–121.
20) Sommercorn, J. & Krebs, E.G. (1987) Induction of casein kinase II during differentiation of 3T3-L1 cells. J. Biol. Chem., 262, 3839–3843.
21) Krebs, E.G., Eisenman, E.A., Kuenzel, E.A., Litchfield, D.W., Lozeman, F.J., Lüscher, B., & Sommercorn, J. (1988) Casein kinase II as a potentially important enzyme concerned with signal transduction. Cold Spring Harb. Symp. Quant. Biol., 53, 77–84.
22) The Human Protein Atlas, URL: https://www.proteinatlas.org/ENSG00000101266-CSNK2A1 最終アクセス2024年6月10日.
23) Tarrant, M.K., Rho, H.S., Xie, Z., Jiang, Y.L., Gross, C., Culhane, J.C., Yan, G., Qian, J., Ichikawa, Y., Matsuoka, T., et al. (2012) Regulation of CK2 by phosphorylation and O-GlcNAcylation revealed by semi-synthesis. Nat. Chem. Biol., 8, 262–269.
24) Wilson, L.K., Dhillon, N., Thorner, J., & Martin, G.S. (1997) Casein kinase II catalyzes tyrosine phosphorylation of the yeast nucleolar immunophilin Fpr3. J. Biol. Chem., 272, 12961–12967.
25) Basnet, H., Su, X.B., Tan, Y., Meisenhelder, J., Merkurjev, D., Ohgi, K.A., Hunter, T., Pillus, L., & Rosenfeld, M.G. (2014) Tyrosine phosphorylation of histone H2A by CK2 regulates transcriptional elongation. Nature, 516, 267–271.
26) Nguyen, L.X.T. & Mitchell, B.S. (2008) Akt activation enhances ribosomal RNA synthesis through casein kinase II and TIF-IA. Proc. Natl. Acad. Sci. USA, 110, 20681–20686.
27) Homma, M.K., Shibata, T., Suzuki, T., Ogura, M., Kozuka-Hata, H., Oyama, M., & Homma, Y. (2015) Role for protein kinase CK2 on cell proliferation: Assessing the components of the CK2 complex in the nucleus during the cell cycle progression, in Protein Kinase CK2 Cellular Function in Normal and Disease States, Advs in Biochemistry in Health and Disease (Ahmed, K., et al. eds.), vol. 12, pp. 197–226, Springer International Publishing, Switzerland.
28) Phanstiel, D.H., Brumbaugh, J., Wenger, C.D., Tian, S., Probasco, M.D., Bailey, D.J., Swaney, D.L., Tervo, M.A., Bolin, J.M., Ruotti, V., et al. (2011) Proteomic and phosphoproteomic comparison of human ES and iPS cells. Nat. Methods, 8, 821–827.
29) Tsuchiya, Y., Akashi, M., Matsuda, M., Goto, K., Miyata, Y., Node, K., & Nishida, E. (2009) Involvement of the protein kinase CK2 in the regulation of mammalian circadian rhythms. Sci. Signal., 2, ra26.
30) Smith, E.M., Lin, J.-M., Meissner, R.-A., & Allanda, R. (2008) Dominant-negative CK2α induces potent effects on circadian rhythmicity. PLoS Genet., 4, e12.
31) Miyata, Y. & Nishida, E. (2004) CK2 controls multiple protein kinases by phosphorylating a kinase-targeting molecular chaperon, Cdc37. Mol. Cell. Biol., 24, 4065–4074.
32) Shimada, A., Dohke, K., Sadaie, M., Shinmyozu, K., Nakayama, J., Urano, T., & Murakami, Y. (2009) Phosphorylation of Swi/HP1 regulates transcriptional gene silencing at heterochromatin. Genes Dev., 23, 18–23.
33) Keller, D.M., Zeng, X., Wang, Y., Zhang, Q.H., Kapoor, M., Shu, H., Goodman, R., Lozano, G., Zhao, Y., & Lu, H. (2001) A DNA damage-induced p53 serine 392 kinase complex contains CK2, hSpt16, and SSRP1. Mol. Cell, 7, 283–292.
34) Loizou, J.I., El-Khamisy, S.F., Zlatanou, A., Moore, D.J., Chan, D.W., Qin, J., Sarno, S., Meggio, F., Pinna, L.A., & Caldecott, K.W. (2004) The protein kinase CK2 facilitates repair of chromosomal DNA single-strand breaks. Cell, 117, 17–28.
35) Yata, K., Lloyd, J., Maslen, S., Bleuyard, J.Y., Skehek, M., Smerdon, S.J., & Esashi, F. (2012) PlK1 and CK2 act in concert to regulate Rad51 during DNA double strand break repair. Mol. Cell, 45, 371–383.
36) Takemoto, A., Kimura, K., Yanagisawa, J., Yokoyama, S., & Hanaoka, F. (2006) Negative regulation of condensing I by CK2-mediated phosphorylation. EMBO J., 25, 5339–5348.
37) Kanki, T., Kurihara, Y., Jin, X., Goda, T., Ono, Y., Aihara, M., Hirota, Y., Saigusa, T., Aoki, Y., Uchiumi, T., et al. (2013) Casein kinase 2 is essential for mitophagy. EMBO Rep., 14, 788–794.
38) Chino, H., Yamasaki, A., Ode, K., Ueda, H., Noda, N.N., & Mizushima, N. (2022) Phosphorylation by casein kinase 2 enhances the interaction between ER-phagy receptor TEX264 and ATG8 proteins. EMBO Rep., 23, e54801.
39) Bouhaddou, M., Memon, D., Meyer, B., White, K.M., Rezelj, V.V., Correa Marrero, M., Polacco, B.J., Melnyk, J.E., Ulferts, S., Kaake, R.M., et al. (2020) The global phosphorylation landscape of SARS-CoV-2 infection. Cell, 182, 685–712.e19.
40) https://clinicaltrials.gov/study/NCT0466373/ or identifier: NCT04668209 最終アクセス2024年6月10日.
41) Robinson, A.E., Binek, A., Ramani, K., Sundararaman, N., Barbier-Torres, L., Murray, B., Venkatraman, V., Kreimer, S., Ardle, A.M., Noureddin, M., et al. (2023) Hyperphosphorylation of hepatic proteome characterizes nonalcholoic fatty liver disease in S-adenosylmethionendeficiency. iScience, 26, 105987.
42) Okur, V., Cho, M.T., Henderson, L., Retterer, K., Schneider, M., Sattler, S., Niyazov, D., Azage, M., Smith, S., Picker, J., et al. (2016) De novo mutations in CSNK2A1 are associated with neurodevelopmental abnormalities and dysmorphic features. Hum. Genet., 135, 699–705.
43) https://www.ncbi.nlm.nih.gov/books/NBK581083/ 最終アクセス2024年6月20日.
44) Seldin, D.C. & Leder, P. (1995) Casein kinase II alpha transgene-induced murine lymphoma: Relation to theileriosis in cattle. Science, 267, 894–897.
45) Rabalski, A.J., Gyenis, L., & Litchfield, D.W. (2016) Molecular pathways: Emergence of protein kinase CK2(CSNK2) as a potential target to inhibit survival and DNA damage response and repair pathways in cancer cells. Clin. Cancer Res., 22, 2840–2847.
46) Ortega, C.E., Seidner, Y., & Dominguez, I. (2014) Mining CK2 in cancer. PLoS One, 9, e115609.
47) Kataoka, K., Nagata, Y., Kitanaka, A., Shiraishi, Y., Shimamura, T., Yasunaga, J., Totoki, Y., Chiba, K., Sato-Otsubo, A., Nagae, G., et al. (2015) Integrated molecular analysis of adult T cell leukemia/lymphoma. Nat. Genet., 47, 1304–1315.
48) Strum, S.W., Gyenis, L., & Litchfield, D.W. (2022) CSNK2 in cancer: Pathophysiology and translational application. Br. J. Cancer, 126, 994–1003.
49) https://clinicaltrials.gov/study/NCT02128282/ or identifier: NCT03571438 最終アクセス2024年6月10日.
50) Hunter, T. & Sefton, B.M. (1980) Transforming gene product of Rous sarcoma virus phosphorylates tyrosine. Proc. Natl. Acad. Sci. USA, 77, 1311–1315.
51) Nishisho, I., Nakamura, Y., Miyoshi, Y., Miki, Y., Ando, H., Horii, A., Koyama, K., Utsunomiya, J., Baba, S., Hedge, P., et al. (1991) Mutations of chromosome 5q21 genes in FAP and colorectal cancer patients. Science, 253, 665–669.
52) Homma, M.K., Li, D., Krebs, E.G., Yuasa, Y., & Homma, Y. (2002) Association and regulation of casein kinase 2 activity by adenomatous polyposis coli protein. Proc. Natl. Acad. Sci. USA, 99, 5959–5964.
53) Kishida, S., Yamamoto, H., Ikeda, S., Kishida, M., Sakamoto, I., Koyama, S., & Kikuchi, A. (1998) Axin, a negative regulator of the wnt signaling pathway, directly interacts with adenomatous polyposis coli and regulates the stabilization of beta-catenin. J. Biol. Chem., 273, 10823–10826.
54) Homma, M.K., Wada, I., Suzuki, T., Yamaki, J., Krebs, E.G., & Homma, Y. (2005) CK2 phosphorylation of eukaryotic translation initiation factor 5 potentiates cell cycle progression. Proc. Natl. Acad. Sci. USA, 102, 15688–15693.
55) Paul, E.E., Lin, K.Y., Gamble, N., Tsai, A.W., Swan, S.H.K., Yang, Y., Doran, M., & Marinchev, A. (2022) Dynamic interaction network involving the conserved intrinsically disordered regions in human eIF5. Biophys. Chem., 281, 106740.
56) Gandin, V., Masvidal, L., Cargnello, M., Gyenis, L., McLaughlan, S., Cai, Y., Tenkerian, C., Morita, M., Balanathan, P., Jean-Jean, O., et al. (2016) mTORC1 and CK2 coodinate ternary and eIF4F complex assembly. Nat. Commun., 7, 11127.
57) 浅野桂(2013)開始コドンの厳密な選択とその制御の生物学的意義.生化学,85, 916–923.
58) Homma, M.K., Kiko, Y., Hashimoto, Y., Nagatsuka, M., Katagata, N., Masui, S., Homma, Y., & Nomizu, T. (2021) Intracellular localization of CK2α as a prognostic factor in invasive breast carcinomas. Cancer Sci., 112, 619–628.
59) Lu, S.L., Kawabata, M., Imamura, T., Akiyama, Y., Nomizu, T., Miyazono, K., & Yuasa, Y. (1998) HNPCC associated with germline mutation in the TGF-beta type II receptor gene. Nat. Genet., 19, 17–18.
60) Homma, M.K., Hashimoto, Y., Homma, Y., & Nomizu, T. (2022) CK2α as a prognostic factor in invasive ductal carcinomas of the breast: Cancer recurrence prognosis by surgical sampling. Lancet Oncol., 23, S25.
61) Homma, M.K., Nakato, R., Niida, A., Bando, M., Fujiki, K., Yokota, N., Yamamoto, S., Shibata, T., Takagi, M., Yamaki, J., et al. (2023) Cell cycle-dependent gene networks for cell proliferation activated by nuclear CK2α complexes. Life Sci. Alliance, 7, e202302077.
62) Sutcliffe, E.L., Bunting, K.L., He, Y.Q., Li, J., Phetsouphanh, C., Seddiki, N., Zafar, A., Hindmarsh, E.J., Parish, C.R., Kelleher, A.D., et al. (2011) Chromatin-associated protein kinase C-theta regulates an inducible gene expression program and microRNAs in human T lymphocytes. Mol. Cell, 41, 704–719.
63) Mikula, M., Skrzypczak, M., Goryca, K., Paczkowska, K., Ledwon, J.K., Statkiewicz, M., Kulecka, M., Grzelak, M., Dabrowska, M., Kuklinska, U., et al. (2016) Genome-wide co-localization of active EGFR and downstream ERK pathway kinases mirrors mitogen-inducible RNA polymerase 2 genomic occupancy. Nucleic Acids Res., 44, 10150–10164.
64) Goke, J., Chan, Y.-S., Yan, J., Vingron, M., & Ng, H.-H. (2013) Genome-wide kinase-chromatin interactions reveal the regulatory network of erk signaling in human embryonic stem cells. Mol. Cell, 50, 844–855.
65) Gajdušková, P., Ruiz de Los Mozos, I., Rajecky, M., Hluchy, M., Ule, J., & Blazek, D. (2020) CDK11 is required for transcription of replication-dependent histone genes. Nat. Struct. Mol. Biol., 27, 500–510.
66) Schaefer, C., Doktor, T.K., Frederiksen, S.B., Chea, K., Hlavacova, M., Bruun, G.B., Rabjerg, M., Andersen, B.S., Dominguez, I., & Guerra, B. (2019) Down-regulation of CK2α correlates with decreased expression levels of DNA replication minichromosome maintenance protein complex (MCM) genes. Sci. Rep., 9, 14581.
67) Busch, H., Lane, M., Adams, H.R., Debakey, M.E., & Muramatsu, M. (1965) Isolation of nucleoli from human tumors. Cancer Res., 25, 225–233.
68) Amano, M. (1967) Metabolism of RNA in the liver cells of the rat. I Isolation and chemical composition of nucleolus. Exp. Cell Res., 46, 171–179.
69) Maeda, Y., Hisatake, K., Kondo, T., Hanada, K.-I., Song, C.-Z., Nishimura, T., & Muramatsu, M. (1992) Mouse rRNA gene transcription factor mUBF requires both HMG-box1 and an acidic tail for nucleolar accumulation: Molecular analysis of the nucleolar targeting mechanism. EMBO J., 11, 3695–3704.
70) Anderson, J.S., Lam, Y.W., Leung, A.K.L., Lyon, C.E., Lamond, A.I., & Mann, M. (2005) Nucleolar proteome dynamics. Nature, 433, 77–83.
71) Li, D., Meier, U.T., Dobrowolska, G., & Krebs, E.G. (1997) Specific interaction between Casein kinase 2 and the nucleolar protein Nopp140. J. Biol. Chem., 272, 3773–3779.
72) Decelle, J., Veronesi, G., Gallet, B., Stryhanyuk, H., Benettoni, P., Schmidt, M., Tucoulou, R., Passarelli, M., Bohic, S., Clode, P., et al. (2020) Subcellular chemical imaging: New avenues in cell biology. Trends Cell Biol., 30, 173–188.
73) Calo, E., Flynn, R.A., Martin, L., Spitale, R.C., Chang, H.Y., & Wysocka, J. (2015) RNA helicase DDX21 coordinates transcription and ribosomal RNA processing. Nature, 518, 249–253.
74) Patel, A.J., Wan, Y.-W., AI-Ouran, R., Revelli, J.-P., Cardenas, M.F., Oneissi, M., Xi, L., Jalali, A., Magnotti, J.F., Muzny, D.M., et al. (2019) Molecular profiling predicts meningioma recurrence and reveals loss of DREAM complex repression in aggressive tumors. Proc. Natl. Acad. Sci. USA, 116, 21715–21726.
75) Davies, M.P.A., Sato, T., Ashoor, H., Hou, L., Lioglou, T., Yang, R., & Field, J.K. (2023) Plasma protein biomarkers for early prediction of lung cancer. EBioMedicine, 93, 104686.
76) Kofuji, S., Hirayama, A., Eberhardt, A.O., Kawaguchi, R., Sugiura, Y., Sampetrean, O., Ikeda, Y., Warren, M., Sakamoto, N., Kitahara, S., et al. (2019) IMP dehydrogenase-2 drives aberrant nucleolar activity and promotes tumorigenesis in glioblastoma. Nat. Cell Biol., 21, 1003–1014.
著者紹介Author Profile
 本間 美和子(ほんま みわこ)
本間 美和子(ほんま みわこ)公立大学法人福島県立医科大学医学部生体物質研究部門 准教授.博士(医学).
略歴東京大学大学院医学系研究科修士課程修了(医学修士).同大学院医学系研究科博士課程修了(医学博士).日本学術振興会研究員(DC, PD).東京医科歯科大学医学部文部教官助手.福島県立医科大学医学部助手,講師を経て現職.
研究テーマと抱負生命活動を司るシグナル伝達の根幹を支えるキナーゼについて,細胞核,細胞オルガネラ,それぞれの空間配置と関連して活性制御の仕組みを解明したい.
ウェブサイトhttps://www.fmu.ac.jp/home/biomol/HTML/HommaMK_2024E
趣味読書.梅,橙など身近な果実の収穫と料理.鉢花を毎年咲かせること.