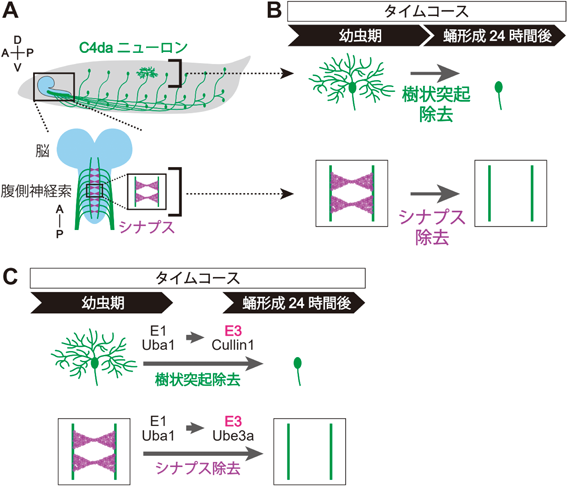
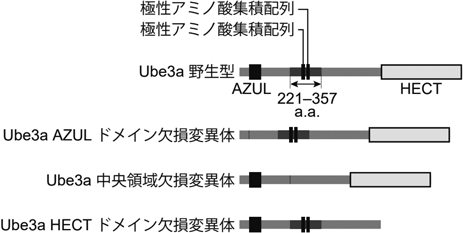
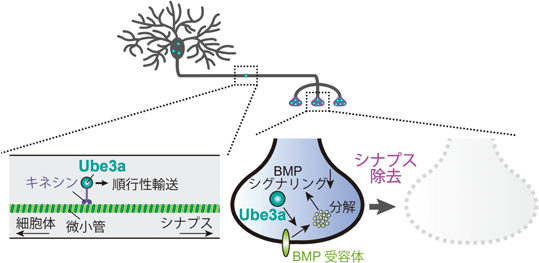
E3ユビキチンリガーゼによる神経コンパートメント除去の時空間制御メカニズムE3 ligases in spatiotemporal regulation of developmental neuronal remodeling
東京大学大学院理学系研究科生物科学専攻脳機能学分野Department of Biological Sciences, Graduate School of Science, The University of Tokyo ◇ 〒113–0033 東京都文京区本郷7–3–1 ◇ 7–3–1 Hongo, Bunkyo-ku, Tokyo 113–0033, Japan