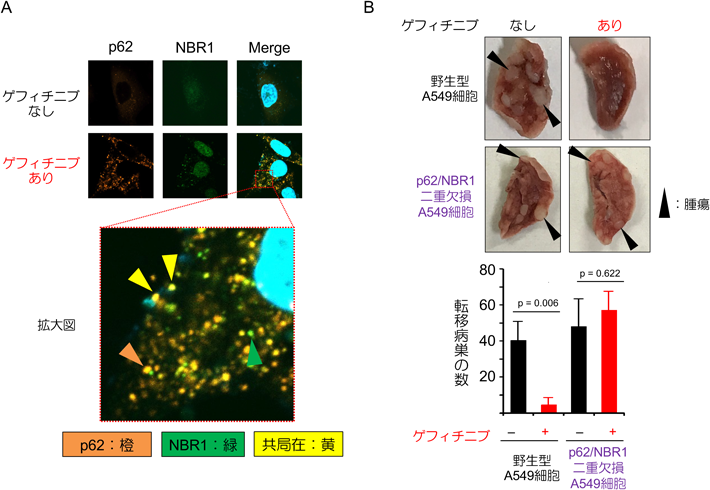
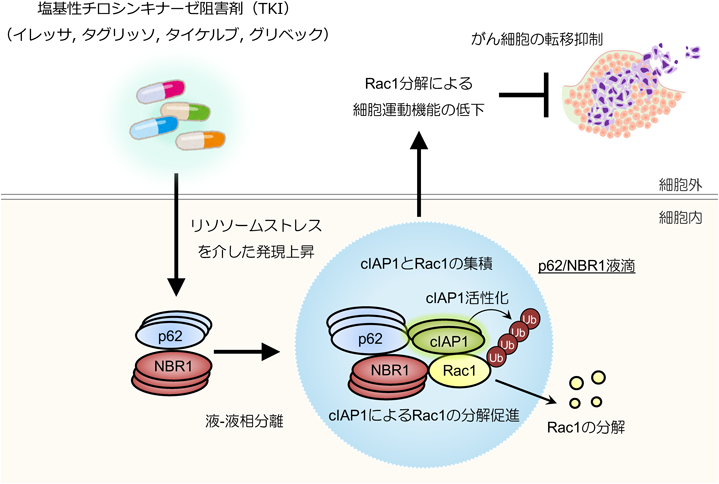
多機能分子p62とNBR1の液–液相分離を介した新規がん転移抑制機構Novel inhibitory mechanisms of cancer cell metastasis through liquid–liquid phase separation of p62 and NBR1
東北大学大学院薬学研究科衛生化学分野Laboratory of Health Chemistry, Graduate School of Pharmaceutical Sciences, Tohoku University ◇ 〒980–8578 宮城県仙台市青葉区荒巻字青葉6–3 ◇ 6–3 Aoba, Aramaki, Aoba-ku, Sendai, Miyagi 980–8578, Japan