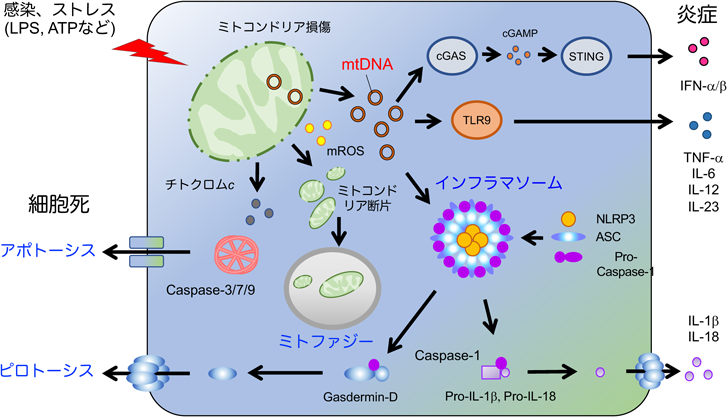
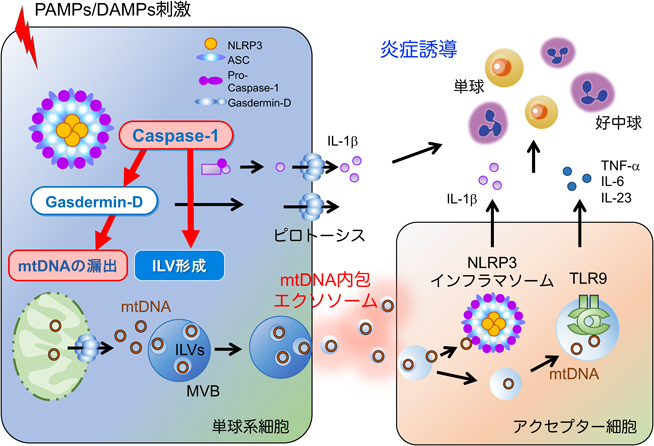
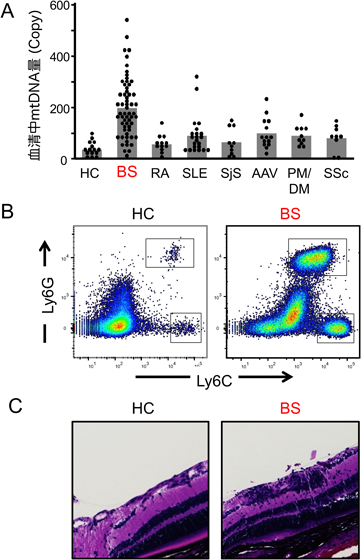
ミトコンドリア損傷によるミトコンドリアDNAの漏出と炎症性疾患Mitochondrial damage-induced mitochondrial DNA leakage and inflammatory diseases
国立病院機構大阪南医療センター臨床研究部免疫異常疾患研究室Laboratory of Autoimmune Diseases, Department of Clinical Research Center for Autoimmune Diseases ◇ 〒586–8521 大阪府河内長野市木戸東町2–1 ◇ 2–1 Kidohigashi, Kawachinagano, Osaka 586–8521, Japan