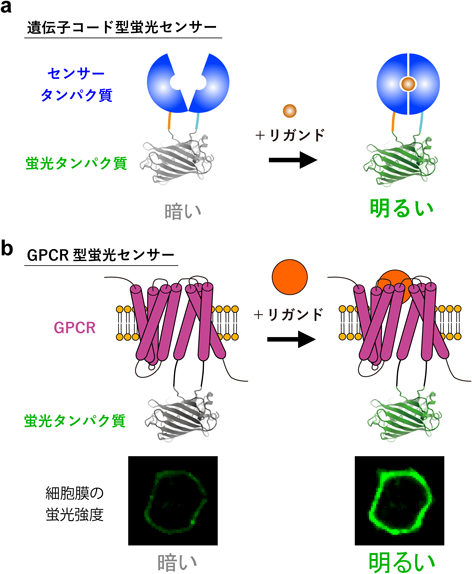
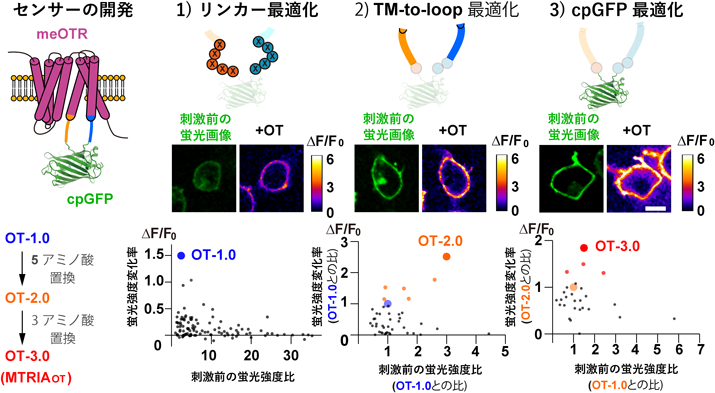
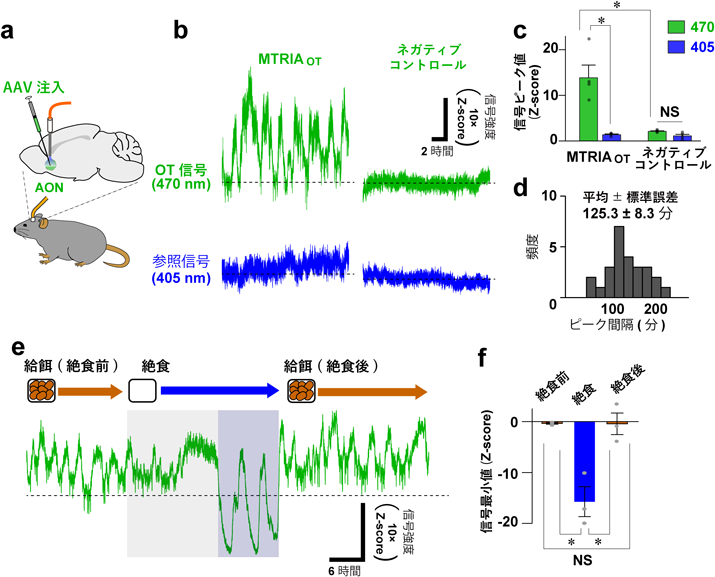
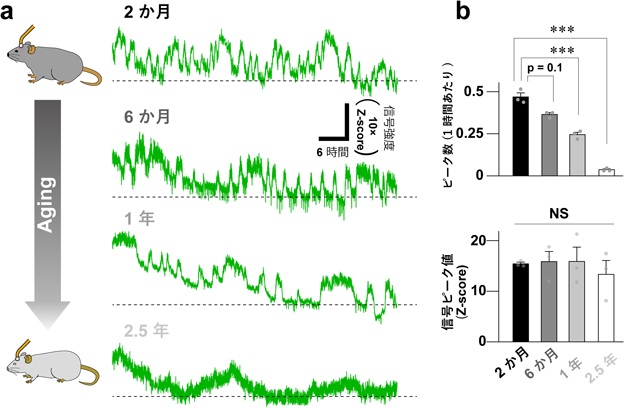
神経ホルモン物質オキシトシンを可視化する蛍光センサーの開発A fluorescent sensor for real-time measurement of extracellular oxytocin dynamics in the brain
大阪大学大学院医学系研究科統合薬理学Department of Pharmacology, Graduate School of Medicine, Osaka University ◇ 〒565–0871 吹田市山田丘2–2 ◇ 2–2 Yamada-Oka, Suita, Osaka 565–0871, Japan