RNAの未修飾ヌクレオシドはアデノシン(A),ウリジン(U),シチジン(C),グアノシン(G)の4種類に大別され,その生理作用については細胞内外においてよく調べられている.たとえばアデノシンは細胞内でエネルギー代謝の中心的な役割を果たす分子の一つであり,ATPの加水分解や双方向性ヌクレオシドトランスポーター,複数の酵素を介して細胞外における濃度が調整されている.ATP, ADP, AMPといったヌクレオチドは細胞のエネルギー通貨として機能し,エネルギーの貯蔵や利用に関与する.これらの分子はAMPK(AMP-activated protein kinase)を介してエネルギーセンサーとして機能し,エネルギー供給と需要のバランスを保つ役割を持つ5).
細胞外では,アデノシンは細胞膜上の受容体に結合してシグナル伝達を介し,免疫応答,血管拡張,心拍数の調整など,さまざまな生理機能を調節する6, 7).特に,アデノシンは抗炎症作用を持ち,炎症性疾患や虚血再灌流障害において保護的な役割を果たすことが示されている8).また,アデノシンの濃度はストレスや傷害に応じて急速に上昇することが知られる9)が,その由来は主に細胞外に放出されたATPの加水分解や双方向性トランスポーターを介したものである.細胞外に放出されたアデノシンはその後,双方向性トランスポーターにより細胞内へ再度取り込まれ,あるいは変換酵素によって速やかにイノシンへと変換されて短時間で定常状態へ戻る10).このように,アデノシンは細胞内外で多機能な役割を果たし,エネルギー代謝や遺伝子発現から免疫調節や炎症応答まで広範な生理的プロセスに関与している.
ウリジンはプリンヌクレオシド・ピリミジンヌクレオシドの中では最も豊富に血中に含まれており11),糖新生やグリコーゲン合成をサポートし,エネルギーバランスを調節する.また,ウリジンは中枢神経系においても重要な役割を担い,神経保護やシナプス形成に関与するとされる12).ウリジンの不足は,発育障害や神経系の異常を引き起こす可能性があり,栄養学的にも重要視される13).ピリミジンのde novo経路(新規合成経路)における律速酵素はジヒドロオロト酸デヒドロゲナーゼであり,この酵素はミトコンドリア内膜上の呼吸鎖複合体IIとIIIの間に位置し,ジヒドロオロト酸のオロト酸への変換を担う.ミトコンドリアDNAを欠失したρ0細胞ではミトコンドリアの電子伝達系が不全となるため,ピルビン酸に加えてウリジンを添加することで生存可能となることが知られ,ウリジンによるミトコンドリア機能向上の可能性が示唆される14).
また従来Toll様受容体TLR7/TLR8はウイルスや死細胞に由来する一本鎖RNAを認識して自然免疫反応を引き起こすことが知られているが,RNAの分解産物としてのヌクレオシドが反応の契機となる機構が近年明らかになった.たとえばTLR7がグアノシンやその誘導体を15, 16),そしてTLR8がウリジンや一本鎖由来の短い分解産物を認識して活性化される17).
以上のように,未修飾ヌクレオシドについては幅広くその機能や調節機構が研究されている.
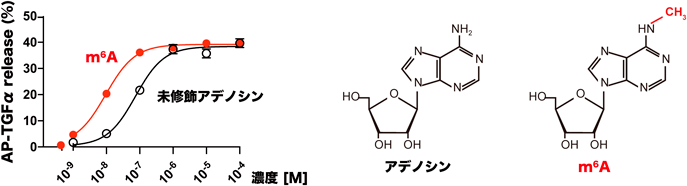
RNA修飾の分解・代謝によって生じた修飾ヌクレオシドは古くからがんや感染症などの病態により量が変動するバイオマーカーとして知られていたが1, 2),その作用については未解明であった.ヒトを含む生物種の体液中にはRNA修飾由来の修飾ヌクレオシドが多種多様に存在しており,たとえばヒト血漿中に存在するヌクレオシドの約半分が修飾ヌクレオシドである.そこで血液中で量の多い修飾ヌクレオシドの受容体活性能を調べたところ,N6-methyladenosine(m6A)がアデノシンA3受容体に対する特異的な活性を有していることがわかり,さらにその活性能は未修飾のアデノシンの約10倍以上も強力であった(図1左).m6Aはアデノシンの6位の窒素原子がメチル化された修飾アデノシンであり(図1右),細胞内のmRNA, rRNA, tRNAなどさまざまなRNAに存在する修飾である.特にmRNA上のm6A修飾は研究が盛んであり,mRNAの局在や安定性,翻訳効率を制御し,造血系や中枢神経系の発達,卵母細胞の成熟や精子形成などの生殖の過程に関わることが知られている18)が,細胞外における生理的意義や機能は不明であった.
アデノシン受容体のサブタイプはA1, A2A, A2B,およびA3の4種類に分類され,すべてが7回膜貫通型Gタンパク質共役型受容体である.A1およびA3受容体の受容体刺激によりアデニル酸シクラーゼが抑制されcAMP産生が低下し,A2AおよびA2B受容体の受容体刺激によりアデニル酸シクラーゼが活性化されcAMP産生が亢進する.今回明らかになったm6Aが活性を持つ受容体はA3受容体であり,ホルスコリン刺激により上昇するcAMPレベルをm6Aが下げていたことからm6Aが受容体を介した新しいシグナル因子であることが示唆された.
未修飾のアデノシンを含む既知のシグナル因子の多くは刺激に応じて量が変動するため,次にm6Aが変動するか調べたところ,細胞障害などの外的刺激が加わった際に,生体や培養細胞でm6Aが特異的に増えることがわかった.この変動は未修飾のアデノシンとは異なるパターンを示し,細胞小器官のリソソーム依存的で,生体内でアデノシンと独立したシグナル応答を惹起している可能性があるといえる.アデノシンA3受容体はアレルギーを含む炎症応答に関わるため,細胞・動物モデルを用いてm6Aの作用を調べたところ,m6AはI型(即時型)アレルギー反応や炎症性サイトカインの産生を誘導しており,この反応は受容体経路に依存していた.
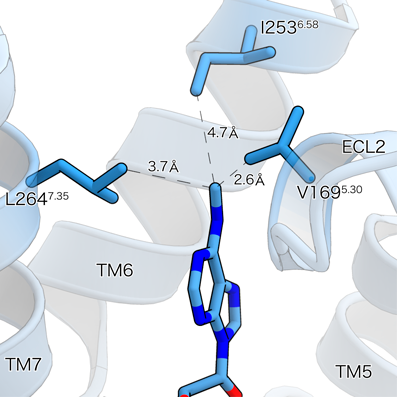
なぜm6Aが特異的な活性能を有するのかをホモロジーモデリングによる予測構造から調べたところ,m6Aのメチル基がA3受容体に存在する疎水性アミノ酸残基と強く分子間力で作用していることを見いだした(図2).さらにこのアミノ酸残基は生物の進化の過程で大きく変動し,配列の相違とm6A活性能が強く相関しており,大型の哺乳動物で特に強い活性を持つことがわかった.すなわちm6AのアデノシンA3受容体活性能は進化的なアミノ酸配列の変化により獲得されたものである可能性が高い.さらに最近,筆者のグループはm6AとA3受容体のクライオ電子顕微鏡による構造解析も行いその相互作用を裏づける報告をしている19).
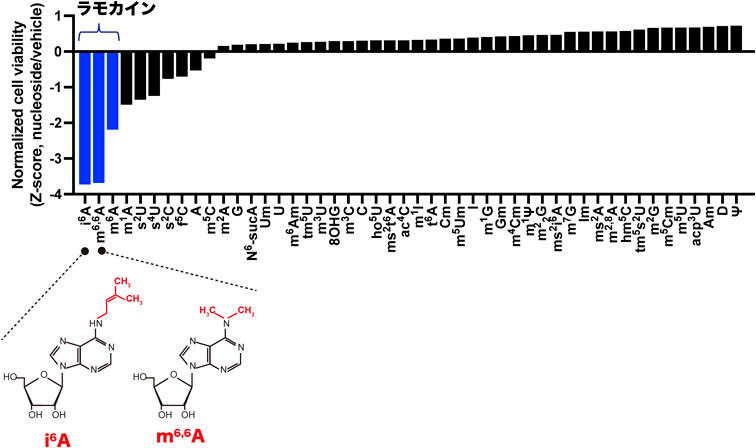
以上により,RNA由来の修飾ヌクレオシドは新たな核酸型液性因子であることがわかったが,さらに修飾ヌクレオシドの機能について知見を得るために筆者らがさまざまな修飾ヌクレオシドをヒト細胞に投与したところ,m6Aを含む3種類のN6位修飾アデノシン[m6A, N6,N6-dimethyladenosine(m6,6A),N6-isopentenyladenosine(i6A)]が細胞毒性を持っていることがわかり,この3種類のN6位修飾アデノシンをラモカイン(Ramokine;RNA modification+kine)と名づけた(図3).
これらのラモカインは通常,血液中に存在する濃度は低く保たれている.また,ラモカインを細胞培養上清あるいはマウスに経静脈的に投与すると,ほかの大部分の修飾ヌクレオシドは安定して存在するがラモカインは短期間に消失することから,ラモカインはほかの修飾ヌクレオシドと異なる代謝・分解機構が存在することが示唆された.
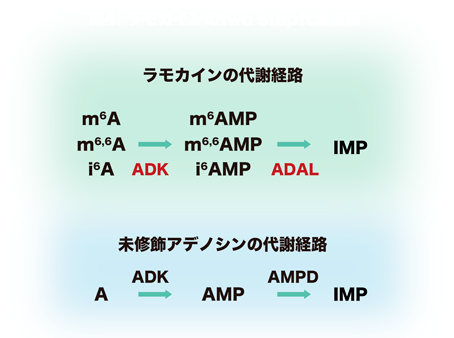
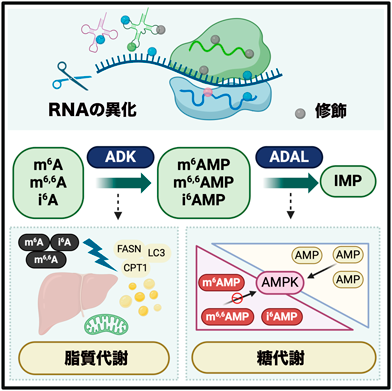
そこで代謝に関連する化合物のスクリーニングを行うことで,ラモカインがADK(adenosine kinase)の新たな基質であること,そしてADKによってそれぞれのモノリン酸化体にリン酸化された後,ADAL(adenosine deaminase-like)によってイノシンモノリン酸(IMP)へと脱アミノ化されてde novo経路やサルベージ経路といった核酸代謝へ合流するという修飾ヌクレオシドの新たな二段階の代謝経路が明らかになった(図4).
興味深いことに,未修飾アデノシンとラモカイン(修飾アデノシン)はどちらもADKの基質となりリン酸化されるが,リン酸化された後は,未修飾AMPはAMPD(AMP deaminase)によりIMPへ,その一方で修飾AMPはADALによりIMPへと脱アミノ化される(図4).ADKは元来未修飾のアデノシンをAMPへとリン酸化する酵素として知られているが,ラモカインへの触媒効率はアデノシンと同等もしくはそれ以上であり,内在性の新たなリガンドが明らかになったことになる.一方でADALは分類上はADA(adenosine deaminase)ファミリーの一種であるが,特に哺乳動物ではその機能についてほとんど明らかになっていなかった20, 21).
そこでADALの機能を調べるためにADALノックアウトマウスを作製して解析を行ったところ,ADALノックアウトマウスは耐糖能異常を示した.ADALノックアウトマウスではADAL以下の経路が機能しないため,その中間代謝体である修飾AMP(m6AMP, m6,6AMP, i6AMP)が蓄積している.そこで耐糖能異常を示すメカニズムとして筆者らはAMPKに着目した.
AMPKは細胞内のエネルギーセンサーとして機能し,飢餓などでAMP/ATP比が大きくなると活性化されて解糖,脂肪酸酸化および糖取り込みを促進しATP産生を亢進させるとともに,糖新生酵素の発現抑制などにより糖新生や脂肪酸合成などのATP消費経路を抑制してATPのレベルを回復させる作用を持つ22).そのためAMPKの活性化は血糖降下や抗肥満作用を示すことが期待される.
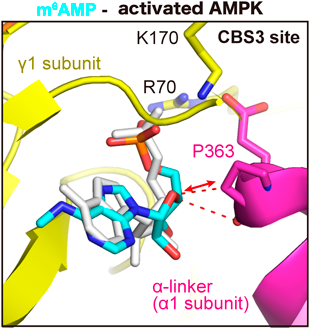
AMPKに対する修飾AMPのホモロジーモデリングを施行した結果,修飾AMPはAMPに対するアロステリックな阻害効果を示すことがわかった(図5).さらに細胞の飢餓時あるいはマウスの絶食時において,AMPKがなく修飾AMPが増えている場合にはAMPによるAMPKの活性化作用が減じており,ADALノックアウトマウスでは修飾AMPが蓄積することでAMPKの活性が落ちることが耐糖能異常を示すメカニズムの一つであると考えられた.
一方でADKはミスセンス変異に伴う欠損症が報告されており,遺伝形式は常染色体潜性(劣性)の遺伝形式をとるまれな先天性代謝異常である.肝障害,奇形,てんかんや発達異常といった重篤な症状を呈し,アデノシン経路の異常に伴う上流の高メチオニン血症とされるが,その詳細なメカニズムはわかっておらず有効な治療法も存在しない23).
これまで報告されているADK変異をADKノックアウト細胞へ入れ戻して各基質に対するリン酸化能を調べたところ,ラモカインリン酸化体である修飾AMPが著明に減少し,対応するように培地中(細胞外)のラモカインは増加していた.また,ADKノックアウトマウスは全個体が生後8日以内に死亡する重篤な表現型を示し,有意なラモカインの上昇がみられた.そこでラモカインとADK欠損症の関連を調べるためにADKノックアウトマウスの肝臓を採取してメタボローム解析およびRNAseqを施行したところ,メチオニン代謝は不変であったが脂質代謝関連遺伝子の大幅な低下が認められ,病態として脂質代謝異常が考えられた.さらに細胞でのエネルギー貯蔵と供給を行う脂肪滴(lipid droplets:LDs)の形成がADK阻害によって減少するが,ラモカインの添加によりさらに減少しており,ADK欠損症やストレス下ではラモカインの蓄積による脂質代謝阻害が主要な病態として示唆された(図6).
このように,細胞はRNA修飾の分解産物の修飾ヌクレオシドのうち毒性を持つラモカインを2段階の代謝で無害なIMPに解毒する経路を有していることが本研究で明らかになった.また,この経路が破綻することで糖質や脂質などの代謝異常が生じうるという修飾ヌクレオシドに起因する新たな病態が明らかになった.